七叶皂苷HK-2细胞毒性的氧化应激机制
张 鑫,袁 兰,杨秀伟,焦士勇,王 旗
(北京大学1.公共卫生学院毒理系,2.医药卫生分析中心,3.药学院天然药物及仿生药物国家重点实验室,北京 100191)
七叶皂苷(aescin)是七叶树(Aesculus chinensis Bge.)或天师栗(Aesculus wilsonii Rehd.)的干燥成熟种子(总称娑罗子)中提取的多种皂苷的总称,主要包括4种成分:A和B为β-七叶皂苷,C和D为α-七叶皂苷,它们有共同的三萜皂苷元母核,由于各自侧链不同而药理活性不同[1]。七叶皂苷具有抗炎、抗渗出、增强静脉张力和抗肿瘤等多种药理活性,在临床上广泛用于烧伤、脑水肿和血管疾病等的治疗[2-4]。但在临床应用中发现,七叶皂苷过量使用可导致急性肾功能衰竭[5],本课题组的体外研究也证实,七叶皂苷对人肾近曲小管上皮细胞具有明显毒性,且不同的组分毒性存在显著差异,而抗氧化剂谷胱甘肽(glutathione,GSH)对七叶皂苷30及60 μmol·L-1引起的细胞损伤具有拮抗作用,提示七叶皂苷可能通过氧化应激途径发挥细胞毒性作用[6]。
为进一步研究七叶皂苷的肾毒性作用机制与氧化应激的关系,本研究以人肾近曲小管上皮细胞(HK-2)为模型检测了七叶皂苷钠(sodium aescinate,SA)作用于细胞后,胞内活性氧(reactive oxygen species,ROS)与抗氧化物质GSH的含量变化,并分别用 GSH合成前体 N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine,NAC)或抑制剂丁硫氨酸亚砜亚胺(L-buthionine-sulfoximine,BSO)控制细胞内的GSH合成状态,进而观察GSH对SA的细胞毒性的影响。
1 材料与方法
1.1 药品与试剂
SA注射剂由山东烟台绿叶制药有限公司生产;D/F12(DMEM∶F12=1∶1)培养基(北京清大天一生物科技有限公司);胎牛血清(美国 MDgenics公司);1∶250胰蛋白酶、四甲基偶氮唑盐(MTT,Amresco)和NAC均购自北京拜尔迪生物技术有限公司;BSO(纯度≥99.0%)购自上海晶纯实业有限公司;谷胱甘肽(GSH)检测试剂盒及活性氧检测试剂盒(DCFH-DA)购自碧云天生物技术研究所;其余试剂为国产分析纯。
1.2 仪器
HERAcell 250二氧化碳培养箱,德国Herus Cell公司;TE2000-S倒置显微镜,DXM1200F数字摄像机,日本Nikon公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;Multiskan MK3型酶标仪,美国Thermo公司;电子精密天平,美国奥豪斯集团;TCSSP2激光扫描共聚焦显微镜,德国Leica公司。
1.3 细胞培养
HK-2细胞购自北京协和医科大学,采用DMEM/F12培养液培养。培养液由D/F12粉配制,另含10%胎牛血清,青霉素100 kU·L-1及链霉素100 kU·L-1。在 CO2培养箱(37℃,5%CO2,恒湿)条件下培养,80%融合后以胰蛋白酶/EDTA消化液消化,3~4 d传代1次,采用对数生长期的细胞进行实验。
1.4 荧光探针法测定细胞内活性氧
取生长融合达80%以上的HK-2细胞,用浓度为0.05%的胰蛋白酶消化液消化,制成单细胞悬液,调整细胞密度为3×105L-1接种至35 mm玻璃薄底培养皿,每皿200μl,于恒湿、37℃和5%CO2培养箱中培养12 h后弃去培养液。细胞分为正常对照,H2O2阳性对照与 SA 10,15,20 和 25 μmol·L-1组,分别在H2O210 min处理及SA处理2 h后弃去皿内上清液,磷酸盐缓冲液(PBS)洗2 遍,以DCFH 10 μmol·L-1稀释液(由不含血清的DMEM/F12稀释)装载细胞,37℃避光孵育30 min后弃去含DCFH培养液,PBS冲洗2遍后加入Hank液,于激光共聚焦显微镜下检测荧光强度(激发波长484 nm,发射波长520 nm),Leica Confocal软件做图像处理,细胞内ROS含量用药组灰度值与对照组灰度值的比值表示。
1.5 DTNB比色法检测细胞内谷胱甘肽含量
取生长融合达80%以上的HK-2细胞,用浓度为0.05%的胰蛋白酶消化液消化,制成单细胞悬液,调整细胞密度为2.5×105L-1,接种至6孔培养板,每孔1 ml,于恒湿、37℃和5%CO2培养箱中培养12 h。
实验分为正常对照,NAC及BSO预处理组:正常对照组加入不含血清的细胞培养液,NAC和BSO组分别加入 NAC 1,5 和 10 mmol·L-1或 BSO 0.5 和2.5 mmol·L-1的无血清培养液,浓度设计参考 Shen等[7]的报道,处理4 h后测定GSH含量;然后加入SA 20 μmol·L-1作用细胞24 h,再测定细胞内GSH 含量。测定方法参照碧云天GSH试剂盒说明书,于405 nm处测定样品及标准品的吸光度值(A405nm)并根据标准曲线计算HK-2细胞的GSH含量。
1.6 MTT法检测HK-2细胞存活
取生长融合达80%以上的细胞用0.05%胰蛋白酶消化液消化,制成单细胞悬液,调整细胞密度为1.5 ×105L-1,每孔200 μl接种于 96 孔培养板。于恒湿、37℃和5%CO2培养箱中培养12 h后弃去培养液。实验分为正常对照组:加入不含血清的培养液;NAC组:加入 NAC 5 mmol·L-1;BSO 组:加入BSO 2.5 mmol·L-1对细胞进行预处理。4 h 后弃去孔内的上清液,分别在上述3个预处理组加入SA 0,10,15,20,25,30 和 40 μmol·L-1,每孔 100 μl,每一浓度组设5个复孔,于恒湿,37℃,5%CO2培养箱中继续培养。
24 h后弃去孔内上清液,每孔加入100μl含有MTT的培养液(0.5 g·L-1),37℃孵育 4 h 后弃去孔内上清液,加入酸性异丙醇(按异丙醇∶1 mmol·L-1HCl溶液体积比96∶4配制),充分震荡混匀后37℃放置30 min,于570 nm处测定吸光度值(A570nm)并计算HK-2细胞的相对存活率,相对存活率(%)=A药物组/A对照组×100%。用 Origin 8.0拟合曲线并计算半数抑制浓度IC50。
1.7 统计学分析
2 结果
2.1 七叶皂苷钠诱导HK-2细胞内活性氧的生成
图1所示为激光共聚焦显微镜下观察的HK-2细胞染色情况,绿色荧光物质为经 ROS氧化的DCF,荧光强度的不同反映了细胞内ROS的含量变化。正常对照组(图1A)荧光强度最低,阳性对照组经H2O2处理10 min后,细胞内的荧光强度明显增高(图 1B,表 1)(P <0.01),SA 12,20和 25 μmol·L-1各组荧光强度也显著高于正常对照组(P <0.01,P <0.05),且随着浓度增加而逐渐增强(图1C ~F)。但SA 25 μmol·L-1的荧光强度较前一组有所减弱,推测可能是ROS含量的增高激发了细胞内的抗氧化反应。

图1 七叶皂苷钠(SA)对HK-2细胞活性氧(ROS)含量的影响.A:正常对照;B:H2 O2;C~F:SA 10,15,20和25μmol·L-1.Fig.1 Effect of sodium aescinate(SA)on reactive oxygen species(ROS)generation in HK-2 cells.
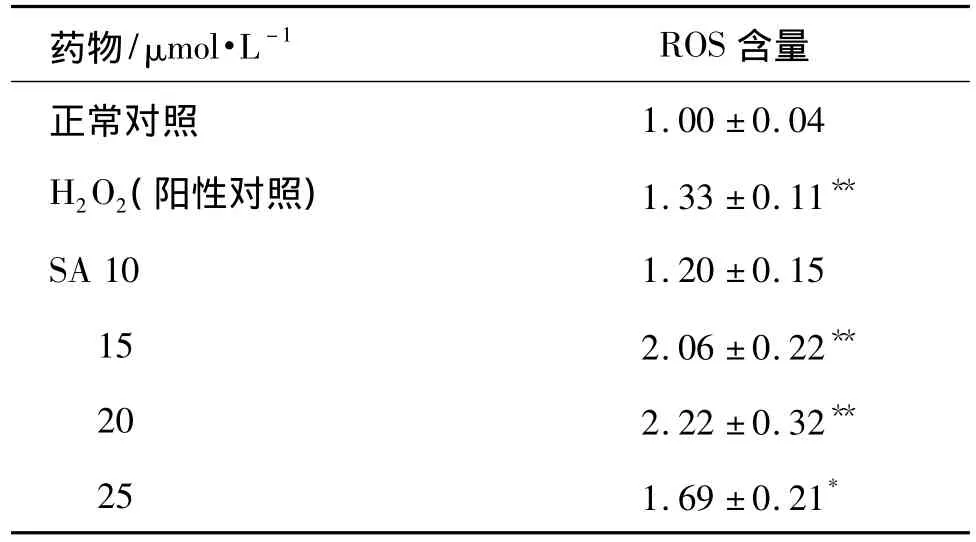
表1 SA对HK-2细胞内活性氧(ROS)含量的影响Tab.1 Effect of SA on ROS generation in HK-2 cells
2.2 七叶皂苷钠对丁硫氨酸亚砜亚胺和N-乙酰-L-半胱氨酸预处理后的HK-2细胞内谷胱甘肽含量的影响
如表 2所示,与正常对照组相比,BSO 2.5 mmol·L-1处理4 h后细胞内 GSH含量显著降低(P <0.05),而 BSO 0.5 mmol·L-1与 NAC 1 和 5 mmol·L-1处理后细胞内的GSH含量与正常对照组相比均无明显差异,说明 BSO 2.5 mmol·L-1处理4 h可有效抑制细胞内 GSH合成。NAC 10 mmol·L-1预处理后细胞内 GSH含量也明显降低(P<0.05),可能与过高浓度的NAC引起细胞毒性作用有关。
经上述预处理后再分别加入SA 20μmol·L-1作用24 h,除 NAC 10 mmol·L-1预处理组外,其余各组在SA作用后细胞内的GSH含量均显著降低(P <0.01)。

表2 SA对N-乙酰-L-半胱氨酸(NAC)和丁硫氨酸亚砜亚胺(BSO)预处理后的谷胱甘肽(HK-2)细胞内GSH含量的影响Tab.2 Effects of SA on glutathione(GSH)content in HK-2 cells after N-acetyl-L-cysteine(NAC)and L-buthionine-sulfoximine(BSO)pretreatment
2.3 七叶皂苷钠对N-乙酰-L-半胱氨酸和丁硫氨酸亚砜亚胺预处理后的HK-2细胞存活的影响
图2结果显示,SA对HK-2细胞有明显的毒性作用,HK-2细胞的相对存活率随药物浓度增加而逐渐降低,SA作用HK-2细胞24 h的IC50为(31.3±1.7)μmol·L-1。BSO 2.5 mmol·L-1预处理后 SA 20,25 和30 μmol·L-1作用细胞的相对存活率分别为(69±6)%,(40±13)%和(25±15)%,显著低于同浓度未经预处理组〔(83±5)%,(69±5)%和(54 ±6)%)〕(P <0.05),IC50值为(23.6 ±2.7)μmol·L-1,与未预处理组相比明显降低(P <0.05)。NAC预处理后各浓度SA的HK-2细胞相对存活率与同浓度未经预处理组相比无显著变化,IC50为(34.2 ±1.5)μmol·L-1,与未预处理组相比无显著变化。
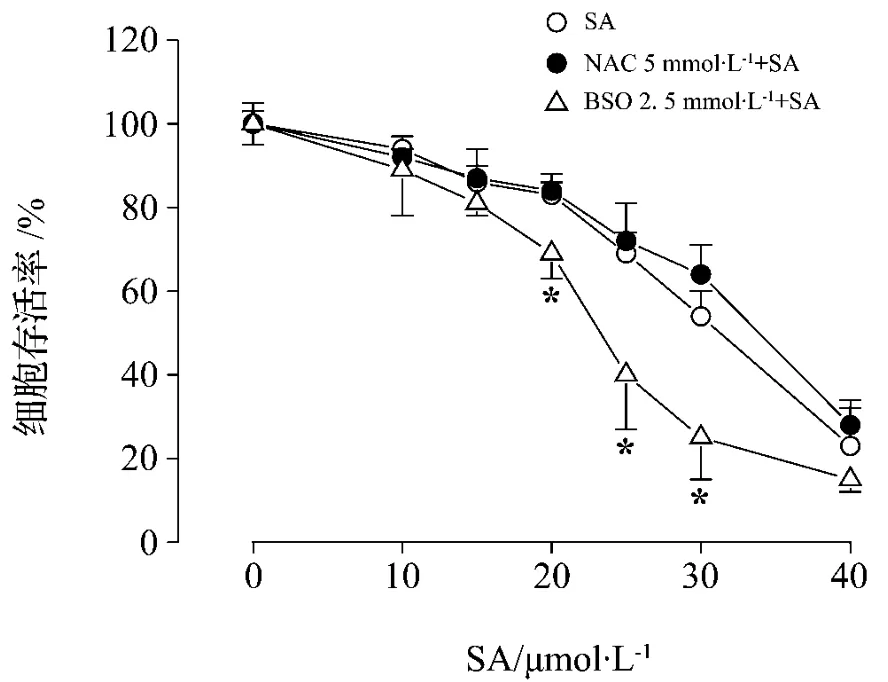
图2 SA对NAC和BSO预处理后的HK-2细胞存活的影响.NAC 5 mmol·L-1或BSO 2.5 mmol·L-1预处理 HK-2 细胞4 h 后加入 SA 20 μmol·L-1作用24 h.细胞存活率(%)=A药物组 /A对照组 ×100%.s,n=3.*P<0.05,与SA组相比.Fig.2 Effect of SA on HK-2 cell survival pretreated with NAC and BSO.
3 讨论
正常生理状态下,细胞内的氧化与抗氧化系统维持动态平衡。但当毒物刺激细胞产生过量的ROS,超过抗氧化系统的代偿能力时,可对细胞造成氧化损伤。肾脏是体内药物代谢、排泄的重要器官,更易受到有毒物质的氧化损伤,因此维持细胞内的谷胱甘肽水平对肾脏细胞抵御外源化学物的氧化损伤有重要作用,当细胞内GSH含量降低不足以维持氧化还原平衡时,可明显增加外源化学物的毒性[8-9]。此外,近曲小管上皮细胞中的一些代谢酶也需要依赖GSH发挥药物代谢与解毒作用。
谷胱甘肽在胞浆内的合成过程分为两步,分别由γ-谷氨酰半胱氨酸合成酶及谷胱甘肽合成酶催化,BSO可通过抑制γ-谷氨酰半胱氨酸合成酶活性显著降低GSH的合成速度,抑制率达90%[10]。本研究采用 BSO 2.5 mmol·L-1与 HK-2 细胞孵育 4 h显著降低了细胞内的GSH含量,在此基础上进行的毒性实验证实GSH含量降低可增加SA 20μmol·L-1的细胞毒性,提示细胞内源性的谷胱甘肽对拮抗七叶皂苷的细胞毒性有重要的作用。
半胱氨酸是GSH合成的底物,其浓度是影响GSH合成速度的决定因素。但在本研究中NAC 1,5和10 mmol·L-1预处理 HK-2细胞,胞浆内的 GSH含量相比对照组并无显著升高,而且 NAC 5 mmol·L-1对SA的细胞毒性亦无显著的保护作用。在本研究中NAC可能未能有效地提高HK-2细胞内的谷胱甘肽合成速度。采用体外分离的大鼠肾近曲小管上皮细胞研究也发现,GSH合成的氨基酸前体5 mmol·L-1与肾近曲小管上皮细胞孵育对胞浆内GSH含量无显著影响,提示近曲小管细胞在氧化应激状况下,合成GSH的主要方式是摄取细胞外的完整GSH而不是通过前体物质合成[11]。而SA促使HK-2细胞内ROS的生成增加,在此状态下,补充NAC不能升高HK-2细胞内的谷胱甘肽含量。
综合上述实验结果表明,七叶皂苷可促进细胞内ROS生成,并加速消耗细胞内的抗氧化物质GSH,通过氧化应激途径发挥细胞毒性作用,细胞内谷胱甘肽可拮抗七叶皂苷的毒性。其细胞保护的机制可能是GSH作为抗氧化剂清除七叶皂苷诱导产生的活性氧,从而减轻其对细胞的损伤。
[1]王绪英.娑罗子中七叶皂苷的提取分离与纯化[J].西北植物学报,2003,23(9):1592-1595.
[2]刘明洁.七叶皂苷钠的临床应用、不良反应及药理学研究[J].时珍国医国药,2005,16(11):1158-1160.
[3]田晓丽.七叶皂苷的药理学研究进展[J].辽宁中医药大学学报,2009,11(5):76-78.
[4]杨秀伟,赵 静,崔景荣,郭 维.七叶树皂苷2Ia的人肠内细菌生物转化产物及其抗肿瘤活性研究[J].北京大学学报(医学版),2004,36(1):31-35.
[5]顾家富,杨继东.超极量应用七叶皂苷钠的肾脏毒性[J].中国实用医刊,2008,35(12):79-80.
[6]沈晓帆,王 旗,杨秀伟,江 芳.七叶皂苷肾细胞毒性及抗氧化剂的拮抗作用[J].中国药理学与毒理学杂志,2008,22(5):375-381.
[7]Shen H,Yang C,Liu J,Ong C.Dual role of glutathione in selenite-induced oxidative stress and apoptosisin human hepatoma cells[J].Free Radic Biol Med,2000,28(7):1115-1124.
[8]Hagen TM,Aw TY,Jones DP.Glutathione uptake and protection against oxidative injury in isolated kidney cells[J].Kidney Int,1988,34(1):74-81.
[9]Lash LH.Role of glutathione transport processes in kidney function[J].Toxicol Appl Pharmacol,2005,204(3):329-342.
[10]Griffith OW,Meister A.Potent and specific inhibition of glutathione synthesis by buthionine sulfoximine(S-nbutyl homocysteine sulfoximine)[J].J Biol Chem,1979,254(16):7558-7560.
[11]Visarius TM,Putt DA,Schare JM,Pegouske DM,Lash LH.Pathways of glutathione metabolism and transport in isolated proximal tubular cells from rat kidney[J].Biochem Pharmacol,1996,52(2):259-272.

