雷公藤甲素急性中毒对大鼠心肌的损伤
王 菡,黄光照,郑 娜,刘 良
(1.三亚市人民医院病理科,海南三亚 572000;2.华中科技大学同济医学院法医学系,湖北武汉 430030)
雷公藤具有抗炎、免疫调节和抗生育等作用[1]。雷公藤甲素(triptolide,TP)是雷公藤的主要有效成分,具有较强的免疫抑制作用[2],并用于抗器官移植排斥反应[3]。但 TP有很高的急性毒性[4],服用中毒早期即可出现心功能障碍的症状,表现为心前区疼痛、血压下降、心律失常,甚至出现顽固性心源性休克而发生急性循环衰竭[5]。本研究ig给予大鼠TP,制备大鼠TP急性中毒模型,观察TP急性中毒大鼠心脏功能的变化和心肌组织病理学改变,探讨TP心脏毒性作用,为TP中毒的临床救治和毒理学研究提供依据。
1 材料与方法
1.1 动物、药品、试剂和仪器
成年SD雄性大鼠60只,体重190~240 g,由华中科技大学同济医学院实验动物中心提供,动物许可证号:SCXK(鄂)2007-0009。TP购自福建省医学科研所,纯度99%;浓缩型小鼠心肌肌钙蛋白(cardiac troponin T,CTn T)单克隆抗体和SP法免疫组化测定试剂盒购自福州迈新生物技术公司。BL-420E+生理功能实验系统由同济医学院病理生理教研室提供。
1.2 雷公藤甲素半数致死量的测定
采用上下增减剂量法[6]测TP的LD50。将每次TP用量及大鼠的结局均输入急性毒性实验统计学软件(AOT425StatPgm),程序自动给出实验的终点剂量。
1.3 动物分组及给药
TP以少量丙二醇溶解,4℃冰箱保存,实验时以生理盐水稀释至所需浓度。大鼠随机分为正常对照组,TP 0.6,1.2 和2.4 mg·kg-1组,每组15 只;TP 一次性ig给予,给药体积为10 ml·kg-1;正常对照组给予等体积生理盐水。实验前大鼠适应性喂养3 d,给予TP前禁食12 h,自由进水,给药后禁食4 h。
1.4 观察大鼠表现及测定心电图
给予TP后动态观察各组大鼠的外观体征、行为活动等一般情况。每组随机取3只大鼠记录心率改变。定时记录Ⅰ导联给药前(记为-1 h)、给药后15,16,18和20 h心电图。连续测量5个心动周期,取其平均值。
1.5 血清肌酸激酶(creatine kinase,CK)和乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测
每组随机取5只大鼠,给药前取血测定血清CK和LDH活性作为自身对照,3 d后ig给予TP,20 h后尾静脉采血,Aeroset全自动生化分析仪检测LDH和CK活性。
1.6 心肌组织病理学观察
给予TP后72h处死大鼠,于心脏右心房下横切取材,制成石蜡切片,HE染色观察。采用全自动彩色图像分析系统,对心肌损伤进行半定量分析。每组9只大鼠,每只3张切片,每张切片放大200倍,随机取4个无重叠视野于镜下观察。将出现心肌细胞肿胀、空泡变性、溶解坏死和收缩带坏死等病理改变的心肌损伤区域圈出,由图像分析系统采集圈出部分的数据,测定每个视野心肌损伤面积占视野总面积的百分比,反映心肌损伤程度。
1.7 心肌超微结构变化的观察
每组随机取2只大鼠,用刀片于心耳下横切面左心室近室间隔处取1~2 mm2心肌组织,2%戊二醛 (pH 7.4,4℃)固定,梯度乙醇脱水,环氧树脂包埋,超薄切片,醋酸铀和柠檬酸铅染色,透射电镜观察超微结构变化。
1.8 免疫组织化学法测定心肌肌钙蛋白分布
按照试剂盒说明书用SP法进行CTn T免疫组化染色。从每组制备的石蜡切片中随机选择10张,经过烤片,脱蜡,梯度乙醇脱水,3%H2O237℃孵育,PBS冲洗,正常羊血清工作液封闭后,滴加抗CTn T抗体4℃孵育过夜,DAB显色。棕褐色为CTn T免疫阳性反应。
1.9 统计学分析
2 结果
2.1 雷公藤甲素的急性毒性
用急性毒性实验统计学软件AOT425StatPgm上下增减剂量法检测结果表明,雄性大鼠ig给予TP,LD50值为 1.19 mg·kg-1,95% 可信区间为 1 ~1.75 mg·kg-1。
2.2 TP急性中毒大鼠一般症状和死亡率
给予TP后5 h,TP 1.2 和 2.4 mg·kg-1组大鼠活动度减低,反应迟钝,食量减少甚至拒食,眼角分泌物增多。TP 2.4 mg·kg-1组大鼠出现抽搐、昏迷、死亡,死亡多发生在给药后16~34 h,死前表现为畏缩不动,潮式呼吸,可持续3~4 h。给予TP后72 h,TP 0.6,1.2 和 2.4 mg·kg-1组大鼠分别死亡 1/15,8/15和14/15。
2.3 TP急性中毒大鼠心率和心电图的改变
给予TP 后15 ~20 h,与对照组比较,0.6 mg·kg-1组大鼠心率无明显变化,1.2 和2.4 mg·kg-1组心率明显减慢(表1);检测心电图发现,TP 3个剂量组均可见S-T段压低、T波高尖、Q波增宽和脱失等心电图改变(图1)。
2.4 TP急性中毒大鼠血清CK和LDH活性
与正常对照组相比,给予TP 20 h后,TP 0.6,1.2 和2.4 mg·kg-1组大鼠血清 CK 和 LDH 活性明显升高(表2),与 TP剂量呈正相关(r值分别为0.95和0.94,P <0.01)。
2.5 TP急性中毒大鼠心肌组织结构的改变
光镜下观察发现,TP 0.6 mg·kg-1组可见灶性心肌细胞水肿(图 2B),TP 1.2 mg·kg-1组心肌细胞肿胀、空泡变性明显(图2C),TP 2.4 mg·kg-1组除可见空泡变性外,还出现细胞溶解坏死和收缩带坏死(图2D)。如表3所示,与正常对照组相比,TP 0.6,1.2和2.4 mg·kg-1组心肌损伤面积百分比明显升高,与 TP 剂量呈正相关(r值为0.80,P <0.01)。

表1 雷公藤甲素(TP)急性中毒对大鼠心率的影响Tab.1 Effect of acute triptolide(TP)poisoning on heart rate of rats
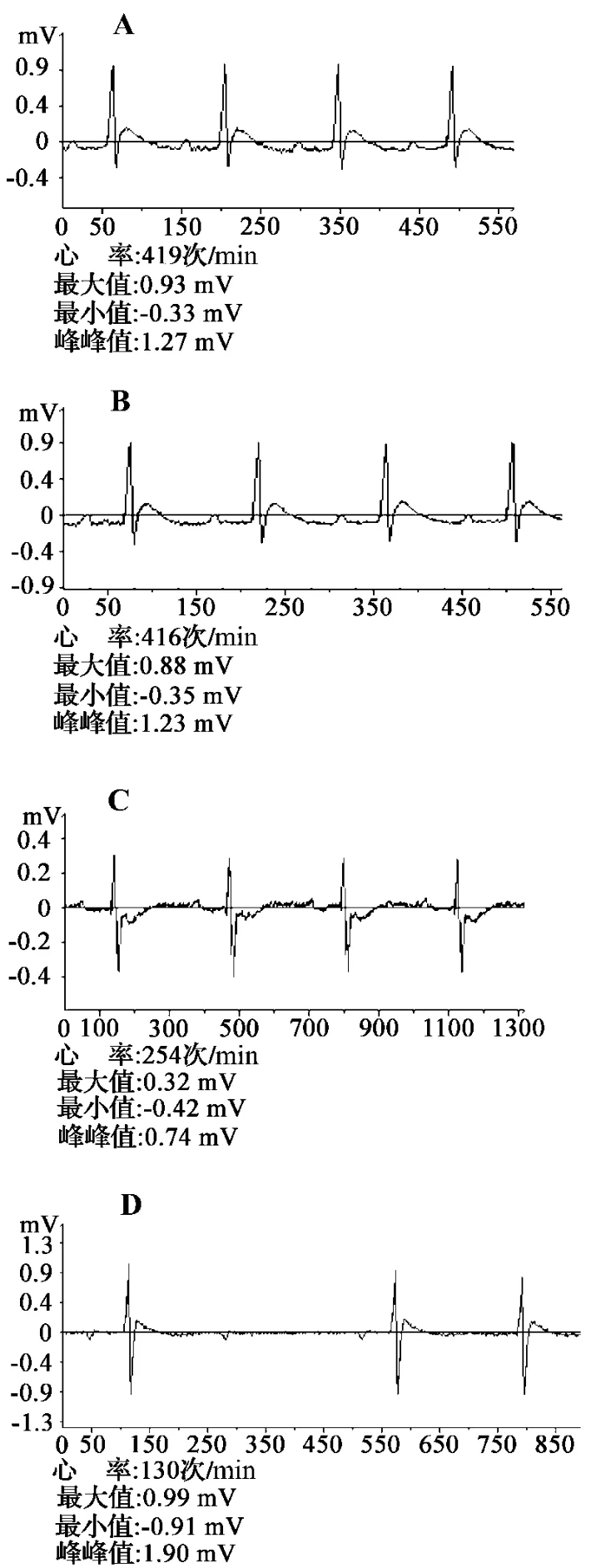
图1 TP急性中毒大鼠心电图的改变.动物处理见表1.大鼠ig给予TP后15~20 h检测心电图.A:正常对照;B,C和D:TP 0.6,1.2和 2.4 mg·kg-1.Fig.1 Electrocardiograms of rats with acute TP poisoning.
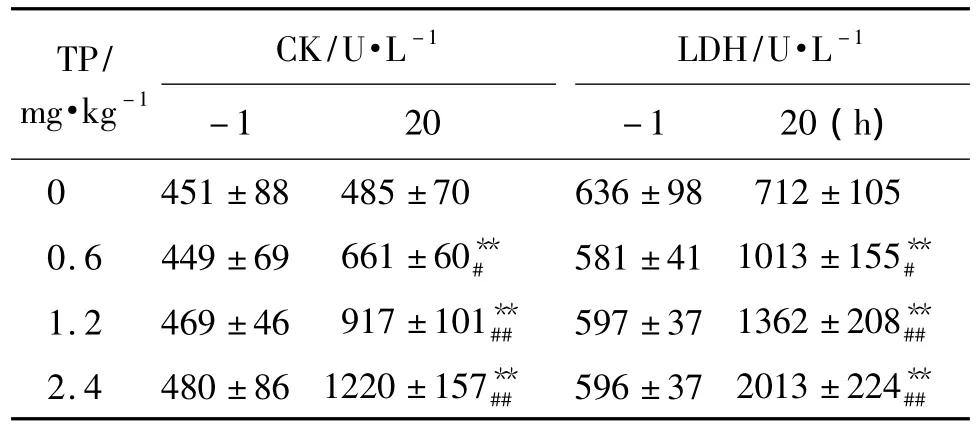
表2 TP急性中毒对大鼠血清肌酸激酶 (CK)和乳酸脱氢酶(LDH)活性的影响Tab.2 Effect of TPacute poisoning on creatine kinase(CK)and lactate dehydrogenase(LDH)activities of rats
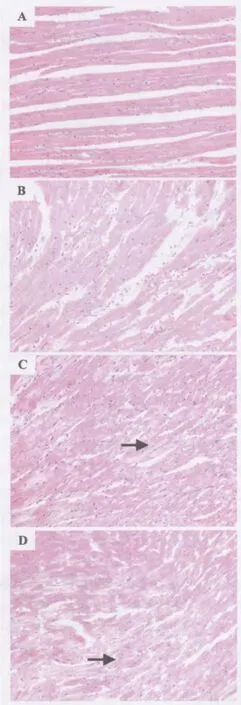
图2 TP急性中毒大鼠心肌组织病理改变(HE×200).动物处理见表 1.A:正常对照;B:TP 0.6 mg·kg-1;C:TP 1.2 mg·kg-1,箭头示心肌细胞肿胀;D:TP 2.4 mg·kg-1,箭头示心肌细胞溶解坏死.Fig.2 Pathological changes in myocardium of rats with acute TP poisoning(HE ×200).

表3 TP急性中毒对大鼠心肌的损伤作用Tab.3 Effect of acute TP poisoning on myocardial damage of rats
2.6 TP急性中毒大鼠心肌超微结构的变化
透射电镜观察发现,TP 0.6 mg·kg-1组可见细胞线粒体轻度肿胀,嵴减少,糖原颗粒减少(图3B);TP 1.2 mg·kg-1组心肌纤维断裂,线粒体明显肿胀,伴空泡样形成,嵴的数目亦明显减少(图3C);TP 2.4 mg·kg-1组肌小节亦有一定程度的断裂,肌原纤维模糊,残存线粒体结构消失(图3D)。
2.7 TP急性中毒对大鼠心肌细胞CTn T表达的影响
如图4所示,正常对照组心肌细胞胞浆内均呈弥漫棕褐色CTnT免疫阳性反应,纵切与横切的心肌纤维中均明显可见,未见灶缺失。TP 0.6 mg·kg-1组灶性心肌细胞胞质内棕褐色颗粒较淡,脱失;TP 1.2 mg·kg-1组局部心肌细胞胞质棕褐色颗粒较淡,少数缺染;TP 2.4 mg·kg-1组心肌细胞棕褐色颗粒缺染区扩大。

图3 TP急性中毒大鼠心肌超微结构的变化.动物处理见表1.A:正常对照;B:TP0.6 mg·kg-1;C:TP1.2 mg·kg-1,箭头示心肌细胞线粒体空泡化;D:TP 2.4 mg·kg-1,箭头示心肌细胞肌原纤维断裂.Fig.3 Effect of triptolide on myocardium ultrastructure by transmission electron microscope.

图4 TP急性中毒对大鼠心肌细胞心肌钙蛋白表达的影响 (免疫组化 ×200).动物处理见表1.A:正常对照,箭头示心肌细胞均呈弥漫棕褐色阳性反应;B:TP 0.6 mg·kg-1;C:TP 1.2 mg·kg-1,箭头示心肌细胞细胞胞质内棕褐色缺染;D:TP 2.4 mg·kg-1,箭头示心肌细胞棕褐色颗粒缺染区扩大.Fig.4 Effect of triptolide on the expression of cardiac troponin T in myocardium(Immunohistochemistry ×200).
3 讨论
有报道部分服TP者可见传导阻滞、结性逸搏、S-T段下降、T波倒置等心脏受损的心电图表现[7]。本实验显示,给TP后大鼠自发活动减少、共济失调、呼吸抑制,出现明显的心电异常,与临床报道的心肌损害特征相似。
本实验观察到一次性给予TP后,大鼠血清心肌CK和LDH水平明显升高,呈现对TP的剂量依赖;心肌损伤面积也随TP剂量的增加而加大。提示TP的急性心脏毒性具有剂量相关性。HE染色结果显示,TP所致急性心肌损伤的病理学改变以心肌细胞肿胀,空泡变性为主,心内膜下心肌改变最明显,病变较重者全层心肌均可见。心肌的溶解坏死,病变范围和程度随着TP剂量的增加而加重。大剂量下还观察到不同程度收缩带坏死,轻者仅见于心外膜下心肌,重者心外膜、内膜下心肌均可见,呈条带状、结节状分布。心肌收缩带坏死又称为凝固性肌溶性坏死,被认为是心肌急性缺血的形态学特征[8],在其他中药急性中毒的心肌也可观察到[9]。给予TP后16 h,大鼠即出现明显的心电异常,心动过缓、S-T段改变、Q波增宽、Q波缺失等心电图表现,可能与TP造成急性心肌缺血,循环衰竭有关。
从超微结构看,TP造成的心肌细胞损伤以线粒体的变化最明显。线粒体是心脏毒性常见的亚细胞靶点。Su等[10]报道 TP处理组的 Lewis肺癌细胞(LLC)染毒后4 h即可检测到细胞线粒体转换孔开放,线粒体膜去极化以及ATP生成障碍。本实验观察到TP中毒的心肌细胞早期即可出现线粒体肿胀,基质密度降低,剂量增大时可出现嵴紊乱、断裂,线粒体空泡化,结构消失。由于线粒体结构和功能的改变,可以影响细胞呼吸链电子传递,使氧化磷酸化异常。而细胞能量代谢障碍,可加重细胞内ATP耗竭,使依赖ATP的离子泵和钙转运调节过程失调,导致细胞主动运输障碍而引起细胞肿胀、空泡变性直至溶解坏死。
大鼠心肌CTn T免疫组化显示,较高剂量TP引起心肌细胞中CTn T明显缺失。CTn T是心肌的结构蛋白,也是一种检测心肌损害高敏感和特异性标志物[11]。当心肌细胞损伤时,细胞膜破裂,胞浆内游离CTn T释放,若损伤进一步加重,则CTn T与肌原纤维分离并持续释放入血。Chen等[12]报道,TP之所以能够使调控细胞骨架的基因B1247008以及调控铁传递蛋白受体的基因BC054522表达上调,与TP破坏细胞骨架损伤细胞膜有关。由此可见,TP所致心肌损伤出现CTn T缺失可能与细胞膜性结构破坏有关。由于CTn T是维持心肌细胞正常收缩耦联的关键蛋白[13],CTn T缺失也意味着该区域心肌纤维结构毁坏,心肌功能丧失[14]。
综上所述,TP的急性毒性与急性心肌损伤密切相关,且具有剂量相关性。心肌超微结构改变和CTn T缺失提示TP的心肌损伤作用可能与线粒体损伤、细胞膜破坏有关。
[1]Tao X,Lipsky PE.The Chinese anti-inflammatory and immunosuppressive herbal remedy Tripterygium wilfordii Hook F[J].Rheum Dis Clin North Am,2000,26(1):29-50,viii.
[2]Liu Q,Chen T,Chen G,Li N,Wang J,Ma P,et al.Immunosuppressant triptolide inhibits dendritic cell-mediated chemoattraction of neutrophils and T cells through inhibiting Stat3 phosphorylation and NF-kappaB activation[J].Biochem Biophys Res Commun,2006,345(3):1122-1130.
[3]First MR,Fitzsimmons WE.New drugs to improve transplant outcomes[J].Transplantation,2004,77(9 Suppl):S88-S92.
[4]Wang J, Xu R, Jin R,Chen Z,Fidler JM.Immunosuppressive activity of the Chinese medicinal plant Tripterygium wilfordii.Ⅰ.Prolongation of rat cardiac and renal allograft survival by the PG27 extract and immunosuppressive synergy in combination therapy with cyclosporine[J].Transplantation,2000,70(3):447-455.
[5]陈远辉.急性雷公藤中毒致心源性休克3例报告[J].福建医药杂志,1996,21(3):56-57.
[6]OECD/OCDE.OECD Guildeine for the Testing of Chemicals.Acute Oral Toxicity:Up-and-Down Procedure.425.Adopted:21st Sept,1998,1-6.
[7]李瑞林,舒达夫.雷公藤的研究与临床应用[M].北京:北京科学技术出版社,1989,152-153.
[8]王慧君,刘 冰,武忠弼.横肌肌收缩带在法医病理学诊断中的意义[J].法医学杂志,1998,14(3):132-134.
[9]李 玲,黄光照.急性天花粉中毒尸检二例[J].同济医科大学学报,1990,19(6):417-418.
[10]Su Y,Yang S,Xiao Z,Wang W,Okunieff P,Zhang L.Triptolide alters mitochondrial functions[J].Adv Exp Med Biol,2007,599:139-146.
[11]周宗灿.毒理学教程[M].北京:北京大学医学出版社,第3版,2006:458-459.
[12]Chen Y,Zhang XM,Han FM,Du P,Xia QS.Gene expression profile analyses of mice livers injured byLeigongteng[J].World JGastroenterol,2007,13(26):3619-3624.
[13]邓大中,陈玉川,胡丙杰,蔡明屈.人心肌梗死心肌肌钙蛋白T脱失的免疫组化观察[J].中国法医学杂志,2004,19(6):350-351.
[14]贾建长,赵子琴,顾云菊,沈忆文,陈 龙.家兔急性心肌梗死CTnI免疫组织化学实验研究[J].法医学杂志,2005,21(2):104-106.

