九株谷氨酸生产菌的生物学特性研究
杜巧燕,郑璞,*,孙志浩,何毅清
(1.江南大学生物工程学院和教育部工业生物技术重点实验室,江苏无锡214122;2.新加坡义安理工学院生命科学与化学工艺学学院,新加坡S599489)
九株谷氨酸生产菌的生物学特性研究
杜巧燕1,郑璞1,*,孙志浩1,何毅清2
(1.江南大学生物工程学院和教育部工业生物技术重点实验室,江苏无锡214122;2.新加坡义安理工学院生命科学与化学工艺学学院,新加坡S599489)
【目的】研究九株谷氨酸生产菌的生物学特性,为具有广域pH耐受性的谷氨酸高产菌筛选提供实验依据。【方法】考察九株菌的低pH生长、高pH产酸特性;对磺胺胍、酮基丙二酸、丙二酸和香豆素的耐受性以及发酵特性。【结果】Corynebacterium glutamicum S9114、Corynebacterium glutamicum ATCC 13761、Corynebacterium glutamicum T613-85均能在pH3.9下生长,而在pH10.5时S9114、Corynebacterium acetoacidophilum ATCC 13870、T613-85依然能够产酸;抗性平板上具有明显生长优势的菌株如下:磺胺胍:S9114;酮基丙二酸:S9114、ATCC 13870;丙二酸:ATCC13761、ATCC13870、Microbacterium ammoniaphilum ATCC 15354;香豆素:除 ATCC13761和 Corynebacterium melassecola ATCC 17966,其他耐受程度相似;九株菌中产酸能力最强的是S9114,其次是T613-85。【结论】以S9114为出发菌株进行改造,确定筛选平板为含磺胺胍2%、酮基丙二酸0.25%、丙二酸1.6%、香豆素0.2%的低pH梯度(pH 3.6~4.0)平板和高pH梯度平板(pH 10.5~11.2)。
谷氨酸生产菌,pH,抗性,产酸
谷氨酸是传统的大宗发酵产品,相比国外,我国生产指标(主要是产酸率和糖酸转化率)普遍偏低[1],亟需性状优良的生产菌株。在发酵生产谷氨酸过程中,需流加氨水控制pH7.0左右,而发酵结束时,亦需向发酵液中投入大量浓硫酸调节pH 3.20~3.25,结晶谷氨酸[2],选育耐低pH的谷氨酸生产菌株可以节约氨水以及浓硫酸用量,降低成本,具有实际生产意义;发酵流加氨水时由于粗放操作造成氨水加入量过大,或者由于搅拌问题造成发酵液局部pH过高,使菌种产酸降低,所以有必要选育能够在高pH情况下高产酸的菌株。而对于菌种广域pH耐受性至今未见报道。筛选谷氨酸高产菌过程中,抗性平板的应用极其广泛[3]。分析谷氨酸代谢途径(图1),可以选育磺胺胍[4]、酮基丙二酸、丙二酸和香豆素抗性提高的菌株实现高产谷氨酸的目的。其中磺胺胍是ADP磷酸化抑制剂,丙二酸是呼吸链抑制剂,对该两种抑制剂有抗性的突变体,能量代谢得以强化,利于谷氨酸的生产,而为了选育解除谷氨酸对谷氨酸脱氢酶反馈调节的突变株,可通过选育酮基丙二酸抗性实现,香豆素是Vp类衍生物,对其有抗性的菌株细胞膜通透性较好。

表1 不同低pH下九株谷氨酸生产菌的固态条件生长情况
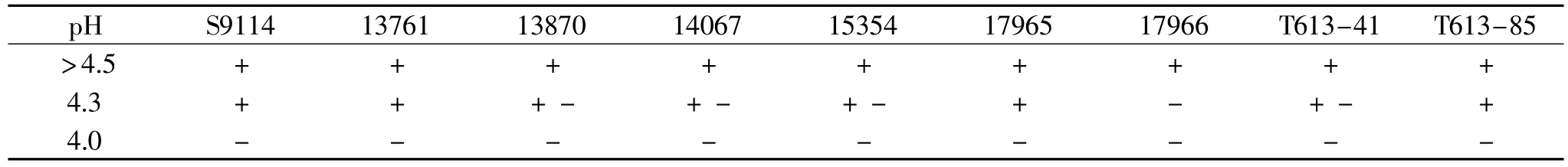
表2 不同低pH下九株谷氨酸生产菌的液态条件生长情况
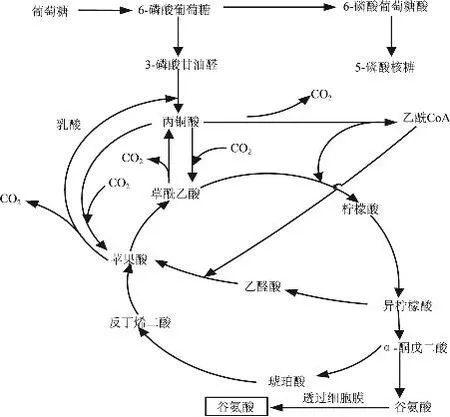
图1 谷氨酸发酵的主要代谢途径
1 材料与方法
1.1 材料与设备
Corynebacterium glutamicum S9114(S9114),Corynebacterium glutamicum ATCC 13761(13761),Corynebacterium acetoacidophilum ATCC 13870(13870),Corynebacterium glutamicum ATCC 14067(14067),Microbacterium ammoniaphilum ATCC 15354(15354),Corynebacterium melassecola ATCC 17965(17965),Corynebacterium melassecola ATCC 17966(17966),Corynebacterium glutamicum T613-41(T613-41),Corynebacterium glutamicum T613-85(T613-85);磺胺胍、酮基丙二酸 购自sigma公司;基本培养基 葡萄糖10g、NaCl 5g、蛋白胨10g、酵母膏5g、牛肉膏10g、琼脂20g,定容至1L,pH7.0;种子培养基葡萄糖25g、K2HPO41.5g、MgSO40.6g、FeSO45mg、MnSO45mg、尿素2.5g、玉米浆30g,定容至1L,pH7.0;发酵培养基 葡萄糖140g、K2HPO41g、MgSO46g、FeSO45mg、MnSO45mg、硫胺素0.05mg、尿素7g、玉米浆3g,定容至1L,pH7.0;其他试剂 均为国产分析纯。
752型紫外可见分光光度计 上海光谱仪器有限公司;SBA-40C型生物传感分析仪 山东省科学院生物研究所。
1.2 实验方法
1.2.1 低pH生长特性研究 固态条件:发酵培养基(含2%琼脂)灭菌后用无菌饱和谷氨酸溶液调节pH至6.0、5.5、5.0、4.5、4.0、3.9、3.8,将九株菌以辐射状划线于不同pH固体平板,置于30℃培养箱培养3d,观察生长情况。
液态条件:将九株菌分别从斜面接种至不同pH(6.0、5.5、5.0、4.5、4.3、4.0)的发酵培养基,30℃,220r/min摇床培养24h,测定发酵液的OD660。
1.2.2 高pH产酸特性研究 发酵培养基(含0.01%溴百里香酚兰)灭菌后用NaOH调pH至8.0、9.0、10.0、10.3、10.5、11.0,其他同低pH特性相同,分别研究固液两种条件下的产酸情况。
1.2.3 抗性特性研究 基本培养基(含2%琼脂)中加入不同浓度抗性制成抗性平板,将九株菌呈辐射状划线,30℃培养3d。各种抗性的浓度如下:磺胺胍0.1%、0.2%、0.4%、1%、2%、4%;酮基丙二酸0.25%、0.5%;丙二酸 0.1%、0.2%、0.4%、0.8%、1.6%、3.2%、6.4%;香 豆 素 0.05%、0.1%、0.2%、0.4%。
1.2.4 发酵特性研究 菌株于基本培养基平板活化,接种种子培养基,30℃,220r/min培养8h后,以8%接种量转接发酵培养基,30℃,220r/min发酵过程中流加尿素维持pH7.0左右,40h后测定发酵液中葡萄糖和谷氨酸含量。
2 结果与讨论
2.1 低pH生长特性研究
不同pH的平板于30℃培养3d后,观察结果如表1。同时计算九株菌摇瓶培养24h后OD660与0h OD660的差值,评判生长与否,结果见表2。
分析表1和表2,固液两种条件下九株菌的耐受力基本一致,S9114、13761和T613-85的低pH耐受力较强。
2.2 高pH产酸特性研究
溴百里香酚兰是碱性pH指示剂,其变色范围是8.0~9.3(黄~蓝),在菌体的培养过程中,产生的谷氨酸与NaOH结合使培养基的pH降低而产生变色圈。根据变色圈的大小可以大致衡量菌株的产酸能力。九株菌在pH<11.0时都能生长,而在pH>11.0都不能生长,九株菌在高pH生长特性上没有明显差别,固体平板上的产酸特性见表3。

表3 不同高pH下九株谷氨酸生产菌的固态条件产酸情况

表4 不同高pH下九株谷氨酸生产菌的液态条件产酸情况
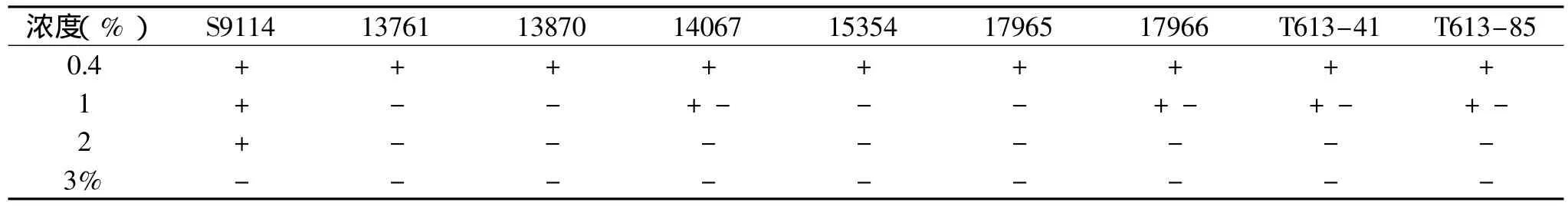
表5 九株菌的磺胺胍耐受性比较

表6 九株菌的酮基丙二酸耐受性比较
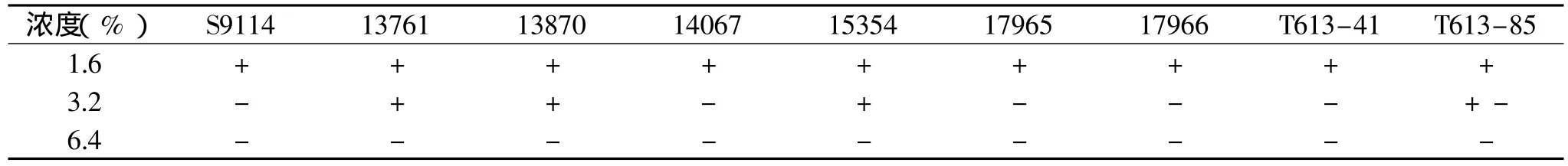
表7 九株菌的丙二酸耐受性比较

表8 九株菌的香豆素耐受性比较
在摇瓶中,发酵产酸使发酵液pH降低,当pH低于8.0时发酵液呈黄色,8.0<pH<9.3时呈绿色,pH>9.3呈蓝色。从颜色变化可以基本反映出九株菌在高pH条件下的产酸情况,具体见表4。
固液两种条件,菌体在高pH下产酸的结果没有矛盾,综合固液两种结果,S9114、13870和T613-85表现出了良好的高pH产酸性能。
2.3 抗性特性研究
针对谷氨酸的代谢途径,选取的4种抗性磺胺胍、酮基丙二酸、丙二酸和香豆素,不同浓度的抗性平板30℃培养3d后,观察结果,如表5。
通过观察抗性平板上九株菌的生长情况,得知九株菌对四种抗性的耐受性能有很大区别,耐受能力较强的菌株如下,磺胺胍:S9114;酮基丙二酸:S9114、13870;丙二酸:13761、13870、15354;香豆素:S9114、13870、14067、15354、17965、T613-41、T613-85。
2.4 发酵特性研究
发酵培养基中添加0.01%的中性红作为pH指示剂,中性红的变色范围pH6.8~8.0(红→黄),发酵过程中,每2h依据发酵液颜色补加适量40%尿素使pH稳定在7.0左右。发酵40h后,将发酵液稀释100倍,通过SBA-40C生物传感分析仪测定发酵液中葡萄糖和谷氨酸的含量。结果每批每株菌的发酵液残糖含量均低于1g/L,可认为糖已经耗完,产酸结果见图2。九株菌中谷氨酸产量最多的是S9114,且平行性很好。

图2 九株谷氨酸生产菌发酵产酸量比较
3 结论
九株菌均为革兰氏阳性,其菌落形态相似,显微镜下均为杆状但长短不一,菌落突起表面光滑,边缘整齐,但菌落颜色稍有不同。国外学者对该九株谷氨酸生产菌的形态特征、生长情况、肽抗性以及可发酵碳源等有过相关研究,但对pH特性研究不够详细,而且未见其考察磺胺胍等抗性[5-13]。实验中发现菌株在固态和液态条件下的生长等情况基本一致。在pH实验中,S9114和T613-85的耐受范围较广;在抗性和产酸研究中发现,产酸最高的S9114只有在磺胺胍抗性中占有明显优势,猜测4种抗性物质中磺胺胍耐受程度与产酸量之间的关系较大。
本实验通过研究发现S9114的各种特性都略优于其他菌株,因此选取S9114作为出发菌株,进行后续改造实验,以期能得到更加高产而且具有pH广域耐受性的优良菌株。由于pH耐受机理不明[14-15],不能采用定点突变等基因工程手段,本实验室拟采用X射线诱变以及DES诱变改造S9114,改造后的筛选使用梯度平板[16]以防止漏筛。梯度平板采用发酵培养基,其具体的浓度设计则依据S9114的pH特性,即低pH方向,pH3.9生长,pH3.8不长;高pH方向,pH10.5能够生长且产酸,pH11.0不能生长,设计低pH梯度平板的两层pH分别为4.0和3.6,高pH梯度平板的两层pH分别为10.5和11.2。因为产量一般与抗性之间有一定联系,所以在pH梯度平板中又加入磺胺胍2%、酮基丙二酸0.25%、丙二酸1.6%和香豆素0.2%,这样可以在保证抗性的基础上筛选pH特性提高的菌株。该筛选方法对其他菌的筛选有一定的借鉴作用。
[1]冯志彬,刘进杰,王东阳,等.提高L-谷氨酸产量的后期发酵工艺参数研究[J].食品科学,2009,30(4).
[2]于信令.味精工业手册[M].北京:中国轻工业出版社,1995.
[3]王帅.L-谷氨酸发酵高产菌选育及其发酵优化的研究[D].江南大学发酵工程,2008.
[4]王东阳.谷氨酸高产菌的原生质体诱变育种及其发酵条件研究[D].天津科技大学轻工技术与工程,2005.
[5]Shukuo Kinoshita,Katsunobu Tanaka,Shigezo Udaka,et al. Microbiological production of amino acid by reductive amination[P].US 3,220,929,1965-11-30.
[6]Hirotoshi Samejima,Hiroshi Teranishi,Takashi Deguchi,et al.Process for extracting proteins from Microorganisms[P].US 3,585,179,1971-06-15.
[7]Isamu Shiio,Koji Mitsugi,Shinichiro Otsuka,et al.Process for producing L-glutamic acid[P].US 3,117,915,1964-01-14.
[8]Takayasu Tsuchida,Hatuo Uchibori,Hiroshi Takeuchi,et al. Process for producing L-amino acids by fermentation[P].US 5,705,370,1998-01-06.
[9]Shinichi Motozaki,Toshinao Tsunoda,Shinji Okumura,et al. Process for producing L-glutamic acid[P].US 3,096,252,1963 -07-02.
[10] Kenzo Yokozeki,KojiKubota.Method ofproducing L-carnitine[P].US 4,650,759,1987-03-17.
[11]Sotoo Yamamoto,Tetsukazu Goto,Takeyoshi Ohsawa,et al. Method for production of L-glutamic acid by microbacteria[P]. US 3,338,793,1967-08-29.
[12] Takeyoshi Ohsawa, Mitsuru Shibukawa, Hideomi Takahashi,et al.Process for producing L-glutamic acid by using bacteria[P].US 3,399,114,1968-08-27.
[13]Tetsukazu Goto,Shuichi Nishio,Hiroshige Kojima,et al. Process for producing L-glutamic acid by using Corynebacterium Melassecola[P].US 3,355,359,1967-11-28.
[14]Terry Ann Krulwich.Alkaliphiles:‘ basic’molecular problems of pH tolerance and bioenergetics[J].Molecular Microbiology,1995 15(3):403-410.
[15]Yuhua Wang,Yan Li,Xiaolin Pei,et al.Genome-shuffing improved acid tolerance and l-lactic acid volumetric productivity in Lactobacillus rhamnosus[J].Journal of Biotechnology,2007,129:510-515.
[16]Ranjan Patnaik,Susan Louie,Vesna Gavrilovic,et al. Genome shuffling of Lactobacillus for improved acid tolerance[J]. Nature Biotechnology,2002,20.
Biological characteristics of nine glutamate acid-producing bacteria
DU Qiao-yan1,ZHENG Pu1,*,SUN Zhi-hao1,HE Yi-qing2
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education and School of Biotechnology Jiangnan University,Wuxi 214122,China;2.School of Life Sciences&Chemical Technology,Ngee Ann Polytechnic,Singapore S599489)
【Objective】Biological characters of 9 strains of glutamic acid bacteria were investigated to provide experimental support for screening of high glutamate acid-producing bacteria with a wide range of pH tolerance.【Method】The acid production and the tolerance of the nine strains to low pH,high pH,sulfaguanidine,diethyl ketomalonate,malonicacid and coumarinwerestudied.【Result】Corynebacterium glutamicum S9114,Corynebacterium glutamicum ATCC 13761 and Corynebacterium glutamicum T613-85 had higher tolerance under low pH(pH3.9).S9114,Corynebacterium acetoacidophilum ATCC 13870 and T613-85 could product glutamate acid at pH 10.5.Growth on the resistance plate showed the growth advantage of certain strains as follows:sulfaguanidine:S9114,diethyl ketomalonate:S9114and 13870,malonic acid:Corynebacterium glutamicum ATCC13761,ATCC13870 and Microbacterium ammoniaphilum ATCC 15354,coumarin:all except 13761 and Corynebacterium melassecola ATCC 17966.S9114 had the highest yield of glutamate acid【.Conclusion】Taking S9114 as the original strain to modify followed with the high or low pH,gradient screening plates consist of sulfaguanidine 2%,diethyl ketomalonate 0.25%,malonic acid 1.6%and coumarin 0.2%.
glutamate acid-producing bacteria;pH;resistance;acid production
TS201.2
A
1002-0306(2010)12-0185-04
2009-07-09 *通讯联系人
杜巧燕(1987-),女,硕士研究生,研究方向:生物化工。
国家高技术研究发展计划(“863”计划)重点项目(2006AA020301)。

