骨髓增生异常综合征患者CD4+CD25+调节性T细胞、调控基因FOXP3的表达及意义
吴小建,黄芳媚,王 勇
(九江学院附属医院血液肿瘤科,江西 九江 332000)
迄今为止,骨髓增生异常综合征(myelodysplastic syndrome,MDS)的发病机制尚未完全阐明,近年来大量研究认为MDS的发病与转归不仅与造血细胞异常有关[1],同时与抗肿瘤免疫缺陷有关[2],免疫异常在MDS的发生、发展中起到了促进作用。CD4+CD25+调节性 T细胞(CD4+CD25+Treg)和调控基因FOXP3是近10年来关于机体免疫状态的研究热点,与机体的免疫状态有着密切的关系。本研究通过检测MDS患者CD4+CD25+Treg细胞和FOXP3基因表达量,探讨二者在MDS疾病中的作用。
1 对象与方法
1.1 研究对象
1) 选择2006年3月-2008年12月九江学院附属医院血液肿瘤科收治的 MDS患者(MDS组)22例,均符合MDS诊断标准[1]。其中男14例,女8例;年龄17~81岁,中位年龄45岁。根据MDS分型标准[3]将22例患者分为:难治性贫血组(RA组)6例、难治性血细胞减少伴有多系发育异常组(RCMD组)11例、难治性贫血伴原始细胞增多组(RAEB组)5例。
2) 选择同期正常健康人(正常对照组)8例,男4例,女 4例;年龄25~67岁,中位年龄39岁。均为健康志愿者。
3) 各组均采集骨髓液4 mL,EDTA抗凝。
1.2 主要试剂与仪器
Trizol试剂盒、TAKARA逆转录试剂盒、SYBR GREEN荧光染料均购自美国Bio-Rad公司;流式试剂 PE-CY5-CD4、FITC-CD25、同型对照FITC-Mouse IgG均购自美国BD公司。Epics XL型流式细胞仪(美国Beckman Coulter公司),iCycler iQTM荧光实时PCR仪(美国Bio-Rad公司),Lamba 20型双光束紫外分光光度计(美国 PE公司)。
1.3 方法
1) 流式细胞仪检测CD4+CD25+Treg细胞占CD4+T细胞比例:取EDTA抗凝的骨髓液1 mL,2倍体积PBS稀释,用淋巴细胞分离液分离出骨髓单个核细胞,调整细胞密度至1×107/mL。各取骨髓单个核细胞悬液50μL于标本试管中,分别加入 PE-CY5-CD4 和 FITC-CD25各 5μL;阴性对照管中加入PE-CY5-CD4和FITC-Mouse IgG1各5μL,振荡混匀后,室温避光孵育30 min后重新悬浮细胞上流式细胞仪检测。每份标本测定10000个细胞,全部数据用流式细胞仪软件SYSTEMⅡ获取,测定CD4+CD25+T reg细胞占CD4+T细胞亚群的百分率。
2) RT-PCR法检测FOXP3基因的表达:①骨髓单个核细胞总RNA的提取:按Trizol试剂盒操作说明提取骨髓单个核细胞总 RNA,室温干燥RNA,加入20~40μL超纯水溶解上述沉淀,双光束紫外分光光度计测量总 RNA的 A260、A260/A280,计算其浓度[RNA浓度(μ g/μ L)计算:A260×40×稀释倍数/1000],并用2%琼脂糖凝胶电泳鉴定RNA的提取质量。②逆转录合成cDNA:反应体系 20μL:20 mmol MgCl24μL,10 mmol dNTP 2μL,10 ×Buffer 2μL,RNA 酶抑制(40 U/μ L)0.5μL,Oligo(dt)随机引物 1μL,AMV(5 U/μ L)1μL,模板 RNA XμL(X=1/RNA 浓度),DEPC 处理水补足总体积;反应条件:42℃60 min,99℃5 min。③RT-PCR 反应:FOXP3上游 :5′-CAAGTTCCACAACATGCGACC-3′,下游 :5′-GGTGGCAGGATGGTTTCTGAA-3′144 bp;β2-MG 上游:5′-ACCCCCACTGAAAAAGATGA-3′,下游 5′-CATCT TCAAACCTCCATGAT-3′124 bp;RT-PCR反应体系25μL :10 mmol dNTP 0.8μL,25 mmol MgCl22.5μL,10 ×Buffer 2.5μL,Taq 酶 0.3μL,SYBRGREE 荧光染料 0.3μL,10 μ mol的上 、下游引物各0.5μL,cDNA 1μL,灭菌用水补足总体积 ;反应条件:95℃预变性3 min,95℃30 s,60℃30 s,72℃40 s 40个循环,72℃再次延升8 min,55~95℃溶解曲线测定。取5μL RT-PCR产物,2%琼脂糖电泳观察电泳结果,以确定实时荧光定量机器上所跑出的峰是本研究所要测定的目的基因和内参的峰。相对mRNA表达量的计算,每个标本中FOXP3基因的相对mRNA表达水平可直接用样品各自内参基因β2-MG表达量进行标化,即每个标本中FOXP3基因的相对mRNA表达水平可以采用相对定量法2-△△Ct计算。
1.4 统计学方法
2 结果
1) MDS组CD4+CD25+Treg细胞比例、FOXP3基因表达水平与正常对照组比较,差异均无统计学意义(均P>0.05)。见表1。
表1 2组CD4+CD25+Treg细胞比例及FOXP3基因表达量比较()

表1 2组CD4+CD25+Treg细胞比例及FOXP3基因表达量比较()
与正常对照组比较,*P>0.05
组别 n CD4+CD25+Treg细胞比例/%FOXP3基因表达量MDS组 22 8.91±2.58* 6.63±2.78*正常对照组 8 8.35±1.32 6.52±1.54
2) RA组、RAEB组CD4+CD25+Treg细胞比例、FOXP3基因表达水平与正常对照组比较,差异均有统计学意义(均P<0.01);RCMD组CD4+CD25+Treg细胞比例、FOXP3基因表达水平与正常对照组比较,差异均无统计学意义(均P>0.05);RCMD组、RAEB组CD4+CD25+Treg细胞比例、FOXP3基因表达水平与RA组比较,差异均有统计学意义(均 P<0.01);RA组、RCMD组 CD4+CD25+T reg细胞比例、FOXP3基因表达水平与RAEB组比较,差异均有统计学意义(均P<0.01),见表2。
表2 各组CD4+CD25+Treg细胞比例及FOXP3基因表达量的比较()
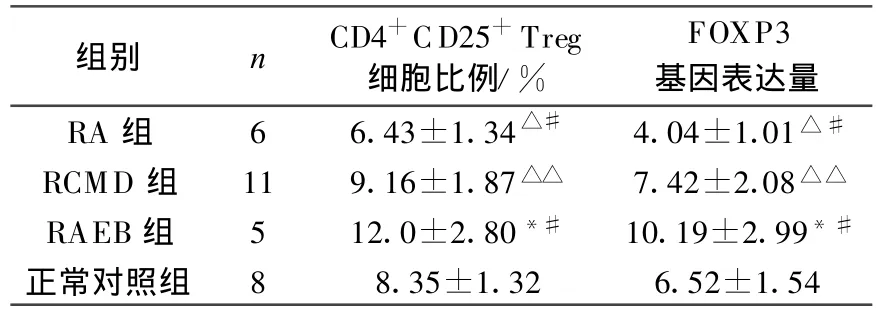
表2 各组CD4+CD25+Treg细胞比例及FOXP3基因表达量的比较()
与正常对照组比较:#P<0.01,△△P>0.05与 RCMD组、RAEB组比较,△P<0.01与 RA组、RCMD组比较,*P<0.01
组别 n CD4+CD25+Treg细胞比例/%FOXP3基因表达量RA 组 6 6.43±1.34△# 4.04±1.01△#RCMD 组 11 9.16±1.87△△ 7.42±2.08△△RAEB组 5 12.0±2.80*# 10.19±2.99*#正常对照组 8 8.35±1.32 6.52±1.54
3 讨论
正常人外周血和胸腺中的CD4+T细胞有5%~10%持续高表达白细胞介素2(interleukin-2,IL-2)受体α链(CD25)而被称为CD4+CD25+T细胞亚群。这类细胞是具有独特免疫调节作用的一种专职抑制细胞又被称为CD4+CD25+调节性T细胞(CD4+CD25+Treg细胞)。其主要功能是强大抑制能力,在慢性炎性反应、自身免疫病、器官移植、肿瘤免疫中发挥重要作用[4-5]。
FOXP3基因特异性表达于CD4+CD25+T reg细胞内,属转录因子,参与调节目的基因的活化和表达,与免疫功能密切相关,对于CD4+CD25+T reg细胞的发育和功能非常重要,参与了免疫耐受的分子机制。目前许多实验证实 FOXP3是 CD4+CD25+T reg细胞主要调控基因,高特异性表达于CD4+CD25+Treg细胞内[6-8]。
近年来,随着对MDS研究的深入,WHO已将其归入了髓系肿瘤。肿瘤的免疫逃逸导致了机体对肿瘤的免疫无应答或免疫反应低下,在实体瘤中,如在部分血液学肿瘤(如白血病、淋巴瘤)中已经得到了证实[2]。由于CD4+CD25+Treg细胞功能上的特性对肿瘤免疫效应细胞的活化增殖及功能存在着抑制作用,使其在肿瘤免疫逃逸中起到了关键性的作用。CD4+CD25+T reg细胞能抑制 T细胞对自体抗原的免疫应答,因而在维持对自身成分耐受的同时也会阻止机体对肿瘤细胞的免疫应答,从而导致了肿瘤的免疫逃逸,随着疾病的进展,CD4+CD25+T reg细胞逐渐升高,导致肿瘤免疫地逐步降低,使得肿瘤细胞大量的生长,导致了机体的病症更加严重,这可能是MDS逐步向白血病转化的重要因素。
本研究结果显示,RA、RCMD、RAEB组的CD4+CD25+Treg细胞比例、FOXP3基因水平随着疾病进展逐渐增高;RA组CD4+CD25+T reg细胞比例、FOXP3基因水平均显著低于RCMD组、RAEB组(均 P<0.01),RAEB组CD4+CD25+Treg细胞比例、FOXP3基因水平均显著高于 RA组、RCMD组(均P<0.01)。综合上述结果可得出CD4+CD25+T reg细胞及FOXP3基因与MDS疾病进展密切相关。CD4+CD25+Treg细胞比例、FOXP3基因水平的逐渐升高,导致肿瘤免疫的逐步降低,可能是MDS病程逐步严重的重要因素。
[1]M aciejewski J P,Selleri C,Sato T,et al.A severe and consistent deficit in marrow and circulating primitive hematopoietic cells(long term culture-initiating cells)in acquired aplastic anemia[J].Blood,1996,88(6):1983-1991.
[2]Leving M K,Sang regorio R,Roncarolo M G,et al.Human CD4+CD25+regulatory T cells suppress naive and memory T cell proliferation and can be expanded in vitro without loss of function[J].J Exp Med,2001,193(11):1295-1302.
[3]陈书长,张之南.协和血液病学[M].北京:人民卫生出版社,2004:420-431.
[4]Khattri R,Cox T,Yasayko S A,et al.An essential role for scurfin in CD4+CD25+T regulatory cells[J].In Immunol,2003,4(4):337-342.
[5]Yagi H,Nomura T,Nakamura K,et al.Crucial role of FOXP3 in the development and function of human CD25+CD4+regulatory T cells[J].Int Immunol,2007,16(11):1643-1656.
[6]Bacchetta R,Passerini L,Gambineri E,et al.Defective regulatory and effector T cell functions in patients with FOXP3 mutations[J].J Clin Invest,2006,116(6):1713-1722.
[7]Gambineri E,Torgerson T R,Ochs H D.Immune dy sregulation,polyendocrinopathy,enteropathy,and X-linked inheritance(IPEX),a sy ndrome of systemic autoimmunity caused by mutations of FOXP3,a critical regulator of T-cell homeostasis[J].Curr Opin Rheumatol,2003,15(4):430-435.
[8]Solomou E E,Rezvani K,Mielke S,et al.Deficient CD4+CD25+FOXP3+T regulatory cells in acquired aplastic anemia[J].Blood,2007,110(5):1603-1606.

