大肝癌的外科治疗
熊志刚,邬林泉
(1.丰城市人民医院普外科,江西 丰城 331100;2.南昌大学第二附属医院肝胆外科,南昌 330006)
原发性肝癌是全球常见的恶性病之一,其发病率和死亡率均居恶性肿瘤的第二位,随着肝移植的迅速发展,为肝脏切除提供了新的断肝理念和技术思路,扩大了大肝癌切除的适应证。本文结合南昌大学第二附属医院近年的病例和经验,就大肝癌外科治疗的问题进行讨论。
1 临床资料
1.1 一般资料
本院2000年6月-2008年8月共收治原发性肝癌238例,其中外科手术切除 52例,男44例,女8例,年龄17~73岁,平均 45岁。其中肿瘤<5 cm的患者10例(小肝癌组),男8例,女2例,年龄21~73岁,平均47岁;肿瘤>5 cm的患者42例(5~10 cm 30例,10~23 cm 12例),男 36例,女 6例,年龄17~64岁,平均43岁。临床表现以右上腹或剑突下胀痛不适,肝区疼痛,上腹部包块为主;有2例无症状,在体检时被发现,为亚临床型肝癌。1例以腹胀,下肢浮肿进行性加重1个月入院,经检查为肿块浸及下腔静脉;以黄疸为主要症状的患者6例,其中1例为肝方叶部肿瘤,4例为肝细胞癌肝内转移或压迫胆管主干,1例为胆总管癌栓。45例患者血清乙型肝炎表面抗原(HbsAg)阳性,占86.5%。肝硬化40例,占 76.9%。甲胎蛋白(AFP)阳性(或>400 U/L)者 27例,占52%,病理检查除1例为透明细胞癌,其他均为肝细胞癌。所有病例术前均进行B超,CT或磁共振检查,肿瘤最大直径为3~23 cm。肿瘤位于尾状叶1例,左叶 10例,右叶35例,左右肝同时存在病灶6例。手术前经过1~3次肝动脉插管栓塞化疗(TACE)者2例。
1.2 手术方式
选择右肋缘下斜切口或“人”字形切口,术中探查肿瘤部位并估计肿瘤能被切除后,即切断肝周围韧带,充分游离肝脏。采用两种阻断血流技术:①阻断入肝血流(pringle法)32例,占61%。②全肝血流(heaney法,肝上,肝下下腔静脉处置血流阻断带,备作全肝血流阻断止血)3例,占6%,不规则肝段切除39例;左外叶切除7例,其中1例联合脾切除;左半肝切除2例,同时行肝动脉,门静脉置全埋入式药盒(皮下埋入式微泵);右半肝切除2例,其中1例行肝动脉,门静脉置全埋入式药盒,另1例门静脉置全埋入式药盒;尾状叶切除1例;肝方叶切除联合门静脉移植1例。1例右肝巨大肝癌,胸腹联合切口切除右下肺,部分心包,膈肌及右肝大部,肿块大小23 cm×15 cm,重达5 kg。本组病例术前术后均常规护肝,补充白蛋白等治疗。术后定期全身化疗或经皮下全埋入式药盒化疗,术后常规行TACE治疗12例。
1.3 统计学方法
计数资料采用χ2检验,计量资料采用t检验,P<0.05为差异有显著性意义。
2 结果
2.1 2组病例手术时间、失血量比较
大肝癌组平均手术时间3.6 h,小肝癌组2.0 h。术中失血量大肝癌组400~3 600 mL,平均为600 mL,小肝癌组 200~800 mL,平均为 300 mL。2组手术时间、失血量比较差异有统计学意义(P<0.05)。
2.2 术后并发症及手术死亡率
中、大量腹水14例,其中大量血性腹水1例。右胸腔积液6例,膈下感染 1例,胆瘘 2例。2组并发症发生率、手术及术后死亡率比较无显著性差异(P>0.05),见表1。
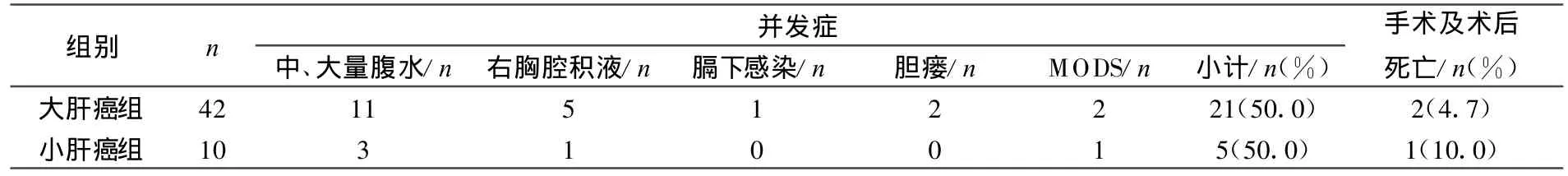
表1 2组病例术后并发症的比较
2.3 术后随访
大肝癌手术组获得随访37例,6个月,1、2年生存率分别72.9%(27/37),48.6%(18/37),27.1%(10/37),死亡原因依次为肝癌复发,肝功能衰竭,上消化道出血。小肝癌切除组术后6个月,1、2年生存率分别 90%(9/10)、90%(9/10)、70%(7/10),死亡原因为肝癌复发、肝功能衰竭。
3 讨论
原发性肝癌患者就诊时多数已为中晚期肝癌,直径>5 cm或10 cm的大肝癌,巨大肝癌临床上常见,是当今肝脏外科治疗的难点和热点,提高大肝癌的切除率对于改善肝癌的总体预后具有十分重要的意义。
近20年来,非手术治疗方法出现较多,发展较快,但肝切除术仍是肝癌治疗的首先方法[1]。大肝癌的切除与小肝癌显然不同,在技术上较为困难,容易导致切除术后肝功能衰竭,术中大出血及其他难以控制的局面。随着手术的进步和手术器械的改良,以前认为不能切除的肝癌成为可以切除。
以前肝切除主要采取钳夹法和指捏法断肝,此法断肝迅速,由于解剖不清,易造成术中大出血,而盲目的大块组织缝扎止血,易误伤大的管道,造成术后肝功能障碍。近年来,笔者采用彭氏多功能解剖器(PMOD),实行刮法解剖肝肿块及其周围管道,分别加以处理,保留重要的管道,如有血管破损应及时加以修补。本组有2例患者术中损伤肝右静脉,先用干纱布压迫止血点,吸尽术野积血,用5-0的prolene线缝合破口,此法术中出血量少且安全可行。本组病例中,大肝癌组手术时间明显长于小肝癌组,术中失血量明显大于小肝癌组,但2组间的手术并发症率及手术死亡率无显著差异,说明大肝癌的手术切除是安全可行的。
对于不能手术切除的肝癌,TACE时首选的治疗方法。TACE治疗后肝脏肿瘤可以缩小,患者生存期可以延长,却达不到治愈的目的,肿瘤缩小,可能为二期切除争取机会。本组有2例术前行TACE,待肿瘤缩小后再行二期肿瘤切除。对于复发性肝癌,现在也倾向于能切除尽量切除[2-3]。
局部根治性切除适合于我国肝癌患者多合并肝硬化这一状况,可最大程度地保护肝脏储备功能,而局部切除有2 cm的切缘即可保证切除的根治性[4]。本组大多数患者采用局部根治性切除(39例)。术后并发症的处理:本组52例中发生各种并发症26例。主要的并发症有胸腔积液6例,一般少量可自行吸收,中到大量胸水并有呼吸困难时,需穿刺抽胸水,一般胸穿1~3次即可。胆瘘2例,1例引流2周后自愈,另1例因全身衰竭而死亡。
肝功能衰竭是术后严重的并发症,本组有1例肝方叶部肿瘤患者,术中发现癌肿浸润门静脉而行门静脉局部切除加人造血管移植,术中门静脉肝动脉阻断达1 h,输血3 600 mL,术后3 d因肝功能衰竭,大量腹水死亡。大肝癌的切除由于术中出血,严重的感染及肝硬化的存在,更易诱发肝功能衰竭。防止术后肝功能衰竭应高度注意围手术期处理。术后要妥善处理各种并发症,尤其是膈下积液,胆瘘,腹腔感染。同时要注意肝功能不全的早期征象,如血浆白蛋白明显降低,转氨酶升高,黄疸,腹水等。应及时采取措施:①纠正和保持水电解质、酸碱平衡;②应用广谱抗生素预防感染;③保护肝肾功能。
[1] Ohto M,Yoshikawa M,Saisho H,et al.Nonsurgical treatment of hepatocellular carcinoma in cirrhotic patient[J].World J Surg,1995,19:42-46.
[2] 吴孟超.肝癌外科治疗的近期进展[J].中国普外基础与临床杂志,2006,13(2):125-128.
[3] 钦伦秀,任宁.原发性肝癌的外科治疗[J].中华肿瘤防治杂志,2006,13(24):1-4.
[4] 徐立,石明,张亚奇,等.肝细胞癌手术切缘对患者术后复发与生存的影响[J].中华肿瘤杂志,2006,28(1):47-49.

