线粒体加工肽酶干扰 RNA真核表达载体的构建
张艳梅, 呼格吉乐, 马飞煜, 邬 伟, 马翔凌
帕金森病(Parkinson's Disease,PD)是一种常见的神经系统变性病,其发生、发展机制涉及多基因表达改变[1]。尽管 PD的发病机制目前仍不完全清楚,但一些诱发因素在不同阶段作用于不同基因,引起相关基因结构及表达水平改变而致病。MPPs的主要功能是特异识别一大类线粒体前体蛋白,并在单一和特定位点剪切这类蛋白,很可能与 PD有关[2]。在本研究的前期工作中利用蛋白组学技术对MPP+诱导的 PC12细胞 PD模型中发现线粒体加工肽酶(m itochondrial processing peptidases,MPPs)表达量变化显著[3],因此本研究采用干扰 RNA技术特异性剔除或关闭 MPP+基因的表达,使培养细胞中的靶定基因沉默。因此本实验针对 Pmpca基因,设计并构建 siRNA(small interference RNA,siRNA)表达载体,为进一步在体内外研究 MPPs的功能奠定基础。
1 材料与方法
1.1 材料
PC12细胞购自中科院上海细胞库;AXYGEN质粒小量提取试剂盒购于杭州爱思进生物技术有限公司;BamH I、Bbs I购自 sigma公司;干扰 RNA的合成购自上海吉玛公司;测序工作在上海 Invitrogen公司完成。
1.2 方法
1.2.1 寡核苷酸的设计与合成
因国内外对 Pmpca-siRNA表达载体的构建,未见报道。本研究根据 Pmpca的所有变异体的共同序列设计出 shRNA,经 blast软件进行同源搜索,确定其特异性。以下序列为 Pmpca部分 cDNA序列,黑体部分为靶序列即干扰部位。


shRNA模板中的 loop结构选用了 TTCAAGAGA以避免形成终止信号,shRNA的转录终止序列采用T6结构。正义链模板的 5'端添加了 CACC,与 BbsI酶切后形成的粘端互补;反义链模板的 5'端添加了GATC,与 BamHI酶切后形成的粘端互补;如果 siRNA的第一个碱基不是 G,则在 CACC后补加一个G,以下是以 SR-Pmpca-1425为例具体说明模板的设计。

1.2.2 shRNA模板的退火
将 DNA oligo分别用 TE(pH 8.0)溶解,浓度为100μmol/L。取相应的正义链和反义链 oligo溶液。退火条件:95℃ 5min;85℃ 5min;75℃ 5m in;70℃5min;4℃保存。退火处理后得到浓度为 10μM的shRNA模板。将所得模板溶液稀释 500倍,终浓度为 20nmol/L,用于连接反应。
1.2.3 PGPU6/GFP/Neo载体的线性化

图1 PGPU6/GFP/Neo载体图
取 2μg PGPU6/GFP/Neo载体进行酶切处理:37℃酶切1h,琼脂糖电泳,使用 Agarose Gel DNA Purification Kit Ver2.0(TaKaRa)回收,电泳检测估算浓度,稀释浓度至 50ng/ul。
1.2.4 PGPU6/GFP/Neo-shRNA载体的构建
(1)载体的连接反应:22℃ 1h,转到 JM109感受态细胞中。
(2)每个连接反应挑取 5个菌落,接种到含50μg/ml Kanamycin的 LB培养基中,37℃孵育过夜。挑取过夜培养平板上单个菌落置于 5ml含卡那霉素(30μg/m L)的 LB培养基中,37℃,250r/min振荡培养12h。
(3)质粒提取:取 5m l在 LB培养基中培养过夜的菌液于离心管中,室温 11200r/min离心 1min,弃尽上清;用 250μl已加入 RNase A的 Buffer S1悬浮细菌沉淀,加入 250μl Buffer S2,翻转混合 4~6次,混合均匀,使菌体充分裂解,形成透亮的溶液。加入350μl Buffer S3,翻转混合 6~8次,11200r/min离心10min;吸取离心上清并转移到 DNA制备管中,11200r/min离心 1m in,弃滤液;将制备管置回离心管 ,加 500μl BufferW1,11200r/min离心 1min,弃滤液;将制备管置回离心管,加 700μl Buffer W2,11200r/min离心 1m in,弃滤液;以同样的方法再用700μl BufferW 2洗涤 1次。确认在 Buffer W2 concentrate中已按试剂瓶上的指定体积加入无水乙醇;将制备管置回 2m l离心管中,11200r/min离心1min;将制备管移入新的 1.5ml离心管中,在 DNA制备管膜中央加 60~80μl Eluent或去离子水,室温静置 1min。 11200r/m in离心 1min。将 Eluent或去离子水加热至 65℃将提高洗脱效率;使用碱裂解法抽提质粒,所得质粒用 Bam H I,Pst I分别酶切鉴定(见图2、图3),测序鉴定。
2 结 果
2.1 质粒酶切
使用碱裂解法抽提质粒,所得质粒用 Bam H I,Pst I分别酶切鉴定,阳性重组载体应该可以被BamH I切开,而不能被 Pst I切开。酶切结果表明,所有质粒均为阳性重组载体(见图2、图3)。
2.2 测序鉴定
每组选择两个克隆进行测序鉴定。构建的 siRNAs序列与基因库中序列完全相同,并且未发现有突变、缺失、插入等异常存在。
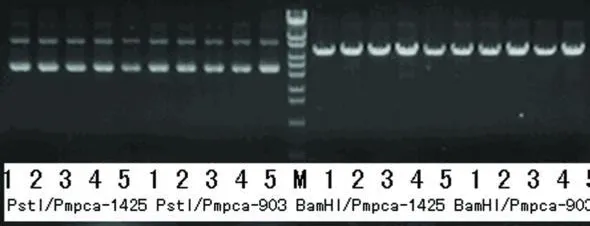
图2 重组载体的酶切鉴定

图3 重组载体的酶切鉴定
3 讨 论
RNAi技术的基本原理是将双链 RNA(doublestranded RNA,dsRNA)裂解为 21~25个核苷酸组成的 siRNA作为介导子,引起同源序列特异性的 mRNA降解[4]。siRNA是 RNA干扰过程中的重要中间分子。体外制备的方法包括直接化学合成或利用Dicer或 RNA酶Ⅲ消化长的 dsRNA,也可利用质粒和病毒载体构建载体在细胞内表达[5]。RNAi技术近年来发展迅速,已成为分子生物学研究的主要技术手段之一,如 siRNA脂质体介导法[6],抑制艾滋病病毒[7,8]癌症的早期发现[9]等,已逐渐被应用于人类基因功能研究和基因治疗方面。当然,开发这类RNAi治疗需要花费几年甚至更长的时间,但随着研究的不断深入将会有更多以 RNAi机制为基础的治疗手段被用于临床[10]。
线粒体加工肽酶(mitochond rial processing peptidases,MPPs)是一种金属内切蛋白酶[11],它也是由 α和 β两个亚单位组成的可溶性的异源二聚体,分子量是 100~110kD。MPPs的主要功能是特异识别一大类线粒体前体蛋白,并在单一和特定位点剪切这类蛋白。目前关于 MPPs与神经系统变性病的研究开展很少,但从上述研究中可以看出,MPPs与神经变性病的发生有着一定的联系,但在国内外 PD研究的相关文献中未见该蛋白的报道。张艳梅等[3]研究首次发现 MPPs蛋白在 PD的发病中可能起一定的作用,值得深入研究以阐明其详尽的作用机制。
本研究通过构建 shRNA的真核表达载体,旨在为帕金森病的基因治疗提供一种有效手段。MPPs真核表达载体的构建未见报道。本研究根据该基因的所有变异体的共同序列设计出 shRNA,经 blast软件进行同源搜索,确定其特异性,模板为含有靶点序列回文结构,这样细胞内合成的 RNA为发夹样双链结构,可产生分子内茎-环结构,被内源性 Dicer酶处理成 21nt的双链 siRNA,发挥 siRNA的效应,达到特异性抑制靶基因表达的目的。再用 PAGE方式纯化,确定其准确性。通过与真核表达载体PGPU6/GFP/Neo连接,酶切鉴定和基因测序证明 MPPs特异性 siRNA真核表达载体 PGPU6/GFP/Neo-Pmpca-SR-1113、PGPU6/GFP/Neo-Pmpca-SR-1425、PGPU6/GFP/Neo-Pmpca-SR-561、PGPU6/GFP/Neo-Pmpca-SR-903构建成功。
综上所述,本实验为进一步研究 MPPs基因功能缺陷对 PC12细胞的侵袭、增值的影响,以及双向电泳探究基因功能缺陷后蛋白的表达奠定了基础。
[1]李淑娟,胡国华,过红明,等.白介素-1β和小胶质细胞在帕金森病中的作用[J].中国老年学杂志,2009,29(5):1189-1191.
[2]Taylor AB,Smith BS,Kitada SJ,etal.Crystal structuresofmitochondrial processing peptidase reveal the mode for specific cleavage of import signal sequences[J].Structure Cambridge,2001,9(7):615-625.
[3]张艳梅,马飞煜,胡林森,等.蛋白质组学技术鉴定帕金森病模型中的 3种新蛋白质[J].国际神经病学神经外科学杂志,2008,35(4):291-294.
[4]呼格吉乐,王震宇,王文礼,等.RNAi技术在肿瘤研究中的应用进展[J].疾病监测与控制杂志,2009,25(1):61-63.
[5]Stockinger A,Eger A,Wolf J,etal.E-cadherin regulates cell growth bymodulating proliferation-dependent beta-catenin transcriptional activity[J].Cell Biol,2001,154(6):1185-1196.
[6]Durcan N,Murphy C,Cryan SA.Inhalable siRNA:potentialas a therapeutic agent in the lungs[J].Mol Pharm,2008,5(4):559-566.
[7]Kumar P,Ban HS,Kim SS,etal.T cell-specific siRNA delivery suppresses HIV-1 infection in humanized mice[J].Cell,2008,134(4):577-586.
[8]Liu YP,Gruber J,Haasnoot J,etal.RNAi-mediated inhibition of HIV-1 by targeting partially complementary viral sequences[J].Nucleic Acids Res,2009,37(18):6194-6204.
[9]Quon K,Kassner PD.RNA interference screening for the discovery of oncology targets[J].Expert Opin Ther Targets,2009,13(9):1027-1035.
[10]Grosshans H,Filipowicz W.Molecular biology:the expanding world of small RNAs[J].Nature,2008,451(7177):414-416.
[11]Oleksandr G,Patrizia C,Grazia I.Mitochondrial processing peptidases[J].Biochim Biophy Acta,2002,1592(1):63-77.

