表观扩散系数在乳腺病变诊断中的应用价值
张 静 Zhang,Jing
程流泉2 Cheng,Liuquan
安宁豫2 An,Ningyu
蔡幼铨2 Cai,Youquan
郭 勇1 Guo,Yong
1.100048 北京
海军总医院医学影像科
2.100853 北京
解放军总医院放射科
乳腺癌的早期发现和早期治疗对增加保乳手术时机和改善其预后至关重要。与传统X线和超声相比,磁共振具有无电离辐射、无需注射含碘造影剂、软组织分辨率高、多参数多平面成像等优点,对临床隐匿的多灶性及多中心病变的诊断准确率明显高于其他检查。扩散加权成像(diffusion weighted imaging,DWI)是在乳腺方面应用最广的一种磁共振功能成像,可以在活体水平探测人体的微观水分子运动,根据表观扩散系数(Apparent diffusion coefficient,ADC)可以鉴别乳腺良恶性病变[1]。本研究通过分析乳腺良、恶性病变的ADC值差异,比较ADC值在乳腺肿块和非肿块性病变中定性诊断的效能,并进一步探讨不同病理类型乳腺病变的ADC值特征,旨在提高DWI在乳腺病变中的诊断及鉴别诊断价值。
1 材料和方法
1.1 研究对象 纳入标准:223名患者经乳腺 MR平扫及增强检查共发现乳腺病灶236个,并经穿刺或手术得到病理证实。其中女性221名,男性2名,年龄18~75岁,平均46岁。排除标准:①MR检查前一周内行乳腺肿块穿刺者,②已行新辅助化疗者,③因脂肪抑制不均匀而影响病变观察者,④因金属异物或运动产生伪影者。
1.2 仪器设备 1.5T超导磁共振扫描仪(Signa Excite HD,GE Medical System,USA),梯度场40mT/m,梯度切换率150T/m/s;4通道乳腺专用表面线圈。病人取俯卧位,双乳自然悬垂。
1.3 检查方法 采用横轴位的平面回波-扩散加权成像序列(EPI-DWI),TR=8 400ms,TE=93.8ms,层厚=4mm,激励次数(NEX)=2,视野(FOV)=30cm×30cm,矩阵=128×128,ASSET=2,b值=0,1 000s/mm2。动态增强扫描采用VIBRANT序列:TR=4.7ms,TE=2.2ms,层厚 2.4mm,FOV=36cm×36cm,矩阵=384×320,注射造影剂前及注射后0min、1min、2min、3min、4min、5min、6min各扫描一次,扫描时间1min/期。横轴位为主,延迟期加扫矢状位。造影剂采用钆喷替酸葡甲胺(Gd-DTPA),剂量为0.1mmol/kg体重,高压注射器注射速率为2ml/s,随后注入20ml生理盐水。
1.4 图像分析及后处理 应用GE Advantage Windows图像处理工作站。病变的形态学分析:由两名有乳腺MR工作经验的放射科医生采用双盲法独立阅片,分析动态增强MRI(dynamic contrast-enhanced MR imaging,DCE-MRI)图像,根据美国放射学会(ACR)2003年出版的乳腺MR影像报告及数据系统(breast imaging reporting and data system MRI,BIRADS MRI)[2],将病变分为肿块性和非肿块性病变两组:肿块性病变指病变具有空间占位效应并能明确地勾勒出其边界,能够描述出病变的形状、边缘;非肿块性病变是指无法明确勾勒出边界,具有一定分布特征的病变,用局灶性、节段性、区域性、多区域性及弥漫性分布来描述其形态学表现。ADC值的测量:应用Functool软件,参照MR增强扫描图像对病变准确定位,将ROI置于病变区,要求ROI略小于病变,并应尽量避免病变坏死或囊变区,在ADC图上测量其平均ADC值,将ROI置于对侧正常乳腺腺体致密区,测量其平均ADC值作为正常对照。所有数据均测量3次取平均值,以减少测量误差。
1.5 病理学分析 病理切片由病理科医生进行HE染色及免疫组化分析后做出病理诊断,将乳腺病灶分为恶性和良性两组。
2 结果
2.1 病例构成 236个乳腺病灶均经穿刺或手术得到病理证实,其中恶性155个,良性81个,具体病理类型见表中所示(表1)。
2.2 乳腺良、恶性病变的ADC值 236个乳腺病灶中,155个恶性病灶的平均ADC值为(1.08±0.32)×10-3mm2/s;81个良性病灶的平均 ADC值为(1.48±0.35)×10-3mm2/s;221个对侧正常腺体的平均 ADC值为(1.95±0.3)×10-3mm2/s。恶性病灶的 ADC值显著低于良性病灶及正常腺体(t=8.89,P<0.01)。
根据ROC曲线确定ADC界值为1.25×10-3mm2/s,即 ADC值<1.25×10-3mm2/s时诊断为恶性,其敏感性和特异性分别为78.2%和77.5%,曲线下面积为0.818。
2.3 肿块与非肿块病变的ADC值差异
2.3.1 根据BI-RADS MRI将乳腺病变按照形态学表现分组:肿块性病变159例,其中恶性103例,良性56例;非肿块性病变75例,其中恶性50例,良性25例;2例病变内既有肿块又有非肿块,故未明确分组(表2)。

表1 乳腺良、恶性病变的病理类型构成及其平均ADC值(×10-3 mm2/s)

表2 肿块和非肿块乳腺病变的ADC值(×10-3 mm2/s)
2.3.2 肿块性病变的ADC值及界值的确定 乳腺肿块性病变159例,恶性病变的平均ADC值为(1.04±0.3)×10-3mm2/s;良性病变的平均 ADC值为(1.47±0.33)×10-3mm2/s,差异有统计学意义(P<0.01);根据ROC曲线确定ADC界值为1.15×10-3mm2/s,当 ADC值<1.15×10-3mm2/s时诊断为恶性,敏感性和特异性分别为79.8%和81.8%,曲线下面积为0.861。
2.3.3 非肿块性病变的ADC值及界值确定 乳腺非肿块性病变75例,其中恶性50例,平均ADC值为(1.18±0.34)×10-3mm2/s;良性25例,平均 ADC值为(1.51±0.4)×10-3mm2/s,两者差异有统计学意义(P<0.01),根据ROC曲线确定非肿块性病变的ADC界值为1.35×10-3mm2/s,当 ADC值<1.35×10-3mm2/s时诊断为恶性,敏感性和特异性分别为78%和72%,曲线下面积为0.751。
2.3.4 在恶性病例中,表现为肿块性病变的ADC值[(1.04±0.3)×10-3mm2/s]低于非肿块性病变[(1.18±0.34)×10-3mm2/s],浸润性导管癌表现为肿块时 ADC值低[(0.98±0.2)×10-3mm2/s],而表现为非肿块时ADC值相对增高[(1.09±0.25)×10-3mm2/s];肿块性病变的 ADC界值(1.15×10-3mm2/s)低于非肿块性病变(1.35×10-3mm2/s)。
2.4 不同病理类型乳腺病变的ADC值差异
2.4.1 本组恶性病例中浸润性导管癌占85.8%(133/155),平均ADC值为(1.01±0.4)×10-3mm2/s。导管内癌 占 9.7% (15/155),平 均 ADC 值 为 (1.34±0.45)×10-3mm2/s,明 显 高 于 浸 润 性 导 管 癌[(1.01±0.22)×10-3mm2/s],差异有统计学意义(P=0.003)。导管内癌在形态学上多表现为非肿块性病变(14/15)。3例黏液腺癌的平均 ADC值为2.03×10-3mm2/s,明显高于其他恶性肿瘤。其他少见病理类型的恶性肿瘤ADC值见表1所示。
2.4.2 本组良性病例中,纤维腺病居多45.7%(37/81),平均 ADC值为(1.56±0.33)×10-3mm2/s;纤维腺病既可以表现为肿块性病变(20/37),又可以表现为非肿块性病变(17/37),肿块组的纤维腺病ADC值[(1.42±0.31)×10-3mm2/s]低于非肿块组的纤维腺病[(1.65±0.35)×10-3mm2/s](图1)。导管内乳头状瘤的ADC值低于其他良性病变。
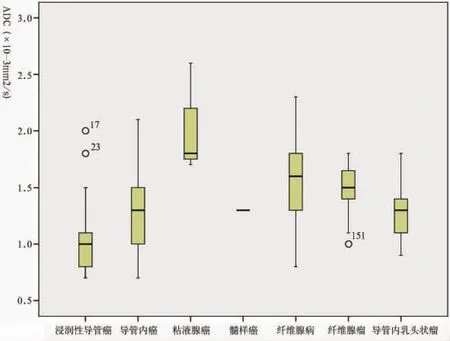
图1 不同病理类型乳腺病变的ADC值
3 讨论
3.1 乳腺良、恶性病变的ADC值差异及其诊断效能本研究表明乳腺恶性病变的ADC值较良性病变低,差异有统计学意义,根据ADC值可以鉴别乳腺良、恶性病变。根据ROC曲线选取ADC值为1.25×10-3mm2/s,其敏感性和特异性分别为78.2%和77.5%。关于乳腺良恶性病变ADC值差异的相关研究已经有很多文献报道,但各文献报道的ADC界值及其敏感性和特异性各不相同[3],分析其原因可能有以下几点。
3.1.1 DWI序列扫描参数缺乏标准化 采用不同扫描序列及选择不同的b值会导致ADC值的不同[4-5],罗建东等选用0和800s/mm2得出ADC界值为1.22×10-3mm2/s,敏感性和特异性为88.9%和87.9%[6];Yabuuchi H等采用0和1 000s/mm2得出ADC界值为1.1×10-3mm2/s[7]。本研究选取较大b值0和1 000 mm2/s,结果与Yabuuchi H等研究结果相近。
3.1.2 ADC值的测量方法缺乏标准化 由于恶性肿瘤具有异质性,肿瘤不同部分的ADC值存在差异,Marini等对直径>3cm的恶性肿瘤进行ADC值测量,发现肿瘤中心部分的ADC值[(1.07±0.21)×10-3mm2/s]显著高于周边部分[(0.94±0.18)×10-3mm2/s][8],因此准确定位 ROI是准确测量 ADC值的前提[9]。本研究结合动态增强图像进行定位,选取ROI略小于病灶,尽量避开病变坏死、囊变、出血区,尽量选取肿瘤增强最明显的部分,ROI不能小于3个体素。
3.1.3 确定ADC界值的统计学方法不同 以往有研究将恶性病变ADC值均数95%置信区间上限作为ADC界值,诊断敏感性高而特异性低[1],而随着循证医学的发展,目前在临床诊断性检验中已经应用ROC曲线来选择临界点,进行检验项目性能评价,美国国家临床实验室标准化委员会(NCCLS)也已正式批准了“应用ROC曲线图评价实验室检验项目的临床准确性指导原则”。本研究发现应用ROC曲线进行ADC界值的选取,可同时兼顾敏感性和特异性,方法简便快捷。
3.1.4 样本量的大小和病例的病理类型构成不同本研究对236例良恶性病变分析得出ADC界值为1.25×10-3mm2/s,其敏感性 (78.2%)和特异性(77.5%)较以往文献报道略低[6-7]。分析原因可能是:与以往研究相比,本研究样本量大,包括了多种病理类型的良恶性病变,减少了选择性偏移,更具有真实性和准确性,但是还有待于积累病例进一步证实。
尽管良、恶性病变的ADC值存在着统计学差异,但是良、恶之间的ADC值仍有一定的交叉重叠,因此还应联合DCE-MRI,综合分析病变的形态学和血流动力学表现,以提高MR诊断的敏感性和特异性。
3.2 肿块和非肿块性病变的ADC值差异及其诊断效能 本研究按照肿块和非肿块对病变进行分组,比较两组病变的ADC值差异,结果发现病变的形态学表现不同,其ADC值也有差异。
在恶性病例中,肿块性病变平均ADC值[(1.04±0.3)×10-3mm2/s]略低于非肿块性病变[(1.18±0.34)×10-3mm2/s];在同一病理类型中,肿块性病变ADC值低于非肿块性病变,肿块组的浸润性导管癌平均ADC值[(0.98±0.2)×10-3mm2/s]低于非肿块组的浸润性导管癌[(1.09±0.25)×10-3mm2/s]。病理对照分析结果发现:形成肿块的浸润性导管癌肿瘤细胞致密,细胞外间隙小,纤维间质成分少(图2);而表现为非肿块的浸润性乳腺癌的肿瘤细胞密度低,纤维间质多,病变内夹杂有不同程度的导管内癌成分(图3),笔者认为肿块和非肿块性病变之间细胞密度的差异可以解释ADC值差异,ADC值和肿瘤细胞密度呈负相关[1,10]。
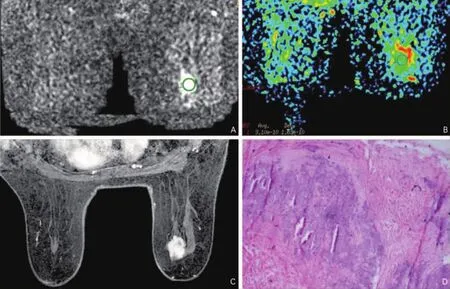
图2 表现为肿块性病变的浸润性导管癌 A.右乳内侧象限肿块,于DWI图像呈明显高信号;B.ADC图测得ADC值为0.9×10-3 mm2/s;C.于增强扫描图像不均匀增强;D.病理切片显示肿瘤细胞致密
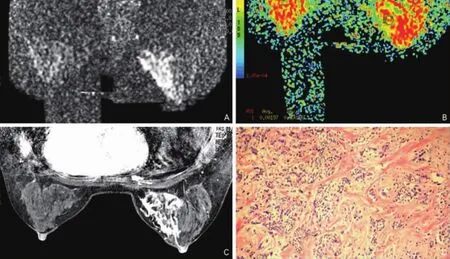
图3 表现为非肿块性病变的浸润性导管癌 A.病变于DWI图像呈节段性分布的稍高信号;B.ADC图测得病变的ADC值为1.97×10-3 mm2/s;C.动态增强扫描图像显示病变呈节段性分布,内部增强不均匀;D.HE染色病理切片显示肿瘤细胞密度小,肿瘤细胞间夹杂大量纤维间质
病变的形态学表现在一定程度上反映了肿瘤的生长方式和浸润程度等,同一病理类型的病变,可能有不同的形态学表现,也会造成ADC值的差异,因此ADC值和形态学表现相结合可以提高诊断的准确性。ROC曲线分析结果同样表明,肿块性病变的ADC界值(1.15×10-3mm2/s)要低于非肿块性病变(1.35×10-3mm2/s);DWI对于肿块性病变定性诊断效能高,敏感性79.8%,特异性81.8%,而对非肿块性病变定性诊断效能略低,敏感性78%,特异性72%。Yabuuchi H等对270个肿块性病变进行研究,得出肿块性病变的ADC界值为1.1×10-3mm2/s[7],与本研究结果相近,目前尚未见非肿块性病变ADC值特征的相关报道。
3.3 不同病理类型乳腺病变的ADC值特征 本研究结果表明不同病理类型的ADC值存在差异,恶性病例按照ADC值由低到高的顺序分别为:浸润性导管癌[(1.01±0.22)×10-3mm2/s]<髓样癌(1.31×10-3mm2/s)<导管内癌[(1.34±0.45)×10-3mm2/s]<粘液腺癌(2.03×10-3mm2/s);良性病例按照ADC值由低到高的顺序分别为:导管内乳头状瘤[(1.3±0.31)×10-3mm2/s]< 纤维腺瘤[(1.5±0.29)×10-3mm2/s]<纤维腺病[(1.59±0.55)×10-3mm2/s]。通过浸润性导管癌与导管内癌的病理学对照分析,发现浸润性导管癌肿瘤细胞致密,细胞形态大,细胞外间隙小,纤维基质较少;而导管内癌的肿瘤细胞密度低,细胞形态小,肿瘤沿着导管生长,肿瘤细胞之间存在大量的纤维基质(图4),这可能是导管内癌的ADC值高于浸润性导管癌的病理学基础。Woodhams R等报道浸润性导管癌的平均ADC值为(1.20±0.32)×10-3mm2/s,显著低于非浸润性导管癌[(1.35±0.22)×10-3mm2/s],与本研究结果非常相似[10],说明根据ADC值对导管内癌进行定性诊断有一定困难。本研究发现导管内乳头状瘤的平均ADC值低于其他良性病变,与恶性肿瘤存在交叉重叠;病理对照分析结果表明导管内乳头状瘤的肿瘤细胞致密、容易出血,这些都可能导致其ADC值较低(图5)。以往研究有类似报道[10,11],Woodhams R 等报道5例导管内乳头状瘤的平均ADC值为1.24×10-3mm2/s[(0.9~1.4)×10-3mm2/s],与本研究结果一致。因此根据ADC值容易将导管内乳头状瘤过诊断为恶性。
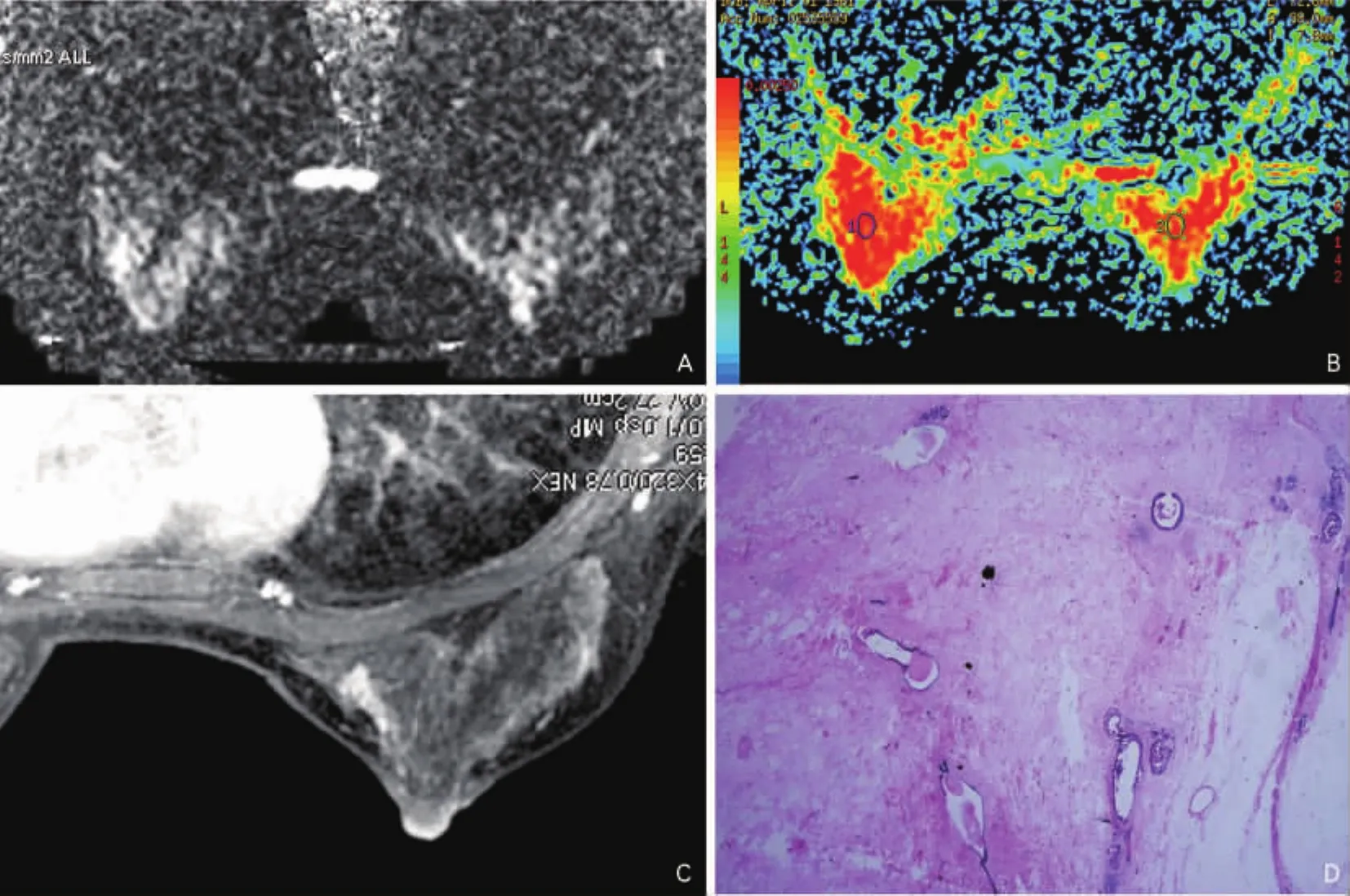
图4 导管内癌的DWI表现 A.病变于DWI图像呈等信号;B.ADC值接近于正常腺体;C.增强扫描显示病变呈节段性分布的非肿块性病变,内部增强不均匀;D.病理切片显示肿瘤细胞稀少,间质成分多
本研究还发现黏液腺癌的ADC值较其他恶性肿瘤高,对照病理学表现发现黏液腺癌的肿瘤细胞密度低而细胞外液多,可见黏液湖,这种病理学特征是黏液腺癌ADC值较高的原因。Hatakenaka M等比较了不同肿瘤的ADC值,包括纤维腺瘤16例,浸润性导管癌117例,髓样癌3例,黏液腺癌4例,发现浸润性导管癌和髓样癌的平均ADC值[(1.15±0.26)×10-3mm2/s和(0.94±0.15)×10-3mm2/s]显著低于纤维腺瘤[(1.66±0.30)×10-3mm2/s],黏液腺癌的 ADC值[(2.11±0.18)×10-3mm2/s]高于其他恶性肿瘤和纤维腺瘤[12],与本研究结果相近。因此,黏液腺癌的ADC值与良性病变存在交叉重叠,容易误诊为良性。

图5 导管内乳头状瘤 A.肿瘤于DWI上呈明显高信号,ADC值为1.1×10-3 mm2/s;B.病理切片显示肿瘤呈乳头状突起,细胞致密,肿瘤表面富含微小血管
病理学对照分析结果表明:乳腺病变的细胞密度、内部结构、间质成分及水肿、坏死、出血、囊变等多种组织成分都会影响ADC值,根据以往文献报道,ADC值不仅与病变的细胞密度呈负相关,良恶性肿瘤微血管密度的差异及其灌注效应也可能导致ADC值的差异[13],为此本研究采用了较大b值,尽量减少灌注效应对ADC值的影响。
总之,乳腺恶性病变的ADC值低于良性病变,根据ADC界值可以鉴别良、恶性乳腺病变。肿块性病变和非肿块性病变的ADC值存在差异;肿块性病变的ADC界值低于非肿块性病变的ADC界值;DWI对肿块性病变的诊断效能高于非肿块性病变。
[1]Guo Y,Cai YQ,Cai ZL,etal.Differentiation of clinically benign and malignant breast lesions using diffusionweighted imaging.J Magn Reson Imaging,2002,161(2):172-178.
[2]American College of Radiology.Breast imaging reporting and data system atlas(BI-RADS atlas).Reston,VA:A-merican College of Radiology,2003.8-62.
[3]Woodhams R,Matsunaga K,Iwabuchi R,etal.Diffusionweighted imaging of malignant breast tumors:the usefulness of apparent diffusion coefficient(ADC)value and ADC map for the detection of malignant breast tumors and evaluation of cancer extension.J Comput Assist Tomogr,2005,29(5):644-649.
[4]陈欣,闫锐,康华峰,等 .不同扩散梯度因子值的乳腺MR扩散加权成像对比研究 .中华放射学杂志,2009,43(4):356-359.
[5]李茗,张冰,周正扬,等 .MR背景抑制扩散加权成像在乳腺癌的应用 .中华放射学杂志,2009,43(1):32-37.
[6]罗建东,刘圆圆,张雪林,等 .磁共振扩散加权成像在乳腺病变鉴别诊断中的应用价值 .癌症,2007,26(2):168-171.
[7]Yabuuchi H,Matsuo Y,Okafuji T,te al.Enhanced mass on contrast-enhanced breast MR imaging Lesion characterization using combination of dynamic contrast enhanced and diffusion weighted MR images.J Magn Reson Imaging,2008,28(5):1157-1165.
[8]Marini C,Iacconi C,GiannelliM,teal.Quantitative diffusion-weighted MR imaging in the differential diagnosis of breast lesion.Eur Radiol,2007,17(10):2646-2655.
[9]Rubesova E,Grell AS,De Maertelaer V,etal.Quantitative diffusion imaging in breast cancer:a clinical prospective study.J Magn Reson Imaging,2006,24(2):319-324.
[10]Woodhams R,Matsunaga K,Kan S,etal.ADC mapping of benign and malignant breast tumors.Magn Reson Med Sci,2005,4(1):35-42.
[11]Bhattarai N,Kanemaki Y,Kurihara Y,etal.Intraductal papilloma:features on MR ductography using a microscopic coil.Am J Roentgenol,2006,186(1):44-47.
[12]Hatakenaka M,Soeda H,Yabuuchi H,etal.Apparent diffusion coefficients of breast tumors:clinical application.Magn Reson Med Sci,2008,7(1):23-29.
[13]郭勇,王辅林,蔡幼铨,等 .乳腺肿瘤表观弥散系数与组织细胞密度相关性研究 .中国医学影像学杂志,2002,10(4):241-243.

