跨越壶腹部支架对犬胆道压力和Oddi括约肌病理学影响的实验研究
温 锋 Wen,Feng
卢再鸣 Lu,Zaiming
郭启勇 Guo,Qiyong
毛晓楠 Mao,Xiaonan
梁宏元 Liang,Hongyuan
目前,微创的胆道支架置入术已成为治疗不可切除的恶性低位胆道梗阻的有效手段[1]。不管是塑料支架还是金属支架,都对延长生存期、提高生存质量有着显著的意义[2,3]。同时,跨越壶腹部的支架所引起的肠胆反流并发症也日益受到人们的关注。肠胆反流所致的支架堵塞和反流性的胆管炎都使得支架置入术的临床疗效较预期大为降低[4~7]。支架到底能否跨越壶腹部即Oddi括约肌(sphincter of Oddi,SO)功能的保留与否,一直存有争议。而且,跨越壶腹部的支架对于胆道压力和SO病理学的影响也鲜有报道。本研究通过动物模型模拟经皮经肝途径置入跨越壶腹部的胆道支架,探讨支架置入后胆道压力和Oddi括约肌病理学的变化。
1 材料与方法
1.1 实验动物 选取健康成年实验犬5只(雄性3只,雌性2只),年龄2~4岁,体重22.5~30kg。对实验犬跨越壶腹部支架置入前后胆道压力的变化进行自身对照比较。所有实验犬均经过医院伦理委员会讨论,同意进行实验研究。
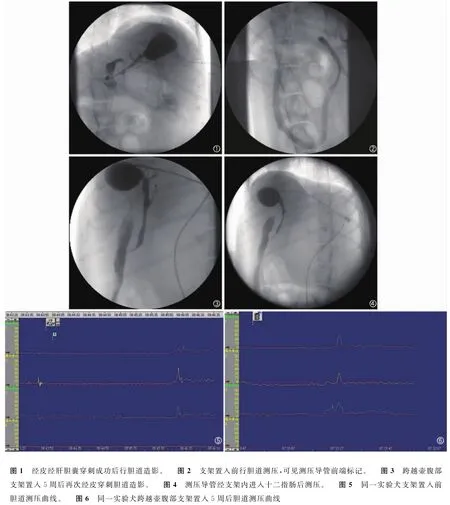
1.2 胆道支架置入 实验犬在禁食水24h后,经肌内注射速眠新Ⅱ1.5~3.0ml行全身麻醉。首先在超声(Shimadzu SDU-500C,岛津公司,日本)引导下确定胆囊位置,以5.0Fr胆道穿刺针(DLPN,Cook公司,美国)经皮经肝穿刺胆囊。成功后在DSA(Shimadzu DIGITEX 2400,岛津公司,日本)监视下以0.035inch导丝引导将5.0Fr动脉鞘经胆囊管换入胆总管内,其远端置于十二指肠。沿动脉鞘插入测压导管至十二指肠远端内6~8cm,然后回撤导管测压。待测压后,在透视下行跨越壶腹部的胆道支架置入,支架为3mm×25mm的编织镍钛合金支架(北京安泰公司),其远端5~10mm位于十二指肠内。抽尽胆囊胆汁,拔除动脉鞘后结束。术后给予青霉素160万U肌注,并继续禁食水24h。5周后重复上述方法穿刺胆囊,并插入测压导管经支架内送入十二指肠远端,回撤导管进行测压。
1.3 胆道测压方法和检测指标 采用PC polygram HR高分辨、多通道胃肠功能测定仪及相应测压软件、三通道测压导管、低顺应性水灌注系统。三通道测压导管长2m,直径1.7mm,末端有三个侧孔,相隔2mm,每孔开口于不同方向。设置电脑测压系统参数,水流速度为0.5ml/min,连接测压导管。待基线平稳后,匀速后拽导管经由壶腹部至胆总管内行测压并存储曲线。
胆道压力的检测指标包括十二指肠压(duodenal pressure,DP)、SO基础压(sphincter of Oddi basal pressure,SOBP)、收缩幅度(sphincter of Oddi contractive amplitude,SOCA)、收缩间期(sphincter of Oddi duration,SOD)、胆总管压(common bile duct pressure,CBDP)。
1.4 组织标本采集和染色 于支架置入5周后,完成测压的1~2天内采集标本。实验犬经肌内注射速眠新Ⅱ行全身麻醉。在无菌条件下经腹正中切口开腹,并逐层进入腹腔。夹闭十二指肠两端,游离胆总管,将含有支架的胆总管、壶腹部及一部分十二指肠一并取下。分离并留取壶腹部组织,放到4%多聚甲醛内固定。石蜡包埋标本,5μm连续切片,以Van Gieson染液进行胶原纤维染色。
2 结果
2.1 胆道压力 以DP作为零点,获得其余各项指标的相对值结果。跨越壶腹部支架置入5周后,测得SOBP和CBDP分别为10.58±3.98mmHg、7.43±2.20mmHg,且均高于DP,其中SOBP较支架置入前有所降低,但差异无统计学意义(P>0.05);而CBDP明显低于支架置入前,差异具有统计学意义(P<0.05)。SOCA为31.95±9.00mmHg,较支架置入前降低;SOD为4.47±1.21s,相比支架置入前缩短。SOCA和SOD与支架置入前相比,差异均有统计学意义(P<0.05)(表1,图1~6)。
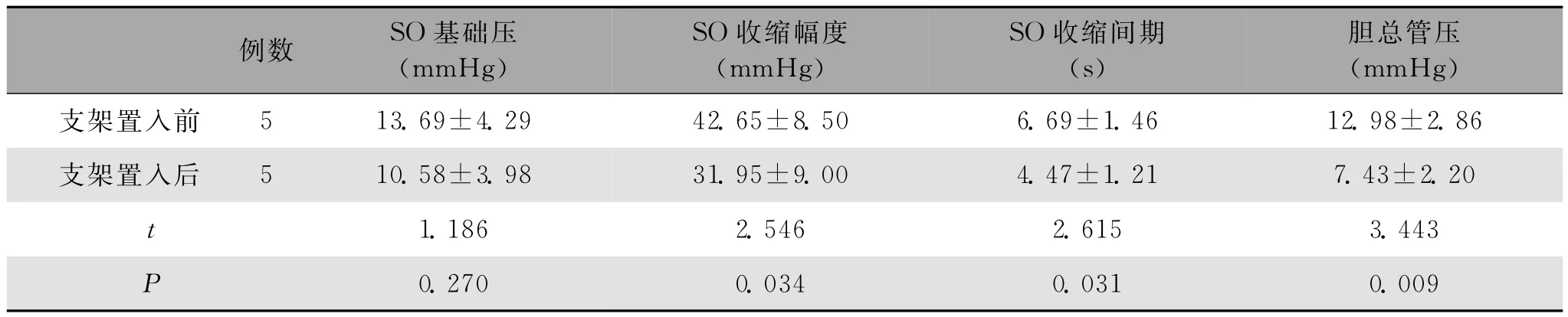
表1 支架置入前与支架置入5周后胆道测压结果
2.2 VG染色 光镜下观察(10×物镜),VG染色后平滑肌呈黄色,胶原纤维和结缔组织呈红色。跨越壶腹部支架置入后可见SO有以下病理改变。
(1)纤维化:轻度者可见平滑肌中已含有少量胶原和结缔组织纤维(图7)。而重度者则可发现肌肉组织仅呈孤立小岛状,很难发现肌纤维束,周围大量胶原纤维和结缔组织,并伴有透明变性(图8)。
(2)腺体病变:腺体呈囊状扩张,腺肌病变即腺体进入平滑肌纤维及胶原纤维组织中被环绕(图9,10)。
(3)炎性病变:表现为炎性浸润,即腺体、肌肉和结缔组织间有淋巴细胞、浆细胞、嗜酸性粒细胞浸润(图11,12)。

3 讨论
SO的运动主要由被动的基础性收缩和在此基础上的主动的紧张性收缩所构成,并对胆汁排泄和防止肠胆反流起着双重调控作用[8]。SO功能的实现与其正常的组织结构和神经、体液支配是密切相关的。本研究中,应用目前诊断SO功能异常的金标准即胆道测压法来观察跨越壶腹部支架置入后胆道的压力变化。当置入支架后,由于SO受到金属支架的压迫和限制,它的调控功能将会受到影响。SOCA的降低和SOD的缩短已经提示SO的紧张性收缩受到了明显的影响。但这种影响仅仅表现为其运动功能的不良,或者说仅仅表现在自发的紧张性收缩运动不良。因为SO的基础性收缩与紧张性收缩均受到神经、体液因素的共同调节[8]。支架置入后对于SO的影响,一方面是限制了它的运动功能,另一方面也刺激了神经和体液因素调节的增加,导致其活性阈值升高而紧张性收缩减弱。而基础性收缩的调节,可能更多受到来自胆囊收缩的反射性调节[9],这使得SOBP虽有降低趋势,但并不明显。由于SO基础压的存在,使得SO控制胆汁排泄的单向阀门功能得以部分保留,帮助CBDP能够高于DP,从而进一步维持了胆道系统内的压力梯度,就为最大程度地抑制肠胆反流提供了可能。同时,SO基础性收缩的存在也说明了支架对于SO的影响仅仅局限于功能上的减弱,其结构的完整性并没有受到彻底性的破坏。
支架置入后,胆道末端变为持续开放状态,胆汁不断地流入十二指肠使得胆总管内的CBDP明显地降低。这与以前的研究结果是相同的[10~12]。而且,SO紧张性收缩的主要作用是使胆汁充盈远端胆道[8],这样以来SO紧张性收缩的减弱必然会导致缺少胆汁充盈的远端胆道压力下降。但由于肝内胆汁的正常分泌以及胆囊的正常收缩,胆道系统内的压力梯度及胆汁流动的动力得以维持。这样就使得降低的CBDP能够高于DP,其与DP间的压力梯度继续存在,胆汁仍能顺利地流入十二指肠,从而不致于产生明显的肠胆反流。而且,十二指肠压力的正常也是保证不发生肠胆反流的前提条件之一。如果在跨越壶腹部置入支架的同时,十二指肠由于病理或解剖的原因出现压力增高,则发生肠胆反流的可能性将大大增加。
SO结构和功能的完整是保证其正常活动的前提。但到目前为止,跨越壶腹部的支架置入对于SO组织结构有哪些影响还不是十分清楚。Haley等[13]观察了负鼠SO的组织结构发现,SO环绕的管腔由内向外的结构依次为由柱状细胞组成的上皮组织、疏松结缔组织、较薄的纵行肌和发达的环形肌。有时在最外层可见一些不连贯的纵行肌束[14]。在本研究中,跨越壶腹部置入支架5周后,壶腹部SO各层发生了不同程度的纤维化、腺体病变和炎性反应等病理变化。这些改变即是支架置入后对SO机械性压迫、刺激的结果,同时也为SO在支架影响下发生功能上的变化提供了病理基础。特别是作为SO主要结构的平滑肌部分,其内出现的纤维化、腺肌变和炎性细胞浸润,将会直接影响到SO的运动功能。当然,研究中上述这些病理改变的程度是有限的,而且SO的各层结构也是相对完整的,这样就保证了SO的主要运动功能,同时也与胆道测压所提示的SO运动功能部分减弱的结果相一致。
值得注意的是,狗的胆总管直径仅约为2.5mm,较人类的小很多。而且实验中植入支架的直径为3mm。虽然本研究在观察时间内没有发现支架的堵塞,但较小的支架直径在长时间内势必会增加胆泥等因素导致支架梗阻的可能性。而且测压导管的直径为1.7mm,实验过程中不可避免会有碰壁的情况发生。尽管采用了三通道测压导管、多点取均值的方法,但难免会对结果产生影响。毕竟,本研究中的样本例数较少,而且只观察了支架置入后较短时间(5周)内胆道压力和SO组织病理学的变化,而支架对于SO功能及胆道动力方面的长期影响仍需进一步观察。
[1]Katsinelos P,Paikos D,Kountouras J,etal.Tannenbaum and metal stents in the palliative treatment of malignant distal bile duct obstruction:a comparative study of patency and cost effectiveness.Surg Endoscopy,2006,20(10):1587-1593.
[2]Prat F,Chapat O,Ducot B,etal.A randomized trial of endoscopic drainage methods for inoperable malignant strictures of the common bile duct.Gastrointest Endosc,1998,49(1):1-7.
[3]Levy MJ,Baron TH,Gostout CJ,etal.Palliation of malignant extrahepatic biliary obstruction with plastic versus expandable metal stents:an evidenced-based approach (Review).Clin Gastroenterol Hepatol,2004,4(2):273-285.
[4]Okamoto T,Fujioka S,Yanagisawa S,etal.Placement of a metallic stent across the main duodenal papilla may predispose to cholangitis.Gastrointest Endosc,2006,63(6):792-796.
[5]Kaskarelis IS,Minardos IA,Abatzis PP,etal.Percutaneous metallic self-expandable endoprostheses in biliary obstruction caused by metastatic cancer.Hepatogastroenterology,1996,43(10):785-791.
[6]Soderlund C,Linder S.Covered metal versus plastic stents for malignant common bile duct stenosis:aprospective,randomized,controlled trial.Gastrointest Endosc,2006,63(7):986-995.
[7]Dua KS,Reddy ND,Rao VG,etal.Impact of reducing duodenobiliary reflux on biliary stent patency:an in vitro evaluation and a prospective randomized clinical trial that used a biliary stent with an antireflux valve.Gastrointest Endosc,2007,65(6):819-828.
[8]Bosch A,Pe~na LR.The sphincter of oddi(Review).Dig Dis Sci,2007,(5):1211-1218.
[9]陈阳龙,郑启昌 .胆肠吻合与引流对胆道动力的影响.临床消化病杂志,2001,13(4):149-157.
[10]Youngelman DF,Marks JM,Ponsky T,etal.Comparison of bile duct pressures following sphincterotomy and en-dobiliary stenting in a canine model.Surg Endoscopy,1997,11(2):126-128.
[11]Marks JM,Ponsky JL,Shillingstad RB,etal.Biliary stenting is more effective than sphincterotomy in the resolution of biliary leaks.Surg Endosc,1998,12(4):327-330.
[12]Marks JM,Bower AL,Goormastic M,etal.A comparison of common bile duct pressures after botulinum toxin injection into the sphincter of Oddi versus biliary stenting in a canine model.Am J Surg,2001,181(1):60-64.
[13]Haley-Russell D,Calabuig R,Moody FG.Anatomy of the bilioduodenal junction of the oppossum.Anatomy Recsearch,1992,232(4):579-586.
[14]Ishibashi Y,Murakami G,Honma T,etal.Morphometric study of the sphincter of oddi(hepatopancreatic)and configuration of the submucosal portion of the sphincteric muscle mass.Clin Anat,2000,13(3):159-167.

