幼年雄性SD大鼠营养性肥胖模型的建立
王 磊,陈 虹
(石河子大学药学院·省部共建新疆特种植物药资源教育部重点实验室,新疆 石河子 832002)
肥胖不仅与高血压、高脂血症、糖尿病等多种慢性疾病相关,而且是影响儿童青少年身心健康的世界性公共卫生问题,因此,控制和治疗肥胖显得尤为重要。目前,研究肥胖及其相关疾病的发病机制和防治措施任务迫切,建立肥胖动物模型则是开展此类研究的前提和手段[1-3]。笔者采用自制的高能饲料喂养SD大鼠,成功建立了营养性肥胖大鼠模型[4-5],现报道如下。
1 材料与方法
1.1 实验材料
酶标仪(美国热电集团);电子天平(分度值0.01 g,梅特勒-托利多仪器<上海>有限公司);TGL-16M台式高速冷冻离心机(湖南凯达科学仪器有限公司)。甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的酶法测定试剂盒均为中生北控生物科技股份有限公司产品;瘦素检测试剂盒(批号为0903252)。刚离乳的雄性SD大鼠48只,SPF级,体重为60~80 g,购自新疆维吾尔自治区实验动物研究中心,批号为SCXK(新)2003-0002。随机均分为模型组和对照组,分别喂养高能量饲料和基础饲料。基础饲料由石河子大学动物中心提供,高能量饲料按基础饲料60%、猪油15%、鸡蛋10%、雀巢全脂奶粉15%及鱼肝油适量配方而成。两组大鼠每天自由饮食。
1.2 肥胖相关指标的测定
每日常规观察大鼠进食和活动情况,在第4周末和第8周末分别从每组动物中取12只,测量体重和体长(鼻尖至肛门的距离)[6],按公式计算 Lee's指数[7]:Lee's index=。然后进行眼眶取血,颈椎脱臼处死。打开腹腔,取出肠系膜、附睾及肾周等处的脂肪,生理盐水冲洗干净后用滤纸吸干,再用电子天平称量,即为内脏脂肪质量。脂肪重量系数[8]=脂肪质量(g)/体重(100 g)。
造模第4周末和第8周末分别眼眶取血,肝素抗凝,3 000 r/min离心10 min,分离血浆,按试剂盒说明书测定血浆TG,TC,LDL-C,HDL-C。血浆瘦素采用酶联免疫法测定。
1.3 统计学方法
2 结果
高能饲料对幼年大鼠体重、体长、Lee's指数、内脏脂肪质量及其系数的影响见表1,对血脂和血浆瘦素的影响见表2。
表1 两组大鼠造模不同时期体重、体长及Lee’s指数、内脏脂肪质量及其系数变化情况(±s)
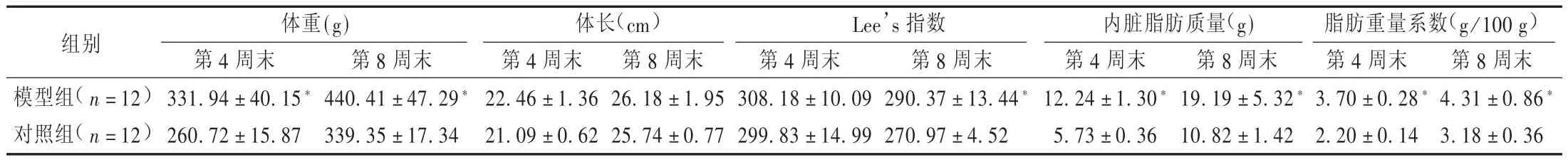
表1 两组大鼠造模不同时期体重、体长及Lee’s指数、内脏脂肪质量及其系数变化情况(±s)
注:与对照组比较,*P<0.05。
组别 体重(g) 体长(cm) Lee’s指数 内脏脂肪质量(g) 脂肪重量系数(g/100 g)模型组(n=12)对照组(n=12)第4周末331.94±40.15*260.72±15.87第8周末440.41±47.29*339.35±17.34第4周末22.46±1.36 21.09±0.62第8周末26.18±1.95 25.74±0.77第4周末308.18±10.09 299.83±14.99第8周末290.37±13.44*270.97±4.52第4周末12.24±1.30*5.73±0.36第8周末19.19±5.32*10.82±1.42第4周末3.70±0.28*2.20±0.14第8周末4.31±0.86*3.18±0.36
表2 两组大鼠造模不同时期血脂和血浆瘦素变化情况(±s)

表2 两组大鼠造模不同时期血脂和血浆瘦素变化情况(±s)
注:与对照组比较,△P<0.05,▲P<0.01。
组别TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) 瘦素(ng/L)模型组(n=12)对照组(n=12)第4周末2.63±0.57△1.10±0.20第8周末3.77±1.47△1.78±0.46第4周末1.59±0.23△0.86±0.15第8周末3.19±0.73△1.63±0.14第4周末0.52±0.10 0.79±0.09第8周末1.00±0.09△1.95±0.39第4周末0.47±0.07△0.35±0.05第8周末0.85±0.05△0.60±0.05第4周末572.26±155.91▲221.81±53.55第8周末1 957.80±713.58▲576.74±158.96
由表1可见,模型组大鼠体重增长较快,第4周末已明显超过对照组(超重27%),第8周末超重更明显(超重30%)。随着大鼠周龄的增加,肥胖程度在逐渐增加,说明该高能量饲料有促使幼年大鼠体重过度增长的作用。但两组大鼠体长增长在第4周末和第8周末均无差异。第4周末模型组大鼠Lee's指数大于对照组,但无差别,而第8周末则明显大于对照组(P<0.05),说明随着饲养时间的延长,大鼠的肥胖程度增加。第4周末模型组大鼠内脏脂肪质量及其系数已明显大于对照组,到第8周末,两组内脏脂肪则进一步增多,模型组更明显大于对照组,并且明显大于本组第4周末时的水平(P<0.05)。说明高能量饲料可使幼年大鼠内脏脂肪含量明显增多,且随造模时间[9]的延长,内脏脂肪含量在大鼠过度增加的体重中占有更大的比重。
由表2可见,造模第4周末模型组大鼠血浆TC、TG和LDL-C已升高,HDL-C则有下降趋势;至第8周末,模型组大鼠血浆TC、TG和LDL-C则升高更显著,同时HDL-C也明显降低,说明进食高能量饲料可使幼年大鼠血浆 TC、TG和LDL-C升高,同时HDL-C降低,这种异常在造模第4周末已出现,随着造模时间的延长而更加明显。第4周末模型组大鼠血浆瘦素含量大于对照组,第8周末差别更明显。说明高能饲料喂养能够促使幼年大鼠肥胖,并且使肥胖大鼠瘦素含量升高,导致高瘦素血症(瘦素抵抗)[10]。
3 讨论
肥胖基因的表达产物瘦素(leptin)是由167个氨基酸组成的相对分子质量为16 000的分泌性蛋白类激素,主要由脂肪组织合成分泌,经血液运输至下丘脑食欲中枢,与受体结合后发挥抑制食欲、减少能量摄入、增加能量消耗、抑制脂肪合成等作用[11-15]。瘦素水平主要由皮下脂肪总量决定,当皮下脂肪增多时,血中瘦素水平升高。由于瘦素的正常生理功能主要是通过瘦素受体介导的,肥胖症时瘦素水平的上升直接造成了瘦素受体水平的反馈性下调或受体后信号转导受阻,这就是瘦素抵抗。本实验结果显示,高能饲料组瘦素表达水平显著高于基础饲料组(P<0.05),说明高能饲料可引起高瘦素血症。
制备动物肥胖模型的方法较多[16],如电刺激损伤、谷氨酸单钠选择性损伤下丘脑均可制作成实验性肥胖动物模型。但这些方法操作复杂,不易掌握,且均是下丘脑性肥胖模型。而营养性肥胖是指全身脂肪组织的过度增生性慢性疾病,不是由某些先天遗传性疾病或代谢性疾病及神经和内分泌疾病所引起的继发性病理性肥胖。大鼠在6~10周龄正处于青春期,本次实验以高能量饮食诱发的幼年雄性大鼠营养性肥胖模型,能在一定程度上复制出青少年单纯性肥胖症,而且方法简便易行。
高能饲料喂养的大鼠体重超过普通饲料喂养大鼠体重的20%则可认为是实验肥胖大鼠造模成功,制备营养性肥胖大鼠模型的关键在于饲料配方。本实验中,模型组大鼠在喂养期间的进食和活动情况正常,所喂养大鼠造模成功率在第8周末为58%,比以往的实验模型成功率高,且实验饲料配方简单而经济。20%猪油饲料油脂含量较高[17],质地柔软,难以干燥,浪费严重,易致大鼠食量减少,皮毛沾油较多,故笔者将猪油含量调至15%,加入10%的鸡蛋,使配方饲料易于制作成形,容易干燥,便于实验操作,肥胖大鼠模型制成率高,值得推广。
肥胖大鼠成模后其TG,TC,LDL-C均较对照组升高,而HDL-C较对照组降低,表明高能量饮食可致大鼠肥胖后血脂异常,并且血脂各成分的变化并不一致,以LDL-C升高幅度为著。实验还发现高脂饲料饲养的模型组大鼠毛色渐黄,光泽缺失,这是由于高能饲料中热量过高、营养不均衡导致大鼠营养不良[3],还是高能饲料饲养后引起大鼠血脂异常诱发的病理生理变化,尚有待进一步研究。
[1]钱伯初.肥胖动物模型的制备原理和方法[J].中国药理学通报,1993,9(1):75-76.
[2]钱伯初,史 红,吕燕萍.肥胖动物模型的研究进展[J].中国新药杂志,2007,16(15):1 159-1 162.
[3]Mercer JG,Archer ZA.Diet-induced obesity in the Sprague-Dawley rat:dietary manipulations and their effect on hypothalamic neuropeptide energy balance systems[J].Biochem Soc Trans,2005,33(5):1 068-1 072.
[4]向建军,王文祥,许榕仙.幼年雌性SD大鼠营养性肥胖模型的建立[J].实用预防医学,2006,13(1):34-36.
[5]杨爱君,崔 雁,叶卉初,等.营养性肥胖动物模型的建立[J].临床和实验医学杂志,2005,4(3):156-157.
[6]曲晓义,张国平,陈 愉,等.单纯性肥胖大鼠的肥胖特点及瘦素的变化[J].中国病理生理杂志,2000,16(11):1 233-1 235.
[7]刘志诚,孙凤岷,韩 燕,等.针刺治疗单纯性肥胖症的实验研究[J].针刺研究,1998,23(1):68-75.
[8]李小林,谢 琳,文辉才,等.维生素D致肥胖大鼠模型的实验研究[J].江西医学院学报,2002,42(6):1-2.
[9]崔明霞,高 琲,闵光宁,等.造模持续时间对大鼠高营养性肥胖模型制备的影响[J].中国药理学通报,2008,24(3):412-416.
[10]孙文广,孙长颢.高能饲料诱导大鼠肥胖及对其脂质代谢的影响[J].中国公共卫生,2004,20(5):514-515.
[11]Ram E,Vishne T,Maayan R,et al.The relationship between BMI,plasma leptin,insulin and proinsulin before and after laparoscopic adjustable gastric banding[J].Obesity Surgery,2005,15(10):1 456-1 462.
[12]Wu DM,Shen MH,Chu NF.Relationship between plasma leptin levels and lipid profiles among school children in Taiwan——the Taipei Children Heart Study[J].European Journal of Epidemiology,2001,17(10):911-916.
[13]Kapsimalis F,Varouchakis G,Manousaki A,et al.Association of sleep apnea severity and obesity with insulin resistance,C-reactive protein,and leptin levels in male patients with obstructive sleep apnea[J].Lung,2008,186(4):209-217.
[14]Scarpace PJ,Matheny M,Zhang Y,et al.Leptin resistance exacerbates diet-induced obesity and is associated with diminished maximal leptin signalling capacity in rats[J].Diabetologia,2005,48(6):1 075-1 083.
[15]Louis GW,Myers MG Jr.The role of leptin in the regulation of neuroendocrine function and CNS development[J].Rev EndocrMetab Disord,2007,8(2):85-94.
[16]谭正怀,莫正纪.三种肥胖动物模型研究概况[J].中国实验动物学杂志,2001,11(3):176-179.
[17]孙 志,张中成,刘志诚.营养性肥胖动物模型的实验研究[J].中国药理学通报,2002,18(4):466-467.

