猪瘟活疫苗(种毒)鉴别检验阳性血清制备
戴志红,关孚时,蒋 卉,孙海燕,李 翠,赵丹彤,关永梅,石宝兰,张慧芳,张瑞婷,张立春,邓 永,江 波,孟画诗,王在时*
(1.中国兽医药品监察所,北京100081;2.金宇保灵生物药品有限公司,内蒙古呼和浩特010030)
猪瘟(Classical sw ine fever,CSF)是由CSF病毒(CSFV)引起的一种高度接触性、致死性猪传染病,给世界上很多国家和地区带来了严重经济损失。世界动物卫生组织将其列为法定通报性疫病,我国将其列为一类动物传染病。
我国目前实行强制免疫作为猪瘟防制的主要手段,因此保证疫苗质量显得尤为重要。鉴别检验是动物活疫苗质量检验的重点之一,其目的是保证疫苗(菌毒种)的特异性,猪瘟兔化弱毒活疫苗也不例外。《中华人民共和国兽用生物制品规程》(2000年版)[1]和《中华人民共和国兽药典》(2005年版3部)[2]都要求对猪瘟活疫苗(包括种毒)进行鉴别检验,但由于鉴别检验用阳性血清缺乏,该工作实际并未进行,给疫苗质量监管留下了隐患。为解决生产、检验需要,本实验制备了猪瘟活疫苗(种毒)鉴别检验阳性血清,并进行了验证试验。
1 材料和方法
1.1 种毒和细胞 CSFV石门株(F114)、猪瘟兔化弱毒种毒(F480)、CSFV Thiverval株(F18)和 PK-15细胞(F145)由中国兽医药品监察所鉴定、保存。
1.2 主要试剂 猪瘟活疫苗(淋脾毒),由乾元浩生物股份公司提供;猪瘟ELISA抗体检测试剂盒购于Idexx公司;猪瘟荧光抗体由中国兽医药品监察所制备;Taq DNA聚合酶、dNTPs、RNasin和 RNase Free Water均购自北京鼎国生物公司;RNA提取试剂TRIzol Reagent和反转录酶SSⅢ均购自Invitrogen公司;MEM培养基、胎牛血清和胰酶均购自Gibico BRL公司;48孔细胞培养板购自CoStar公司。
1.3 实验动物 实验猪为普通健康非免疫猪,体质量20kg左右,购于内蒙某猪场,经农业部兽医诊断中心检测为口蹄疫、猪伪狂犬病、猪瘟、猪繁殖与呼吸综合征、猪细小病毒病、牛病毒性腹泻/粘膜病病原、抗体阴性(病原用PCR或RT-PCR方法检测,抗体用ELISA方法检测),隔离饲养;体质量18g~22g小白鼠、体质量1.5kg~2kg日本大耳白兔、体质量350g~400g豚鼠,均为清洁级,购于北京维通利华实验动物技术有限公司。
1.4 免疫原制备 按文献方法[1]在强毒隔离动物室制备免疫原,共获得CSFV石门株血毒4000m L(≥105MLD/m L),-20℃以下冻存备用。
1.5 血清制备 在强毒隔离动物室制备血清。选4头猪,每头猪免疫猪瘟活疫苗2头份;14d后每头猪肌肉注射免疫原100m L;以后每头猪每隔10d肌肉或腹腔注射免疫原200m L~300m L,同时进行ELISA抗体水平监测,直至抗体效价接近峰值时分别采血,分离血清。
1.6 血清过滤、分装、冻干、熔封 将4批血清分别先经0.4μm无菌滤膜加压过滤,再经0.22μm无菌滤膜加压过滤;随后用瓶颈分液器(分装精度为±0.01m L)无菌分装至1m L灭菌长安瓿,分装过程中用搅拌子保持低速搅拌;按常规方法冻干后抽真空、熔封。
1.7 成品检验
1.7.1物理性状、无菌检验、安全检验、支原体检验、真空度测定4批产品均随机抽取规定数量的样品,按文献方法[1]和[2]进行。
1.7.2剩余水分测定采用真空干燥法[1]。
1.7.3均一性检验每批随机抽取20支样品,随机分为2组,分别进行称重试验。将每支安瓿称重后,分别仔细收集玻璃残渣;将安瓿内容物溶解后用去离子水冲洗干净,烘干,连同各自的玻璃残渣分别称重;再用安瓿打开前的总重量减去该重量,即可计算冻干血清的重量。用狄克逊准则剔除数据中的异常值[3],再进行t检验和F检验[3-4],即用t检验法检验两组测定结果的平均值是否存在统计学差异,用F检验法检验两组测定结果的方差是否存在显著性差异。若两组测定结果的均值和方差无显著差异,则被测样品均一性符合要求。
1.7.4特异性检测每批随机抽取5支样品,同一批次复溶混合后委托农业部兽医诊断中心进行口蹄疫病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、牛病毒性腹泻/粘膜病毒抗体检测(均用ELISA方法进行)。
1.7.5残余CSFV检测每批随机抽取5支样品,同一批次复溶混合后按文献[5]和[6]的分别进行免疫荧光和套式RT-PCR检测,以CSFV Thiverval株作阳性对照,以PBS作阴性对照。
1.7.6兔体中和效价测定将4批血清分别按照1∶400~1∶3200倍比稀释。将猪瘟兔化弱毒种毒用灭菌生理盐水稀释至100兔体感染量(Rabbit infection dose,RID)/m L,与等量的稀释血清充分混合,置10℃~15℃中和1h,其间振摇2次~3次;同时设立种毒阳性对照(50RID/m L)、阴性对照(4批血清的所有稀释度) 和空白对照(生理盐水)。中和结束后,分别接种大耳白兔2只,每只耳缘静脉接种1m L。按文献方法和标准[1-2]测温。阳性对照出现热反应,而阴性对照和空白对照不出现热反应,则试验成立。以中和后完全不引起热反应的血清最高稀释度作为该血清的中和效价。
1.8 鉴别检验验证试验 将5种经效力检验合格的猪瘟活疫苗和猪瘟兔化弱毒种毒分别用灭菌生理盐水稀释至100RID/m L,与等量按各自中和效价稀释的4批血清充分混合,置10℃~15℃中和1h,其间振摇2次~3次;同时设立阳性对照(50RID/m L种毒和疫苗)、阴性对照(按中和效价稀释的血清)和空白对照(生理盐水)。中和结束后,分别接种大耳白兔2只,每只耳缘静脉接种1m L。按文献方法和标准[1-2]测温。阳性对照出现热反应,而阴性对照和空白对照不出现热反应,则试验成立。按实际中和结果验证各批次血清的鉴别检验效果。
2 结果
2.1 物理性状、无菌检验、安全检验、支原体检验、真空度测定 结果均符合规定。
2.2 剩余水分测定 采用真空干燥法对抽取样品进行了剩余水分测定,结果水分含量均低于4%(表1)。
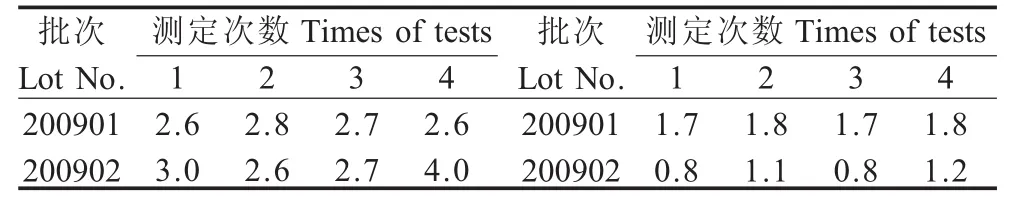
表1 冻干血清剩余水分含量(%)Table 1The residualmoisture contents of lyophilized antisera(%)
2.3 均一性检验 对4批样品(每批2组)的称重结果进行了经t检验和F检验,结果所有统计量t和F均小于其临界值(表2),表明每个批次内两组测定结果的平均值和方差无显著性差异,说明4批血清样品的均匀性良好。
2.4 特异性检验 4批样品经农业部兽医诊断中心检测,结果口蹄疫病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、牛病毒性腹泻/粘膜病病毒ELISA抗体均为阴性。
2.5 残余CSFV检测 将样品复溶后分别接种PK-15细胞,再进行免疫荧光染色,结果均为阴性(图略);将样品复溶后进行套式RT-PCR核算检测,结果均为阴性(图1)。
2.6 兔体中和效价测定 4批血清倍比稀释后分别与猪瘟兔化弱毒种毒中和,测定兔体中和效价(表3)。
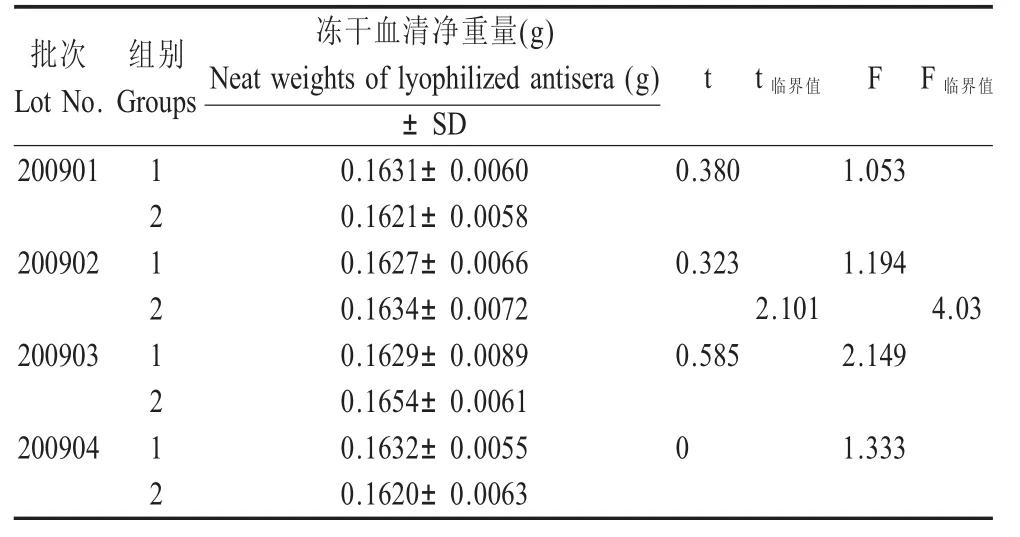
表2 均一性测定结果Table 2The results of uniform ity tests
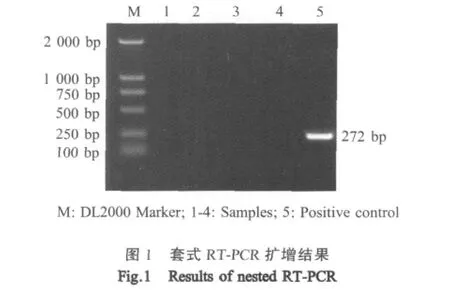
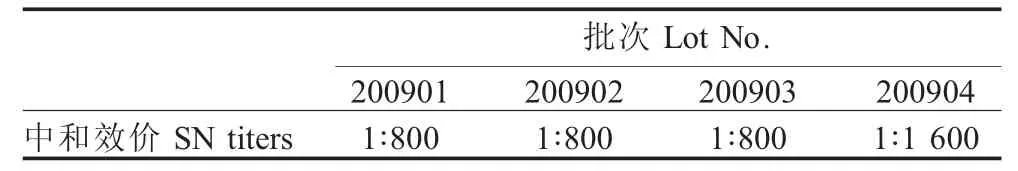
表34 批血清的兔体中和效价Table 3The neutralization titers of 4antisera tested in rabbits
2.7 鉴别检验验证试验 将4批血清分别按各自中和效价稀释后,与100RID/m L的CSFV种毒和5种CSF疫苗中和后分别注射大耳白兔,进行鉴别检验验证试验。结果显示,4批产品中和种毒和疫苗后,均不引起家兔产生热反应和其他异常反应(表4),表明该4批血清能特异性中和猪瘟疫苗和种毒,可以用于其鉴别检验。
3 讨 论
鉴别检验是活疫苗(包括其生产用菌毒种)的常规检验项目之一,其目的是保证疫苗(菌毒种)的特异性,即检验疫苗(菌毒种)是否具备其应有的免疫学或生物学特性。病毒类活疫苗(种毒)鉴别检验常用的方法是检验活疫苗(种毒)是否能被已知的单特异性抗体完全中和。由此可见,鉴别检验的目的和方法有别于外源病毒检验或效力检验,其重要性不容忽视。
表4 对种毒和5种猪瘟疫苗鉴别检验验证结果Table 4Verification of identity tests to seed virus and 5CSF vaccines
为提高血清质量,本实验采取了以下措施:对实验猪和制备的血清进行了常见病原、抗体检测,保证了血清的特异性;在采血前,对抗体水平进行监测,尽量提高血清效价;在分装前进行了2次过滤,在分装过程中保持低速混匀,并且进行了均一性检验,保证了每批样品的均一性;以免疫荧光和套式RT-PCR方法对血清进行了残余CSFV检测,提高了其生物安全性;用猪瘟兔化弱毒种毒和不同厂家生产的5种疫苗进行了鉴别检验验证试验,保证了血清的实际使用效果。
在过程中实验猪经强毒反复攻击,因此该血清存在残余强毒的风险,为此本试验进行了残余CSFV检测,结果显示免疫荧光和套式RT-PCR检测均为阴性。经初步分析,以下几点因素可能有助于减少血清残余CSFV:选择健康状况良好的实验猪,基础免疫剂量充足并且在抗体阳转后开始攻毒;我国驯化发明的猪瘟兔化弱毒疫苗本身非常优异,该疫苗免疫不仅能诱导完全的临床保护(不发病),而且能产生完全的“病毒学”保护(不出现病毒血症,不排毒)[7];采血时机的把握,一般在监测到抗体峰值后一周内采血为宜。即便如此,仍不能完全排除血清残余CSFV的可能性,因此仍有必要进行严格的CSFV检测,一旦CSFV检测结果阳性,则应该用钴60射线照射处理,但会显著降低抗体效价。
另外,由于易受动物个体差异、环境和人为操作等影响,在生产实际中用兔体反应测定猪瘟兔化弱毒含量可能存在较大误差,因此在使用该血清进行检验时可以参照标定的中和效价,根据实际情况适当降低血清稀释度进行中和试验,确保血清能将兔化弱毒完全中和。
[1]农业部第四届兽用生物制品规程委员会.中华人民共和国兽用生物制品规程[M].北京:化学工业出版社,2000.
[2]中国兽药典委员会.中华人民共和国兽药典[M].2005年版3部,北京:中国农业出版社,2006.
[3]全浩.标准物质及其应用技术[M].北京:中国标准出版社,2003.
[4]蒋子刚,顾雪梅.分析测试中的数理统计与质量保证[M].上海:华东化工学院出版社,1991.
[5]戴志红,赵耘,谢磊,等.猪瘟病毒检测技术规程[A].兽医微生物菌种资源标准化整理整合及共享试点项目组.兽医微生物菌种资源描述规范及技术规程[M].北京:中国农业科学技术出版社,2008.
[6]戴志红,赵耘,宁宜宝,等.猪瘟病毒FJFQ-39株的毒力鉴定[J].中国预防兽医学报,2008,30(9):694-698.
[7]仇华吉,童光志,沈荣显.猪瘟兔化弱毒疫苗-半个世纪的回顾[J].中国农业科学,2005,38(8):1675-1685.

