猪圆环病毒2型感染小鼠脾脏内CD4+CD25+调节性T细胞的动态变化
许道军,余兴龙,邓治邦,袁安文,王乃东,薛立群
(湖南农业大学动物医学院,湖南长沙410128)
猪圆环病毒2型 (Porcine circovirus 2,PCV2)为环状单链DNA病毒[1],与断奶仔猪多系统衰竭综合征、皮炎肾病综合症、猪繁殖与呼吸综合征、增生性肠炎等病原相关[3],危害养猪业。
机体感染PCV2后难以激发有效的免疫反应来清除病毒,常发展成长期带毒或持续性感染[4-5],目前尚不清楚PCV2免疫抑制现象的机理。CD4+CD25+调节性T细胞(T regulaotry cell,Tregs)是近年来发现的一类具有免疫抑制作用的细胞,在维持自身抗原的免疫耐受、控制免疫反应强度等方面发挥关键性作用[6]。已发现多种病原微生物可通过在宿主体内诱导Tregs的增殖来介导免疫耐受和免疫抑制作用[7]。对于PCV2感染过程中是否通过同样的途径介导免疫抑制作用目前尚无报道。
在PCV2感染动物模型方面,已有报道利用小鼠成功构建了PCV2感染模型[8-11]。为揭示Tregs是否在PCV2感染中介导了免疫抑制作用,本实验通过分离的PCV2野生毒株在小鼠体内进行8次传代后获得PCV2感染小鼠实验模型,检测PCV2感染小鼠后脾脏内Tregs占CD4+T细胞比例的动态变化,为进一步研究PCV2对免疫系统的抑制作用机理提供实验依据。
1 材料和方法
1.1 病毒株及实验动物 PCV2-1BP0毒株(EU095020),为本实验室分离保存,采用PK-15细胞培养,TCID50为4×104.0/m L;实验动物为清洁级昆明小鼠60只,体质量约20g~25g,购自湖南省斯莱克景达实验动物中心。
1.2 主要试剂 红细胞裂解液、染色缓冲液、FITC标记的抗小鼠CD4单克隆抗体(MAb)、PE标记的抗小鼠CD25MAb、PE标记大鼠IgG1和FITC标记大鼠IgG2b同型对照均购于eBioscience公司;鼠抗PCV2多克隆抗体由本实验室制备;二步法免疫组化检测试剂及DAB显色剂均购自北京中杉金桥生物技术有限公司。
1.3 PCV2感染小鼠模型建立及检测 将30只小鼠随机分为6组,每组5只,将PCV2200μL经腹腔注射感染小鼠。另取30只作为阴性对照。试验组和对照组小鼠隔离饲养。在感染后不同日龄迫杀小鼠后,取腹股沟淋巴结、颌下淋巴结、肺门淋巴结及肠系膜淋巴结,提取DNA。采用PCR方法检测PCV2DNA,以PK-15培养PCV2为阳性对照。引物序列为:PCV2P1:GCGGGCCAAAAAAGGTAC AGTTCC;PCV2P2:ACCAGCGCACTTCGGCAGC GGCAG。PCV2引物由Invitrogen公司合成。PCR反应条件为:94℃ 5min;94℃ 30s,60℃ 30s,72℃30s,共35个循环。PCR产物经2%琼脂糖凝胶电泳后观察。对PCR检测呈阳性的PCV2感染小鼠淋巴结进行免疫组化试验检测PCV2,方法参照文献[12]。
1.4 小鼠脾细胞悬液的制备 于感染后第5d、10d、15d、20d、30d、60d分批迫杀小鼠,取脾脏用200目不锈钢网研磨制备单个脾细胞悬液,离心弃上清后用预冷的PBS洗涤1遍,然后加入5m L红细胞裂解液室温作用5min,加入PBS 20m L终止裂解反应,1000r/m in离心5m in,去上清后用染色缓冲液调整细胞浓度为1×107/m L。
1.5 细胞染色 每管加入1×107/m L脾细胞悬液100μL,加入0.25μg FITC标记的抗CD4MAb和0.125μg PE标记的抗CD25MAb,同时设立同型对照及FITC标记的抗CD4MAb和PE标记的抗CD25MAb进行单独标记。混匀后常温避光孵育30min,用预冷的流式细胞染色缓冲液0.5m L洗涤2次,并以流式细胞染色缓冲液500μL重悬细胞备用。
1.6 流式细胞仪检测 先以前向散射和侧向散射设定淋巴细胞门,然后以CD4设定CD4+T细胞亚群,检测CD4+T细胞亚群中CD4+CD25+细胞百分率。每次分析10000个细胞。荧光强度以二维dot-plot散点图表示,由软件自动分析结合CD4及CD25MAb的阳性细胞个数和百分比,参照FITC-CD4/PE-CD25双参数图计算Tregs占总CD4+T细胞的百分比。
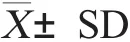
2 结果
2.1 PCV2感染小鼠模型的评价 试验组小鼠淋巴结DNA的PCR产物经琼脂糖凝胶电泳检测,结果表明试验组小鼠在感染PCV2不同时期均能在淋巴结内检出PCV2DNA,而对照组呈阴性(图1)。对PCR检测呈阳性的接种后60d的小鼠淋巴组织进行免疫组化检测,结果表明淋巴结内存在明显的PCV2阳性信号(图2)。表明试验组小鼠体内存在PCV2感染,而对照组小鼠未受PCV2感染。
2.2 PCV2感染小鼠脾细胞中Tregs的比例动态变化 试验组小鼠Tregs经流式细胞仪检测结果表明:Tregs占CD4+T细胞的比例在PCV2感染后第5d即开始明显上升,第20d达到峰值,此后逐渐下降,在10dpi、20dpi、30dpi时与对照组相比差异显著(p<0.05),其中在20dpi时与对照组相比较差异极显著(p<0.01)(图2)。但在60dpi时二组间差异不显著(图3)。整个实验期间,对照组的Tregs占CD4+T细胞的比例变化不大(p<0.05)(图4)。

3 讨 论
Tregs为一类发挥免疫负性调节功能的淋巴细胞[13],该类型细胞的主要细胞标记有CD4、CD25、CTLA-4、Foxp3等。Tregs可由胸腺产生,称为天然调节性T细胞(Nature Tregs,nTregs);也可以由外周CD4+T细胞诱导生成,称为诱导型调节性T细胞(Induced Tregs,iTregs)。Tregs对多种免疫细胞如CD4+T细胞、CD8+T细胞、B淋巴细胞、NK细胞、树突状细胞等均具有强烈的抑制作用;同时还可分泌免疫抑制功能的细胞因子如TGF-β及IL-10来发挥特异或非特异性免疫抑制作用[6]。
已发现人和小鼠的多种慢性感染的病原体可诱导机体Tregs明显增殖,抑制宿主免疫系统对病原体抗原的免疫应答,使免疫系统难以有效的清除病原体[14]。猪的繁殖与呼吸综合征病毒感染猪后也可在体内诱导明显的Tregs增殖并介导免疫抑制作用[15]。Tregs在慢性病原体感染中的重要作用已经引起了广泛的关注[16]。
已报道PCV2感染后可以抑制IFN-α和TNF-α的分泌,并抑制骨髓来源的树突状细胞成熟[17],并且可以通过诱导PBMCs产生高浓度的IL-10[18]。而高浓度的IL-10和不成熟的骨髓来源的树突状细胞来提呈抗原为诱导Tregs的生成提供了条件。因此,笔者推测PCV2感染可能诱导Tregs的生成。本研究采用昆明小鼠作为模型,对PCV2感染后小鼠脾脏内的Tregs占CD4+T细胞的比例进行了检测,结果表明在PCV2感染后第5d开始Tregs占CD4+T细胞的比例即开始上升,到20d时达到峰值,以后逐渐减少。证明PCV2可在小鼠脾脏内诱导明显的Tregs增殖。由于Tregs是一类具有强烈免疫抑制作用的细胞,可能与PCV2感染造成的机体免疫系统的抑制作用具有相关性。
本实验首次从Tregs的角度来探讨PCV2造成免疫抑制作用的可能途径,为深入研究PCV2感染的免疫反应机制及可能的免疫抑制作用提供了一个新的视角和思路。本实验虽然发现在PCV2感染过程中诱导了Tregs的增殖,但是这些增殖的细胞是否能够抑制机体免疫系统对PCV2的免疫反应也还有待进一步的研究。
[1]Tischer I,Gelderblom H,Vettermann W,et al.A very small porcine virus w ith circular single-stranded DNA[J].Nature,1982,295:64-66.
[2]Grau-Roma L,Fraile L,Segalés J.Recent advances in the epidem iology,diagnosis and control of diseases caused by porcine circovirus type 2[J].Vet J.2010[Epub ahead of print].
[3]张建武,庄金山,刘长龙,等.2007年中国部分地区猪圆环病毒2型分子流行病学分析[J].中国农业科学,2009,42(8):2949-2957.
[4]Steiner E,Balmelli C,Gerber H,et al.Cellular adaptive immune response against porcine circovirus type 2in subclinically infected pigs[J].BMC Vet Res,2009,5:45.
[5]Carasova P,Celer V,Takacova K,et al.The levels of PCV2specific antibodies and viremia in pigs[J].Res Vet Sci,2007,83(2):274-278.
[6]Sakaguchi S,Yamaguchi T,Nomura T,et al.Regulatory T Cells and Immune Tolerance[J].Cell,2008,133(5):775-787.
[7]Li Shuo,Gowans E J,Chougnet C,et al.Natural regulatory T cells and persistent viral infection[J].J Virol,2008,82(1):21-30.
[8]秦宏阳,罗玉均,张得玉,等.猪圆环病毒2型感染对小鼠组织中Caspase3、Bak及Bcl-2基因表达的影响[J].中国预防兽医学报,2009,31(5):342-345.
[9]苗岚飞,崔尚金,张超范,等.猪圆环病毒2型感染昆明小鼠模型的建立[J].中国兽医科学,2008,38(6):475-478.
[10]Quintana J,Balasch M,Segalés J,et al.Experimental inoculation of porcine circoviruses type 1(PCV1)and type 2(PCV2)in rabbits and mice[J].Vet Res.,33(3):229-237.
[11]Cságola A,Cadar D,Tuboly T,et al.Replication and transm ission of porcine circovirus type 2in mice[J].Acta Vet Hungarica,2008,56(3):421-427.
[12]唐宁,吕艳丽,郭鑫,等.免疫组化法检测猪圆环病毒2型在人工感染猪体内的分布[J].畜牧兽医学报,2008,39(3):372-375.
[13]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2receptor alpha-chains(CD25).Breakdown of a singlemechanism of self-tolerance causes various autoimmune diseases[J].J Immun,1995,155(3):1151-1164.
[14]Keynan Y,Card C M,M cLaren P J,et al.The role of regulatory T cells in chronic and acute viral infections[J].Clin Infect Dis,2008,46(7):1046-1052.
[15]Wongyanin P,Buranapraditkun S,Chokeshai-Usaha K,et al.Induction of inducible CD4+CD25+Foxp3+regulatory T lymphocytes by porcine reproductive and respiratory syndrome virus(PRRSV)[J].Vet Immunol Immunopathol,2010,133(2-4):170-182.
[16]Yasm ine B.Regulatory T cells and infection:a dangerous necessity[J].Nature Rev Immunol,2007,7:875-888.
[17]Vincent IE,Balmelli C,Meehan B,et al.Silencing of natural interferon producing cell activation by porcine circovirus type 2DNA[J].Immunol,2007,120(1):47-56.
[18]Darwich L,Segalés J,Resendes A,et al.Transient correlation between virem ia levels and IL-10expression in pigs subclinically infected with porcine circovirus type 2(PCV2)[J].Res Vet Sci,2008,84(2):194-198.

