斯氏艾美耳球虫感染对兔肝脏和血清抗氧化功能的影响
李文超,顾有方,陈会良,韩素云,彭保亮
(安徽科技学院动物科学学院,安徽凤阳233100)
兔球虫病是危害养兔业的重大疾病之一,目前主要以药物防治为主。由于耐药虫株的不断出现和新药研制费用昂贵等原因[1],使得兔球虫病的防治效果不佳,因此研究球虫的致病机理具有十分重要的理论和现实意义。
近年来逐渐形成了由自由基化学与生物医学交叉的自由基医学[2],少量的自由基对机体是有益的,但是过量的自由基可对机体造成损伤,这也是是构成诸多疾病的病理学基础。球虫感染可以引起兔机体发生一系列生理生化反应,超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)均属于机体的抗氧化系统,它们活性的变化反映出机体抗氧化功能的强弱[3]。为此,我们研究兔感染斯氏艾美耳球虫(Eime-ria stiedai)过程中肝脏和血清内自由基的动态变化,揭示球虫感染的病理生理学机制,为该病的防制提供依据。
1 材料和方法
1.1 虫株 斯氏艾美耳球虫由本实验室保存。
1.2 主要试剂和实验动物 试验所用试剂盒均购自南京建成生物工程研究所;140只30日龄~45日龄兔购自凤阳某兔场。
1.3 接种 兔进行隔笼饲养,饮水中加入地克珠利抗球虫药,每天以饱和盐水漂浮法检查球虫卵囊,直至观察不到卵囊为止,在感染前停药7d。随机等分为试验组和对照组。试验组每只兔经口接种2.5×104个孢子化卵囊,对照组每只兔接种等量蒸馏水。
1.4 样品的采集与处理 分别于感染当天及感染后7d、14d、21d、28d、35d和42d的各组中随机抽取10只兔迫杀,采血并分离血清,-20℃保存备用;取肝脏样品进行匀浆处理,2500r/min10min取上清,-20℃保存备用。
1.5 测定项目与方法 组织中蛋白的测定采用双缩脲法;总SOD活性的测定采用黄嘌呤氧化酶法;MDA含量的测定采用硫代巴比妥酸比色法;CAT活性的测定采用可见光法;GSH-Px活性的测定采用DTNB法。
1.6 数据处理 试验数据以平均值±标准误(X±SD)表示,用SPSS软件对数据进行描述性统计,并对组间均值进行多重比较(p<0.05)。
2 结 果
2.1 斯氏艾美耳球虫感染对兔肝脏自由基的影响试验组肝脏样品中SOD活性在感染后第7d明显下降并达到最低值,第14d开始呈上升趋势,第35d基本上升为对照组水平,第7d和14d的数据与对照组相比,差异极显著(p<0.01);试验组肝脏中GSH-Px活性在感染的初期低于对照组水平,并于感染后第7d和14d呈上升趋势,但与对照组数据相比较差异不显著(p>0.05)。试验组肝脏样品中CAT活性在感染后第7d略有降低,并持续至35d恢复为对照组水平,但与对照组相比差异不显著(p>0.05)。试验组肝脏样品中MDA活性在感染第7d出现峰值,随后骤降,第14d开始高于对照组水平,其中,仅感染后第7d试验组MDA活性与对照组相比,差异显著(p<0.05)(表1)。
2.2 斯氏艾美耳球虫感染对兔血清自由基的影响试验组血清SOD活性于感染后第7d开始明显下降,最低值出现在7d~14d,然后呈上升趋势,至试验结束基本与对照组水平相同;感染后第7d和14d的SOD活性与对照组相比,差异极显著(p<0.01)。试验组血清GSH-Px活性于感染后仅第14d略有下降,与对照组相比,差异不显著(p>0.05)。试验组血清CAT活性从感染初期至试验结束均低于对照组,各阶段CAT活性与对照组相比,差异均不显著(p>0.05);试验组血清MDA含量于感染后迅速增加,第7d达到峰值,随后缓慢下降,第35d降至对照组水平,感染后第7d的MDA含量与对照组相比,差异极显著(p<0.01),感染后第14d MDA含量与对照组相比,差异显著(p<0.05)(表2)。
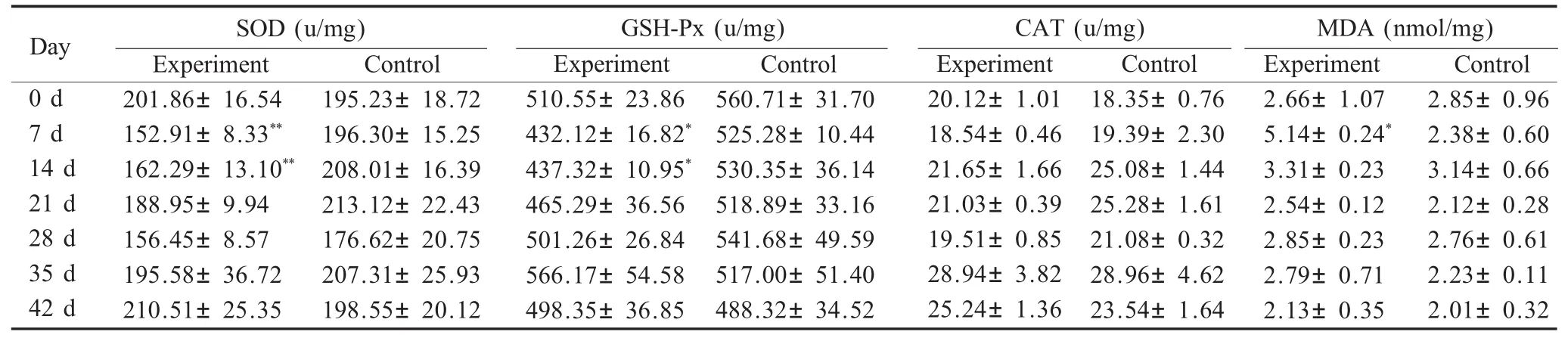
表1 斯氏艾美耳球虫感染对兔肝脏自由基的影响Table 1Effects of free radical in the liver of rabbit infected w ith E.stiedai

表2 斯氏艾美耳球虫感染对兔血清自由基的影响Table 2Effects of free radical in serum of rabbit infected with E.Stiedai
3 讨 论
在正常情况下,体内自由基的产生、利用和清除保持着动态平衡,自由基的清除主要依赖于体内各类抗氧化酶,包括SOD、CAT和GSH-Px等。SOD活性的高低间接反映了机体清除氧自由基的能力;MDA可以反映该体系中脂质过氧化自由基的存在及反应的程度[4];CAT广泛存在于哺乳动物体内,尤以肝脏和红细胞内的含量最多,其主要作用是将H2O2分解为水和氧气,从而达到清除体内产生的过氧化物;GSH-Px主要催化脂质过氧化物转化为无害物[5]。
斯氏艾美耳球虫是兔球虫中唯一寄生在肝脏的球虫。Barriga等认为,兔感染斯氏艾美耳球虫后,存在肝细胞短期损伤期,由于肝细胞损伤和坏死对肝功能的影响,使得机体抗氧化功能的下降[6]。该试验中,感染斯氏艾美耳球虫后,兔肝组织和血清中的SOD、CAT、GSH-Px活性和MDA含量均发生不同程度的变化。SOD、CAT和GSH-Px活性均有不同程度的下降,其中SOD活性下降最明显,MDA含量高于对照组水平,各指标在感染急性期(感染后7d~21d)后逐步回升或接近对照组水平,该结果与王丙云和赵海全等研究鸭肝炎病毒对鸭抗氧化功能的影响的结果一致[7-8]。上述结果表明在球虫感染过程中可导致兔抗氧化体系的短时破坏,细胞内脂质过氧化反应增强和抗氧化能力下降,以致氧自由基反应性增强,从而加剧细胞损伤,但球虫感染属于自限性感染,到感染后期,兔的肝脏损伤逐渐恢复正常,体内OFR产生和清除逐渐趋向平衡,因此很快恢复至正常的抗氧化平衡状态[9]。
[1]蒋建林,蒋金书.鸡球虫基因及基因工程疫苗的研究进展[J].中国兽医科技,1999,29(6):21-25.
[2]顾有方,陈会良,刘德义,等.自由基的生理和病理作用[J].动物医学进展,2005,26(1):94-97.
[3]金光明,张岱芊,顾有方,等.柔嫩艾美耳球虫感染后组织抗氧化功能的动态变化[J].中国兽医学报,2005,22(3):233-235.
[4]Jibert A R,Botten J A,M iller D S,et al.Characterization of age and dose related outcomes of duck hepatitis B virus infection[J].Virology,1998,244(2):273-282.
[5]陈越,金久善.自由基的生物学效应[J].中国兽医杂志,1996,22(2):48-51.
[6]Barriga O O,Aznoni J V.Pathophysiology of hepatic cocciosis in rabbits[J].Vet Parasitol,1981,8:20l-2l0.
[7]王丙云,计慧琴,赵海全,等.自由基在鸭病毒性肝炎发病过程中的作用[J].中国兽医学报,2003,23(5):271-273.
[8]赵海全,王丙云,冯军,等.DHV对雏鸭肝组织中SOD活性和MDA含量的影响[J].2002,(7):43-45.
[9]聂奎,汤明,鲁智,等.柔嫩艾美耳球虫感染雏鸡LPO含量和抗自由基酶活性的动力学[J].中国兽医学报,2003,23(5):469-471.

