CO2/空气比值对牟氏角毛藻生长和总脂含量的影响
王 蒙 ,李纯厚 ,戴 明 ,韦芳三 ,周岩岩 ,杨慧英,胡维安,杨 进
(1.中国水产科学研究院南海水产研究所,农业部海水养殖生态与质量控制重点开放实验室,广东 广州 510300;2.上海海洋大学,上海 201306)
牟氏角毛藻(Chaetoceros miielleri)隶属硅藻门(Bacillariohyta)盒形藻目(Biddulphiales)[3],其体积小、细胞壁薄、耐高温、繁殖速度快、抗污染能力强,多数单个生活,有时2~3个组成群体。其所含营养丰富,适于虾类、蟹类以及泥蚶、牡蛎等贝类幼体摄食和消化[4],且在温度为10~39℃环境下均能生长繁殖,是海产经济动物的良好饵料生物。与其他单胞藻相比,牟氏角毛藻藻体内含有大量的脂肪酸、蛋白质等营养物质,近年来引起人们的广泛研究[5-9]。
蒋霞敏[10]研究指出,外界培养条件的变化(如养分、光照、温度、盐度等)均会影响微藻细胞的生长及其脂肪酸的含量与组成。丰富的碳源有利于积累更多的油脂[11],C/N比对微藻油脂合成也有显著影响[12]。CO2的来源广泛,利用CO2促进微藻细胞的生长,具有良好的经济效益。光合作用以CO2作为基质消耗,引起pH变化,采用添加大量的NaHCO3会导致海水中多种重要离子的沉淀[8,13-14]并使生产成本提高。5%浓度的CO2对微藻的光合作用特征及固碳机制的影响,已有广泛的研究[8,15-16]。CO2及CO2通入方式对微藻生长速度及细胞密度的影响近年来也有报道,但通入的CO2与空气的比例对微藻相对生长率和总脂含量百分比的研究却很少。本文旨在探索牟氏角毛藻作为生物燃料的原材料的可行性,通过控制培养过程中通入的CO2/空气比值的大小,刺激藻体内乙酰-COA(Acetyl-COA)和NADPH的生产,使其积累更多的油脂,以提高牟氏角毛藻的总脂含量。
1 材料和方法
1.1 试验材料
试验于2009年9~11月在南海水产研究所深圳实验基地进行,牟氏角毛藻藻种由中国水产科学院南海水产研究所水产种质资源与养殖技术重点开放实验室提供。试验用药品全部为分析纯。
1.2 试验方法
1.2.1 培养用水、培养液配方和培养容器 培养用海水全部取自深圳市杨梅坑海域,盐度约为30.6,加入消毒淡水将盐度调至20。依次经遮光沉淀,过滤棉、脱脂棉、300目筛网过滤,煮沸消毒。以消毒海水为基础,加入一定的营养盐配成培养液,基础培养液成分[17]见表1。在本试验中将培养液中NaHCO3的浓度调为5.75 g/L,培养容器为Corning 1 L扁形玻璃培养瓶,培养液体积为800 mL。试验前用1%稀盐酸溶液浸泡、洗涤、120℃高温消毒1 h,冷却备用。

表1 基础培养基配方 (g/L)
1.2.2 培养方法与日常管理 试验设置5个梯度的CO2/空气比值,分别为A处理,1/5;B处理,1/10;C 处理,1/15;D 处理,1/20;E 处理,1/25;以不通气体作为空白对照组。试验时采用单种培养,试验藻在85-2恒温磁力加热搅拌器上培养,搅拌速度约200 r/min;温度设定为26℃;采用6只40 W灯管并排放置的方法全天24 h光照,光照强度约为4 000 lx(上海市嘉定学联JD-3照度计);培养液盐度为20,pH控制为7.8~8.5。用直径5 mm的玻璃管匀速通入CO2与空气的混合气体,每个梯度设置3个平行。每24 h从培养瓶中取出约2/3倒入5 L塑料桶中继续培养备用,然后再加入新的培养液,即半连续培养。
1.3 计数
每日上午8点到10点扩藻,扩藻前后分别取样一次,采用KB-K-25血球计数板计数,每个样计数2~3次,取平均值并分别计算牟氏角毛藻每个梯度、每个平行培养瓶扩前扩后的细胞密度,计算相对生长率。
1.4 采收与提取
待塑料桶中的牟氏角毛藻生长至指数生长期末期[18](此时脂肪酸积累程度最高),用离心机(上海安亭LXJ-IIB)4 500 r/min离心15 min浓缩藻液,弃去上清液后的藻泥用消毒淡水清洗2~3次,并将藻泥置于鼓风干燥箱中45℃干燥至恒重备用。参照文献[19],将干燥后的藻泥称重并用脱脂棉包好装入卷好的滤纸筒,再将滤纸筒放入提取筒中,连接好接收瓶和冷凝管,并用铁架台固定。加入无水乙醚至接收瓶容积的2/3,60℃水浴加热,索氏提取法提取体内的粗脂肪。提取后的滤纸筒烘干至恒重,准确称量提取前后干滤纸筒的重量,两者之差即为粗脂肪的重量,进而计算出该梯度条件下粗脂肪的含量。只需更换滤纸包即可进行下一次测定,可连续操作,方法简单经济,能得到较好的平行结果。
一般来说,对同一量子态进行测量时,正定算子值测量之矩阵的阶仅是投影测量之矩阵的阶的一半[7-8,43]。这表明:就同一量子任务而言,采用正定算子值测量的协议比采用投影测量的协议更简单且易于实验实现。本节,我们通过用正定算子值测量代替上节中的投影测量U1,达到改进上述方案的目的。
1.5 计算方法
1.5.1 相对生长率 计算公式为:
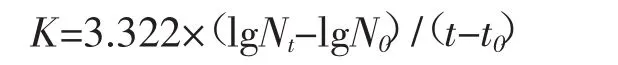
其中Κ代表生长率,Nt为试验进行到t天扩藻前的细胞密度,N0为t0天时扩藻后的细胞密度,t0<t。
1.5.2 总脂含量百分比 计算公式为:
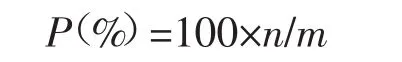
其中P代表总脂含量百分比,n代表粗脂肪总重,m代表样品藻的干重。
1.5.3 总脂日增量 假设样品藻初始干重为a g,P代表总脂含量百分比,且在相同生长条件下P不变,则生长一天后,藻液中的藻干重为2Ka g,藻中粗脂肪的总重量为2Ka·Pg,所以总脂日增量的计算公式为:
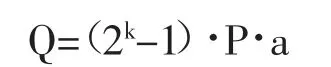
1.6 保种
本文采用的是固定化[20]保存方法,方法如下:称取2.5 g海藻酸钠,溶入100 mL蒸馏水中,并加入2 g氯化钠,搅动加热至成为均匀的粘稠状胶体停止加热,此即为固定化所需的海藻酸钠凝胶溶液。将浓缩后的藻细胞悬浮液与海藻酸钠凝胶溶液按1∶4的比例充分混匀,制成胶-藻混悬液;取20 mL注射器、9号针头吸取混悬液,匀速挤入2%氯化钙溶液中,玻璃棒迅速搅拌均匀。用消毒海水冲洗2次,以除去残余的氯化钙溶液,不添加培养液,置于冰箱中4℃冷藏。
1.7 脂肪酸的成分分析
利用GC/MS面积归一化法(JY/T 003-1996)对藻类提取出的脂肪酸进行成分分析。
2 结果与分析
2.1 CO2/空气比值对牟氏角毛藻生长的影响
采用上述试验方法培养牟氏角毛藻,根据每天的细胞计数,计算每个梯度下藻的初始密度、终密度、相对生长率。该藻在本试验方法培养过程中,始终处于指数生长期,经观察,指数生长期可维持15~20 d。
图1显示不同的CO2/空气条件下牟氏角毛藻培养24 h前后细胞密度的变化情况。从图可知,牟氏角毛藻的最高终密度为15.35×106cell/mL,最低为10.67×106cell/mL;当CO2/空气=1/15时藻的密度变化比较明显,说明CO2/空气比值为1/15的条件适合牟氏角毛藻的生长。
图2显示在不同的CO2/空气条件下,牟氏角毛藻相对生长率的大小。图中显示CO2/空气=1/15时,该藻的相对生长率平均值最高,达1.76 d-1;其中CO2/空气=1/25时,相对生长率平均值相对于其他梯度较低,而对照组则最低。方差分析显示,CO2/空气比值对牟氏角毛藻相对生长率影响极显著(F=15.441,p<0.01),其中对照组与5个CO2/空气梯度
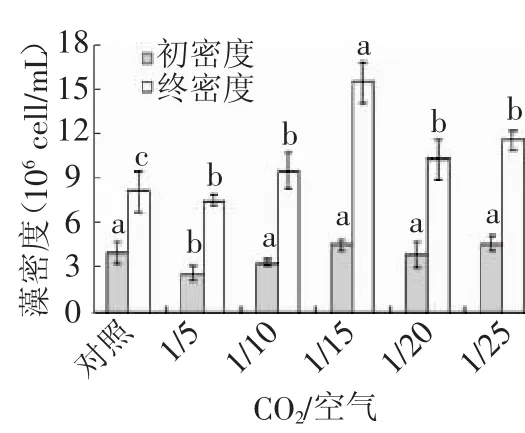
图1 CO2/空气比值对藻密度的影响

图2 CO2/空气比值对藻相对生长率的影响
(同一指标的不同小写字母标注表示差异达显著水平,下同。)之间差异极显著(p<0.01),E与B、E与 C、C与D之间差异也是极显著(p<0.01),A与E、B与D之间差异显著(0.01
2.2 CO2/空气比值对牟氏角毛藻总脂含量百分比的影响
从图3中可知,CO2/空气=1/15时牟氏角毛藻的总脂含量百分比最高。方差分析显示,CO2/空气比对牟氏角毛藻总脂含量影响极显著(F=76.524,p<0.01),其中对照组与5个梯度之间差异均极显著(p<0.01),A与C、A与E、B与C之间差异也极显著(p<0.01),A与D、C与D之间差异显著(0.01
2.3 CO2/空气比值对牟氏角毛藻总脂日增量的影响
根据公式分别计算5个CO2/空气比值培养条件下总脂日增量的大小,结果见图4。CO2/空气比值对牟氏角毛藻总脂日增量影响极显著(F=38.431,p<0.01),其中对照组与5个梯度之间差异均极显著(p<0.01),A与C、B与E、C与D、C 与 E 之间差异也极显著(p<0.01),A与E、B与C、B与D之间差异显著(0.01
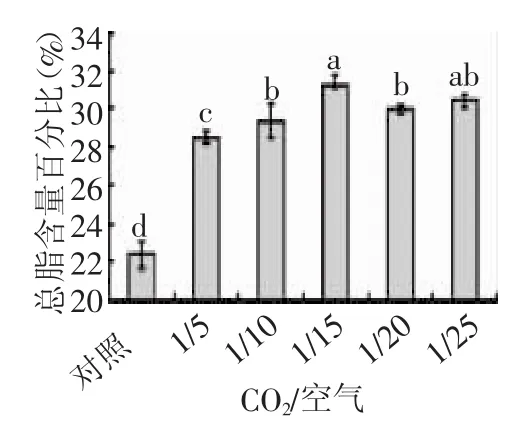
图3 CO2/空气比值对总脂含量百分比的影响
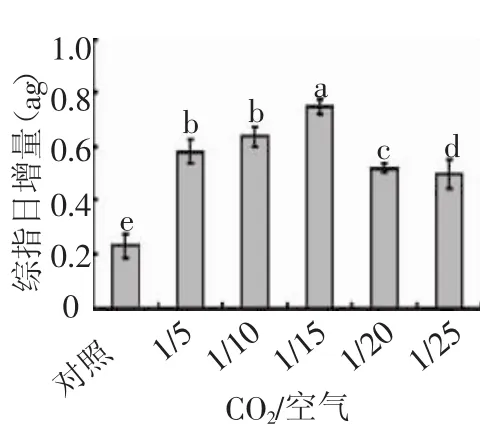
图4 CO2/空气比值对总脂日增量的影响
牟氏角毛藻在5个CO2/空气梯度条件下,总脂日增量的变化与相对生长率的变化趋势相似,这说明相对生长率的大小与总脂日增量的关系密切,在藻种的总脂含量百分比相差不悬殊的情况下,相对生长率越大,总脂日增量也越大。
2.4 CO2/空气比值对牟氏角毛藻脂肪酸组成的影响
每个梯度取一个样本,用1.7中方法测定脂肪酸的组成,不同CO2/空气比值下,牟氏角毛藻脂肪酸含量见表2。
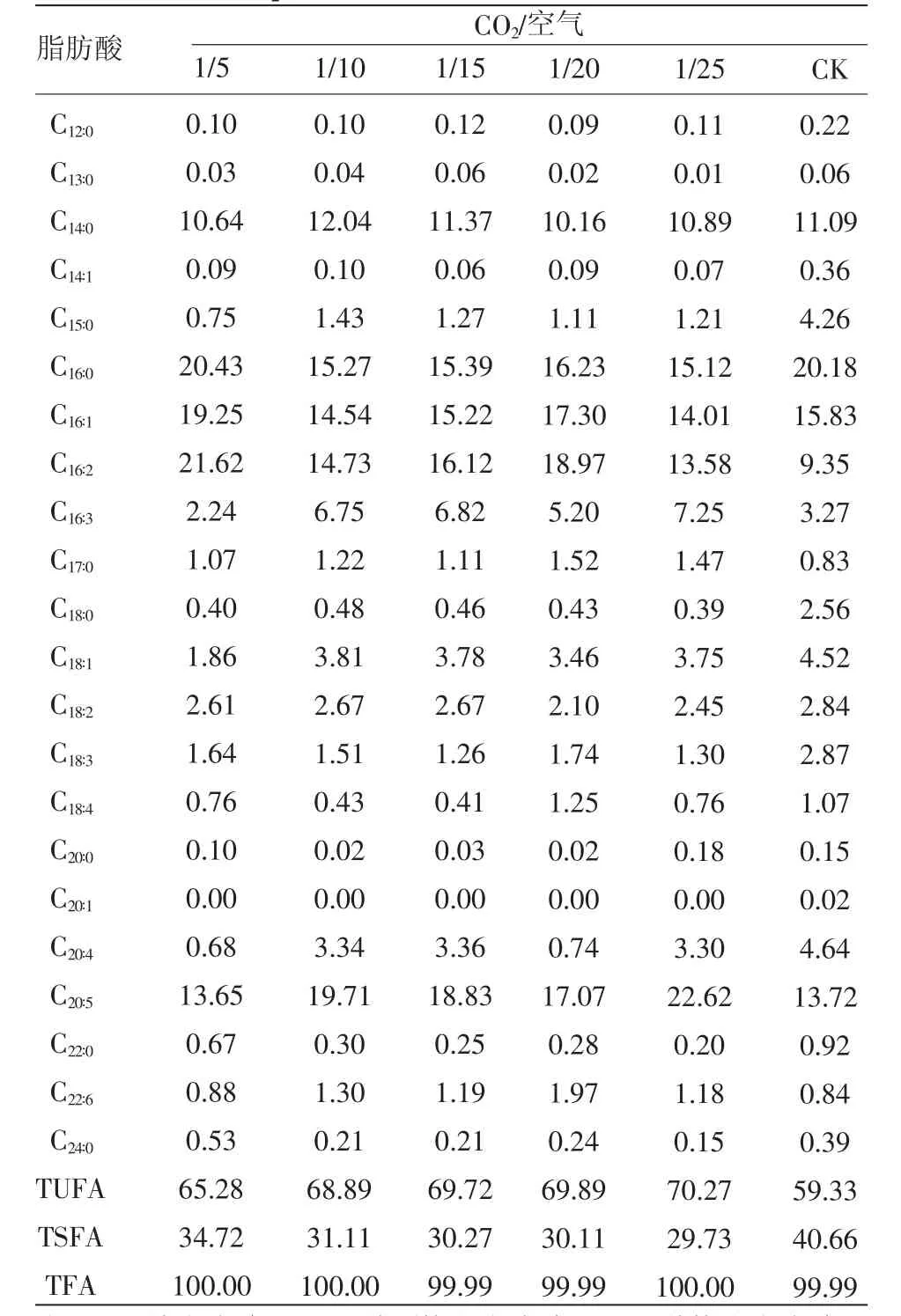
表2 不同的CO2/空气比值下牟氏角毛藻的脂肪酸组成(%)
从表2中可知,经不同CO2/空气比值的混合气体培养,总不饱和脂肪酸的量范围在65.28%~70.27%之间,平均为68.81%,比不通空气的对照组提高了9.48个百分点。牟氏角毛藻的总不饱和脂肪酸的含量随CO2/空气比值的减小而增加,总饱和脂肪酸的量则呈降低趋势。
3 结论
据袁有宪[21]、王侃等[22]报道,利用普通的摇瓶方法培养牟氏角毛藻,最高密度为4.8×106cell/mL;邹宁等[23]指出,在生物反应器中牟氏角毛藻的密度最高为10×106cell/mL。本研究表明,牟氏角毛藻终密度最高达到15.35×106cell/mL),是袁有宪、王侃等人培养密度的3.20倍,是邹宁在生物反应器中培养的1.54倍;终密度最低为10.67×106cell/mL,是前人研究的1.05~2.19倍。而在如此高的密度下,牟氏角毛藻完全可以抑制弧菌等细菌的生长[24]。从现有的报道来看,培养牟氏角毛藻时相对生长率都小于1.2 d-1;胡晗华、高坤山[8]报道了在CO2浓度倍增情况下,牟氏角毛藻的最大生长率为0.47 d-1,本研究中相对生长率在1.39~1.76 d-1范围内,对照组中相对生长率为1.04 d-1,可见通入不同CO2/空气比值的混合气体能使牟氏角毛藻生长速度加快。
蒋霞敏等[25]报道了牟氏角毛藻的总脂含量百分比为15.07%,而经过本方法培养,测得该藻的总脂含量百分比有了极大的提高,在CO2/空气=1/15时最高,达到31.25%,将牟氏角毛藻的粗脂肪含量提高了16.18个百分点;在CO2/空气=1/5时最低为28.52%,仍比报道的高13.45个百分点。结果显示,CO2/空气比值在1/5~1/25之间时,牟氏角毛藻的总脂含量百分比先随比值的减小而升高,1/15之后又有所下降,但趋于平缓,说明牟氏角毛藻在CO2/空气=1/15时,牟氏角毛藻体内的乙酰辅酶A羧化酶(ACC)和NADPH的生成影响显著,有机体积累油脂的能力最强。可见,通入CO2/空气比值为1/15的混合气体适合牟氏角毛藻的生长与粗脂肪积累,这也为培养其他种类产能微藻提供一个借鉴方法。
研究表明,CO2/空气=1/15时,总脂日增量最高,达样品藻初始干重的0.75倍。根据总脂日增量与相对生长率、总脂含量百分比的函数,笔者认为总脂日增量与相对生长率和总脂含量百分比均有联系,与相对生长率的关系最为密切。因此,牟氏角毛藻产油量最高的最适CO2/空气比值为1/15。但在实际培养过程中,要根据藻不同的生活习性通入不同的CO2/空气的混合气体,使相对生长率与总脂含量百分比达到完美的结合,从而达到高产油量的目的。
李荷芳[26]研究认为,硅藻的主要脂肪酸为、和,占总脂肪酸含量的 74.6%~83.1%。硅藻纲脂肪酸组成的特点是的含量高于,并有高水平的另一个特点是含有较高含量的根据本研究结果,牟氏角毛藻的主要脂肪酸为和有高水平的含有较高含量的,这与李荷芳的研究结果相似。的含量基本上低于,与李荷芳的研究结果不一致。王海英[27]研究指出,牟氏角毛藻体内总饱和脂肪酸占40.5%,总不饱和脂肪酸的含量为54%。本研究发现,牟氏角毛藻体内总饱和脂肪酸的含量为29.73%~34.72%,低于王海英的研究结论。这些结果的产生与本研究的培养方法以及提取方法有一定的关系,还需做进一步研究。
[1]梅 洪,张成武,殷大聪,等.利用微藻生产可再生能源研究概况[J].武汉植物学研究.2008,26(6):650-660.
[2]王兆凯.基于海洋硅藻的生物燃油生产 [J].渔业现代化,2008,35(2):60-63,59.
[3]冯 坚,郑忠明,金春华.牟氏角毛藻的生产性培养技术[J].水产科学,2002,21(6):20-21.
[4]金彬明,曾国权.牟氏角毛藻培养技术 [J].中国水产,2004,(10):73-74.
[5]李文权,张元标,陈清花,等.超声辐射对牟氏角毛藻的生物效应研究[J].海洋科学,2001,25(10):39-42.
[6]Sirler de CA,Virginia M T G.Growth and biochemical composition of the diatom Chaetoceros cf.wighamii brightwell under different temperature,salinity and carbon dioxide levels.I.Protein,carbohydrates and lipids[J].Aquaculture,2005,246(1-4):405-412.
[7]McGinnis K M,Dempster T A,Sommerfeld M R.Characterization of the growth and lipid content of the diatom Chaetoceros muelleri[J].Journal of Applied Phycology,1997,9(1):19-24.
[8]胡晗华,高坤山.CO2浓度倍增对牟氏角毛藻生长和光合作用的影响[J].水生生物学报,2001,25(6):636-639.
[9]Jose A L E,Voltolina D,Enriquez-Ocana F,et al.Indoor and outdoors mass production of the diatom Chaetoceros muelleri in a Mexican commercial hatchery[J].Aquacultural Engineering,2005,33(3):181-191.
[10]蒋霞敏.温度、光照、氮含量对微结球藻生长及脂肪酸组成的影响[J].海洋科学,2002,26(8):9-13.
[11]Roessler P G.Environmental control of glycerol lipid metabolism in microalgae:commercial implications and future research directions[J].Journal of Phycoogy,1990,26:393-399.
[12]Regnault A,Chervin D,Chammai A,et a1.Lipid composition of Euglena gracilis inrelation to carbon-nitrogen balance[J].Phytochemistry,1995,40(3):725-733.
[13]林惠民.盐泽螺旋藻与其他螺旋藻的比较研究[J].水生生物学报,1991,15(1):27-34.
[14]邹 宁.藻类光生物反应器的开发及应用[D].烟台:鲁东大学生命科学学院,1996.
[15]胡晗华,戴玲芬,戴和平,等.一种海生黄藻的氨基酸和脂肪酸组成[J].应用与环境生物学报,1999,(5):487-490.
[16]李夜光,胡鸿钧.螺旋藻培养液吸收CO2特性的研究[J].武汉植物学研究,1996,14(3):253-260.
[17]田治立,王长海,于 贞,等.纤细角毛藻培养条件优化[J].海洋科学,2005,29(2):5-7,36.
[18]王 蒙,李纯厚,戴 明.以海洋微藻为原料提取生物燃料的研究进展与发展趋势[J].南方水产,2009,5(2):74-80.
[19]姚 虹.索式提取法测定脂肪含量方法改进 [J].中山大学学报,1996,(4):64-65.
[20]胡蓓娟,王雪青,吴晶晶,等.8种微藻的保存方法研究[J].海洋湖沼通报,2008,(1):58-65.
[21]袁有宪,曲克明,辛福言.海水单胞藻培养液中微量元素的最佳浓度[J].中国水产科学,1998,5(2):45-51.
[22]王 侃.塑料白桶单胞藻生产性培养的初步试验[J].浙江海洋学院学报(自然科学版),2000,19(2):189-191.
[23]邹 宁,孙东红,韩亚香.CO2对牟氏角毛藻高密度培养的影响[J].生物工程学报,2005,21(5):844-847.
[24]姚雪梅,王 珺,王 思,等.人工培养牟氏角毛藻对弧菌抑制效果研究[J].南方水产,2005,8(4):41-46.
[25]蒋霞敏,郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报,2003,27(3):243-247.
[26]李荷芳,周汉秋.海洋微藻脂肪酸组成的比较研究[J].海洋与湖沼,1999,30(1):34-40.
[27]王海英,曾晓波.三种硅藻产多不饱和脂肪酸分析[J].中国油脂,2007,32(7):76-78.

