胰腺导管内乳头状黏液性肿瘤良恶性的术前鉴别
匡天涛 王单松 楼文辉 靳大勇
(复旦大学附属中山医院普外科,上海 200032)
胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasms,IPMN)起源于胰腺导管上皮,其病理类型涵盖自良性(腺瘤和交界性肿瘤)至恶性(原位癌和浸润癌)连续变化过程。本文回顾总结我院手术切除并经病理证实的70例IPMN病例的临床资料,比较良恶性肿瘤病例的不同临床特征,为治疗方式的选择提供帮助。
1 资料及方法
1.1 一般资料 1999年1月—2008年12月复旦大学附属中山医院共收治经手术及病理学证实的胰腺导管内乳头状黏液性肿瘤70例,其中男性46例,女性24例;平均年龄(61.4±9.4)岁;肿瘤位于胰头57例,胰体尾10例,全胰3例;病理类型︰良性肿瘤21例(腺瘤15例,交界性肿瘤6例),恶性肿瘤49例(原位癌8例,浸润癌41例)。
1.2 方法 从以下各方面对良恶性肿瘤的特征进行比较:一般人口学数据、临床表现、实验室检查结果、影像学检查结果等。
1.3 统计学分析 应用SPSS 15.0统计软件分析;率的比较采用卡方检验或Fisher′s精确概率法,均数比较采用t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 人口学数据 两组病例性别分布及发病年龄差异有统计学意义:恶性组病例平均发病年龄为(64.32±8.95)岁,而良性组为(57.28±8.51)岁;男性病例中恶性比率为60.86%(28/46),女性病例中为87.5%(21/24);肿瘤部位分布、去除3例全胰肿瘤,肿瘤位于胰头者恶性比率为68.42%(39/57),位于胰体尾者为70%(7/10);两组病例在性别组成及肿瘤部位分布方面无显著差异(表1)。
2.2 临床表现 腹痛最为常见(n=40),其次为体质量显著下降(n=24)及皮肤、巩膜黄染(n=23),而发热、脂肪泻及胆管炎等少见。两组病例黄疸、体质量下降及无症状发生率有显著差异,而腹痛及急性胰腺炎发生率无显著差异(表1)。
2.3 实验室检查 恶性组血癌抗原19-9(CA19-9)升高发生率高于良性组,两组差异有统计学意义,其中CA19-9值在良性组只有4例升高,且均小于100 U◦mL-1,而恶性组23例升高,其中20例值大于150 U◦mL-1;糖尿病发病率恶性组也显著高于良性组;血癌胚抗原(CEA)升高发生率2组无显著差异(表1)。
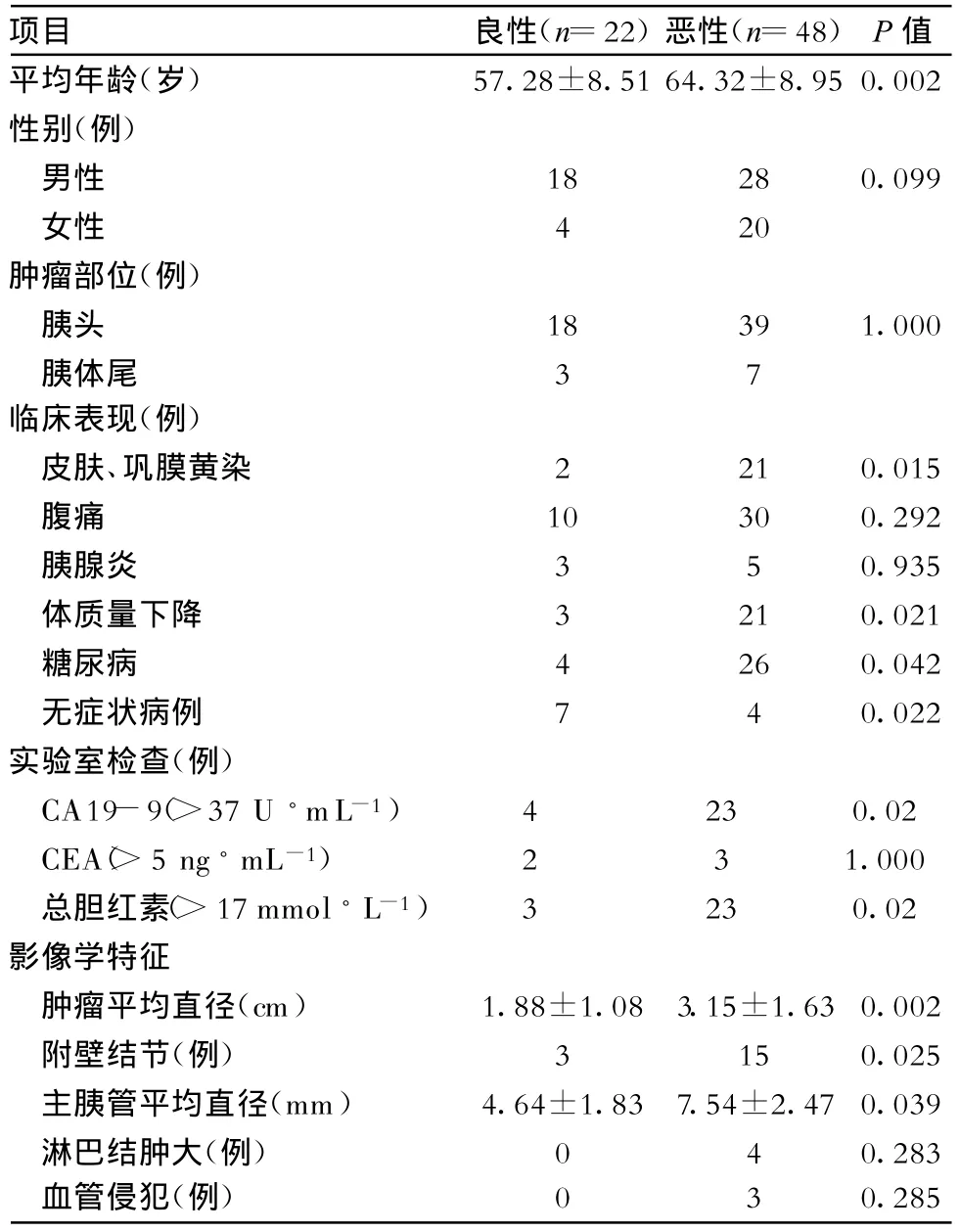
表1 良恶性IPMN患者临床特征比较
2.4 影像学检查结果 病例组中,共有51例患者行增强CT或磁共振胆胰管成像(MRCP)检查,其中良性组19例,恶性组32例。CT上IPMN主要表现为胰腺低密度或囊性占位(n=51),强化不明显或轻度强化,肿瘤平均直径2.77±1.59 cm(1~8 cm);囊壁附壁结节(n=19);伴主胰管显著扩张;淋巴结肿大(n=4)或门静脉系统侵犯(n=3),这些病例的病理检查结果均证实有淋巴结转移或血管侵犯;其他少见征象有胰腺萎缩或钙化。两组病例在以上方面均有显著差异。
3 讨 论
胰腺导管内乳头状黏液性肿瘤最早于1982年由Ohhasi等[1]报道,1996年世界卫生组织正式命名为导管内黏液性肿瘤(intraductal papillary mucinous neoplasms,IPMNs)[2]。其起源于胰腺导管上皮,主要病理特征为主胰管或(和)主要分支胰管囊样扩张,内衬富含粘液的高柱状瘤细胞,病变上皮形成乳头状或假乳头状结构。该类型肿瘤涵盖了自良性至恶性的各级别病变。
IPMN手术切除预后良好,非浸润性IPMN(包括腺瘤、交界性肿瘤及原位癌)手术切除后5年生存率达70%~100%[3-5],即便是浸润癌5年生存率也达30%~60%[3,6-7]。虽然上述结果令人满意,但手术病例及手术时机的选择对临床工作者仍是一个巨大挑战:胰腺切除手术近年虽然病死率显著下降,但并发症发生率仍较高;良性IPMN虽然有恶变趋势,但发展较为缓慢[8]。对于良性IPMN患者,特别是高龄病例,目前多主张可进行密切随访。如何通过非手术方式区分良恶性肿瘤成为是否手术的关键。虽然目前有报道[9-10]认为经胰管镜胰液细胞检测及正电子发射断层摄影(PET)等手段能有效地区分良恶性IPMN,但类似报道结论不一致,且这类检查对技术、设备要求较高,费用也较高,不易广泛开展。
Thomas等[3]报道208例手术切除IPMN,其中良性患者为126例;而在美国约翰霍普金斯医院的资料中良恶性比率为2.72∶1[11],与本组资料接近。虽然良恶性比率在不同报道中并不一致,但两组年龄上的差异在多数文献[8,11]报道中结论比较一致,恶性患者平均年龄较良性患者大6~8岁,本组病例与上述结论一致,这种趋势可能间接反映了IPMN自良性向恶性转化的病理变化过程。
在临床表现方面,本组病例中,恶性组有皮肤、巩膜黄染,体质量下降及有症状患者的比率显著高于良性组;腹痛及胰腺炎比率与良恶性无关。Yasuhiro等[12]分析64例IPMN病例后发现,良恶性病例组除在皮肤、巩膜黄染方面有显著差异外,胰腺炎及腹痛发生率无差异,与本研究结果一致。不过我们应该注意到虽然两组病例中无症状患者比率存在差异,但在恶性组仍有4例无症状患者,这种现象在其他文献[10,12]中也有报道,这提醒我们临床工作中对于“意外性”的IPMN病例不能疏忽大意,要警惕恶性可能。
本研究发现除血CEA外,血CA19-9、总胆红素和血糖在两组间均有显著差异。血CA19-9升高比率不但两组差异显著,而且在良性组中均为轻度升高,而恶性组中升高甚为明显,这说明血CA19-9是一个诊断恶性IPMN很好的指标。在Kazuyuki等[4]的报道中,良性IPMN患者血CA19-9平均水平为13 U◦mL-1,而恶性组为27 U◦mL-1,两者差异显著;而血CEA水平两者无显著差异,结果与我们的一致。有报道[13]证实在胰腺导管腺癌中,糖尿病发病率(特别是新发糖尿病)较一般人群显著升高。同样起源为胰腺导管上皮的恶性IPMN似乎也具有致糖代谢障碍的可能,Yasuhiro等[14]报道在44例恶性IPMN中,糖尿病病例达20例,虽然这种现象原因不明,但仍可以作为鉴别良恶性IPMN的有用指标。
影像学检查手段在鉴别胰腺IPMN的良恶性方面占有重要地位。目前人们主要从囊性肿块大小、附壁结节、主胰管扩张程度等方面进行分析。Sang等[15]比较了204例胰腺IPMN患者的影像学资料,恶性病例组中肿瘤直径大于3 cm或主胰管直径大于6 mm或出现附壁结节的病例所占比率显著高于良性组。在本组病例中,恶性组平均肿瘤直径为3.15 cm,平均主胰管直径为7.54 mm,近半数病例出现附壁结节;此外由于病例数较少,血管侵犯及淋巴结转移在两组间差异无统计学意义,但如出现上述征象,恶性的诊断可能性极大。
总之,良恶性胰腺导管内乳头状黏液性肿瘤患者有着不同临床特征,这种差异对于鉴别良恶性IPMN有一定的帮助;但也应注意到这些差异无绝对的判断价值,在实际临床处理中还应综合考虑多方面因素,特别是应根据患者自身情况制定合理的个性化治疗方案。
1 Ohashi T,M urakami Y,Takekoshi T.Four cases of mucinous secreting pancreatic cance[J].Prog Diagn Endosc,1982,20:348-351.
2 Longnecker DS,Adler G,Hruban RH,et al.Intraductal papillary-mucinous neoplasms of pancreas[A].In:Hamiltom SR,Aaltonen LA,eds.World Health Organization Classification of Tumors:Tumors of the Digestive System[M].Lyon,France:IA RC Press,2000:237-240.
3 T homas S,Michael GS,David M,et al.Experience with 208 resections for intraductal papillary mucinous neoplasm of the pancreas[J].A rch Surg,2008,143(7):639-646.
4 Kazuyuki NRD,Atsushi KKK.Intraductal papillary mucinous neoplasms of the pancreas:clinicopathologic characteristics and long-term follow-up after resection[J].World J Surg,2008,32:271-278.
5 Marco N,Robert G,Ralf H,et al.Outcome of invasive and noninvasive intraductal papillary-mucinous neoplasms of the pancreas(IPMN):A 10-year ex perience[J].World J Surg,2008,32:2253-2260.
6 Yoshiaki M,Kenichiro U,Takeshi S,et al.Invasive intraductal papillary-mucinous neoplasm of the pancreas:comparison with pancreatic ductal adenocarcinoma[J].Journal of Surgical Oncology,2009,100:13-18.
7 George AP,Sushanth R,John L,et al.Histopathologic basis for the favo rable survival after resection of intraductal papillary mucinous neoplasm-associated invasive adenocarcinoma of the pancreas[J].Annals of Surgery,2010,251(3):470-476
8 Claudio B,Michael GS,Keith D,et al.Natural history of intraductal papillary mucinous neoplasms(IPMN):current evidence and implications fo rmanagement[J].J Gastrointest Surg,2008,12:645-650.
9 Martha BP,Paul JM,Vikram DWR,et al.Cytological and cy st fluid analysis of small(<3 cm)branch duct intraductal papillary mucinous neoplasms adds value to patient management decisions[J].Pancreatology,2008,8:277-284.
10 Cosimo S,Sergio B,Claudio P,et al.18-Fluorodeoxyglucose positron emission tomography enhances computed tomography diag nosis of malignant intraductal papillary mucinous neoplasms of the pancreas[J].Annals of Surgery,2007,246(6):932-939.
11 Taylor AS,Charles JY,John L,et al.Intraductal papillary mucinous neoplasms of the pancreas an updated ex perience[J].Annals of Surgery,2004,239(6):788-799.
12 Chandrajit PC,Gregg AS,James L,et al.Intraductal papillary mucinous neoplasms of the pancreas:effect of invasion and pancreatic margin status on recurrence and survival[J].Annals of Surgical Oncology,2006,13(4):558-594.
13 Kuang TT,Jin DY,Wan DS,et al.Clinical epidemiological analysis of the relationship between pancreatic cancer and diabetes mellitus:data from a single institution in China[J].J Dig dis,2009,10(1):26-29.
14 Yasuhiro F,Ippei M,T akashi U,et al.Proposed new score predicting malig nancy of intraductal papillary mucinous neoplasms of the pancreas[J].Am J Surg,2007,194:304-307.
15 Sang H,Shin DJ,Han KT,et al.Validating a simple sco ring system to predict malignancy and invasiveness of intraductal papillary mucinous neoplasms of the pancreas[J].World J Surg,2010,34:776-783.

