猪IL-15与PRRS病毒GP5基因核酸疫苗免疫效力
石 娜 ,尹杰超 ,Dante Zarlenga ,李广兴,任晓峰*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.东北农业大学生命科学学院,哈尔滨 150030;3.美国农业部农业研究所中心牛功能基因组和动物寄生虫病实验室,马里兰州 20705)
PRRS病毒(PRRSV)的GP5蛋白是PRRSV的主要结构蛋白,可刺激机体产生中和抗体和细胞免疫反应[1]。GP5有6个抗原决定簇,能诱导机体产生特异性中和抗体,是理想且常用的免疫原。
白细胞介素-15(I nterleukin-15,IL-15)是Grabstein于1994年在检测猿肾上皮细胞培养上清液时首次发现的一种细胞因子[2]。IL-15的生物学作用范围广泛,如促进B细胞、T细胞、NK细胞和LAK细胞的增殖分化及细胞毒活性。近来又发现它以自分泌的方式调节单核巨噬细胞分泌细胞因子[3];还可刺激活化的B细胞分泌抗体。因此,IL-15极具开发新型免疫佐剂和免疫增强剂的潜力。本试验利用分子克隆方法分别构建了表达猪IL-15和PRRSV GP5基因的重组质粒,评价了IL-15对GP5基因免疫的增强效果,为新型疫苗的研制提供了参考数据。目前防治PRRSV的主要措施是疫苗接种,而传统疫苗的存在一定的不足。核酸疫苗的出现为克服弱毒疫苗的易返祖、潜在感染等缺陷和传染病的防治提供了新思路[4]。
1 材料与方法
1.1 材料
1.1.1 质粒,工程菌
PMD-18-T-ORF5ORF6质粒由本实验室构建;PUC-18-IL-15质粒由美国农业部Dante Zarlenga博士构建;pVAX1、感受态菌JM109、PRRSV GP5基因等均由本实验室保存。
1.1.2 工具酶和试剂
脂质体转染试剂(L ipofectamineTMReagent)购自Invitrogen公司;血清购自上海依科赛公司;T4连接酶,各种限制性内切酶均购自TaKaRa大连生物工程公司;飞捷RNA提取试剂盒、DNA回收试剂盒购自南京凯基公司;PE标记的抗鼠CD8+,FITC标记的抗鼠CD4+抗体,HRP标记的山羊抗鼠IgG均购自欧瑞德公司。
1.1.3 实验动物
6~8周龄昆明小鼠,体重为18~25 g·只-1,购自哈尔滨兽医研究所,实验鼠分组后按3只·组-1进行准备。
1.2 方法
1.2.1 PRRSV ORF5-pVAX1载体的构建及表达
1.2.1.1 PRRSV ORF5基因的PCR扩增
按文献[5]方法,以质粒PMD-18-T-ORF5ORF6基因的核苷酸序列设计了1对引物,同时考虑外源基因的表达量在基因起始密码子的前面加入Kozak序列(GCCACC),扩增ORF5基因的引物为:
上游引物P1:5′GGGGAAGCTTGCCACCATGT TGGAGAAA3′;
下游引物P2:5′CCCCGGATCCCTAAGGACGA CCCCATTG3′。
在上、下游引物中分别添加了HindⅢ酶切位点和Bam HⅠ酶切位点。
以质粒PMD-18-T-ORF5ORF6为模板,扩增ORF5基因,反应体系如下:10×PCR buffer 5μL;dNTP Mixture 4μL;模板2μL;Ex Taq 0.5μL;用ddH2O补至50μL。扩增条件:预变性:95℃5 min;变性:94℃1 min;退火:41.7℃1 min;延伸:72℃1 min共30 cycles最终延伸72℃10 min。
1.2.1.2 PRRSV ORF5-p VAX1载体的构建
按文献[6]方法,用限制性内切酶HindⅢ/Bam HⅠ消化PCR纯化产物和pVAX1,分别获得PRRSV ORF5基因片段和线性载体pVAX1,按照百泰克胶回收试剂盒说明书进行胶回收。连接、转化、挑菌、提质粒用限制性内切酶HindⅢ/Bam HⅠ鉴定。
1.2.1.3 重组质粒的纯化和转染细胞
质粒的小量制备及纯化,贮存于-20℃。用含10%小牛血清的DMEM培养基,在37℃,5%CO2的条件下培养BHK-21细胞,待细胞长至对数生长期时质粒转染细胞。采用脂质体法:将BHK-21细胞加入装有细胞爬片的24孔板培养孔内,待细胞长满70%~80%时,采用脂质体转染法将PRRSV ORF5-pVAX1真核质粒转染细胞,同时设立空载体对照组,放入37℃,5%CO2培养箱内培养。
1.2.2 猪IL-15-pVAX1载体的构建及表达
1.2.2.1 猪IL-15基因的PCR扩增
以质粒PUC-18-IL-15基因的核苷酸序列设计了1对引物,扩增猪IL-15基因的引物为:
上游引物P3:5′GGGGAAGCTTATGAGAATTT TGAAACCA 3′;
下游引物P4:5′CCCCCTCGAGTCAAGAAGTG TTGATGAA 3′。
在上、游引物中分别添加了HindⅢ酶切位点和Xh oⅠ酶切位点。
以质粒PUC-18-IL-15为模板,扩增猪IL-15基因,反应体系如下:10×PCR buffer 5μL;dNTP Mixture 4μL;模板2μL;Ex Taq 0.5μL;用ddH2O补至50μL。扩增条件:预变性:95℃5 min;变性:94℃1 min;退火:48.4℃1 min;延伸:72℃1 min共30 cycles最终延伸72℃7 min。
1.2.2.2 IL-15-pVAX1载体的构建
用限制性内切酶HindⅢ/Xh oⅠ消化PCR纯化产物和pVAX1,分别获得IL-15基因片段和线性载体pVAX1,按照百泰克胶回收试剂盒说明书进行胶回收。连接、转化、挑菌、提质粒用限制性内切酶HindⅢ/Xh oⅠ鉴定后进行测序。
1.2.2.3 重组质粒的纯化和转染细胞
方法同1.2.1.3。
1.2.2.4 RT-PCR检测猪IL-15基因的转录情况
如1.2.1.3提取细胞总RNA,经反转录后分别用引物P3和P4扩增。
1.2.3 小鼠免疫
根据文献[7],用碱裂解法大量制备质粒DNA,用适量灭菌的0.1 mol·L-1PBS将终浓度调整到1μg·μL-1。将小鼠随机分成7组(见表1),腿部肌肉先注射盐酸利多卡因50μL·只-1,15 min后再接种质粒,分别按以下分组和不同剂量免疫小鼠。每间隔两周免疫1次,分别于免疫后3 h,7、14、21、28、35及42 d,眼球取血制备血清检测抗体,并检测T淋巴细胞亚群的数量。

表1 核酸疫苗PRRSV ORF5-pVAX1和猪IL-15-pVAX1免疫小鼠分组及免疫程序Table 1 Grouping and immunization of mice inoculated with PRRSV ORF5-pVAX1 and pig IL-15-pVAX1
1.2.4 外周血淋巴细胞的分离培养
小鼠眼球采血,加3.8%柠檬酸钠抗凝剂制备抗凝血,用淋巴细胞分离液分离淋巴细胞,2 000 r·min-1离心20 min。收集淋巴细胞,用RPMI 1640培养液洗2次。细胞沉淀用1 mL RPMI 1640营养液悬浮,用台盼蓝染色法检测细胞活力>95%,调整至1×107个细胞·mL-1。
1.2.5 外周血淋巴细胞亚群数量的检测
按1.2.4制备外周血淋巴细胞悬液,每份样品各取500μL,3 000 r·min-1离心5 min沉淀淋巴细胞。用冷PBS缓冲液(pH 7.4)洗2次,每次3 000 r·min-1离心5 min。然后分别加入1:1 000稀释的CD4+-FITC标记、CD8+-PE标记抗体的预冷PBS 100 μL进行反应,4℃孵育30 min后,用冷PBS缓冲液(pH 7.4)洗2次,加入500μL缓冲液重悬,流式细胞仪检测。
1.2.6 ELISA检测抗体
①将PRRSV ORF5蛋白纯化后用0.05 mol·L-1NaHCO3稀释成50μg·μL-1,加入酶标板中,100 μg·孔-1,4℃静置包被过夜;②用PBST洗板3次,加入200μg·孔-1的封闭液,37℃作用2 h;③PBST洗板3次,加入50倍稀释的被检血清样品,100μg·孔-1,37℃作用1 h;阴性对照孔用未免疫小鼠血清;④PBST洗板3次,加入5 000倍稀释的HRP标记的山羊抗鼠IgG酶标抗体100μg·孔-1,37℃作用1 h;⑤加入新配制的显色液OPD 100 μg·孔-1,37℃闭光作用10 min,加2 mol·L-1硫酸50μL终止反应,在酶联免疫检测仪上依次读取490 nm下的OD值。
1.2.7 IFN-γ的检测摘除眼球取血,收集血清,双抗夹心ELISA法测定IFN-γ,操作按试剂盒说明书进行。
1.2.8 统计学方法
采用SPSS 11.5统计软件包进行统计分析。所有资料均用(X±S)表示,采用多样本均数比较的方差分析法。
2 结果与分析
2.1 真核重组质粒构建
利用分子克隆技术将PRRSV ORF5和猪I L-15基因分别插入到真核表达载体pVAX1的多克隆位点上,经酶切初步鉴定后进行测序。测序结果表明重组质粒中外源基因序列没有基因突变、插入及缺失,证明在克隆重组过程中,没有导致目的基因改变。
2.2 重组质粒转染BHK-21细胞后RT-PCR结果
为证实构建表达质粒的表达效果,将表达质粒转染BHK-21细胞后,用试剂盒提取RNA,并进行RT-PCR。如图1所示,转染重组质粒后,插入的目的基因均可通过RT-PCR方法检测到,表明重组质粒能够在真核细胞内进行复制,说明构建的二个重组质粒能在真核哺乳动物细胞中表达,为开展体内试验研究提供依据。

图1 PRRSV ORF5-pVAX1和猪IL-15-pVAX1重组质粒转染后RT-PCR结果Fig.1 RT-PCR product of the recombinate plasmids PRRSV ORF5-pVAX1 and pig IL-15-pVAX1 transfected to BHK-21 cell
2.3 核酸疫苗PRRSV ORF5-pVAX1和猪IL-15-pVAX1免疫对外周血CD4+细胞数量的影响
核酸疫苗PRRSV ORF5-pVAX1和猪IL-15-pVAX1通过肌肉注射免疫小鼠后,用流式细胞仪对小鼠外周血CD4+细胞含量进行检测,结果表明,实验组CD4+细胞数量明显高于PBS对照组和pVAX1对照组,差异极显著(P<0.01),表明加佐剂与不加佐剂肌肉注射免疫都诱导CD4+细胞免疫应答,而且加佐剂组明显高于不加佐剂组,但差异不显著(P>0.05)。见图2。该结果提示PRRSV ORF5有可能能通过细胞免疫途径增强机体的免疫能力,同时分子佐剂猪IL-15能有效增强该基因疫苗的免疫效果。
2.4 核酸疫苗PRRSV ORF5-p VAX1和猪IL-15-pVAX1免疫后对小鼠外周血CD8+细胞数量的影响
核酸疫苗PRRSV ORF5-pVAX1和猪IL-15-pVAX1免疫后,用流式细胞仪检测小鼠外周血CD细胞数量。结果表明,加佐剂组外周血CD细胞数量明显高于PBS对照组和pVAX1对照组,差异极显著(P<0.01),佐剂组明显高于不加佐剂组,差异极显著(P<0.01)。如图3。该结果提示本试验构建的基因疫苗在提高细胞免疫的同时有可能增强抗体生成。也表明IL-15可有效提高T淋巴细胞的功能。

图2 PRRSV ORF5-pVAX1和猪IL-15-pVAX1核酸疫苗免疫后小鼠外周血CD4+细胞数量的变化Fig.2 Changes of CD4+in peripheral lymphocytes of mice inoculated with PRRSV ORF5-pVAX1 and pig IL-15-pVAX1

图3 PRRSV ORF5-p VAX1和猪IL-15-p VAX1核酸疫苗免疫后小鼠外周血CD8+细胞数量的变化Fig.3 Changes of CD8+in peripheral lymphocytes of mice inoculated with PRRSV ORF5-p VAX1 and pig IL-15-pVAX1
2.5 ELISA抗体检测
ELISA抗体检测结果见图4。所构建的核酸疫苗均能诱导机体产生特异性抗体,且加佐剂组抗体水平明显高于PBS对照组(P<0.05),差异显著,加佐剂组要高于pVAX1对照组,但差异不显著(P>0.05);同时还发现,加佐剂组高于PRRSV ORF5-pVAX1单独注射组,但是差异不显著(P>0.05)。该试验结果表明PRRSV ORF5基因疫苗能提高体液免疫水平。然而,佐剂分子猪IL-15不能有效地直接提高该疫苗的抗体生成水平。
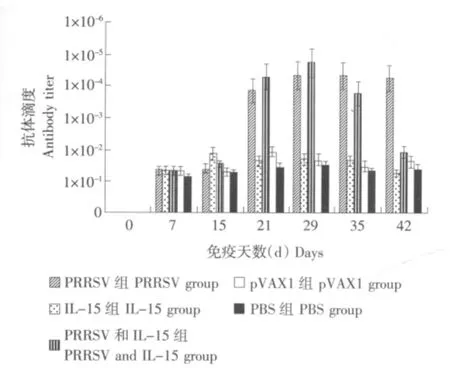
图4 PRRSV ORF5-pVAX1和猪IL-15-pVAX1核酸疫苗免疫后抗PRRSV IgG的动态变化Fig.4 Antibody changes of mice inoculated with PRRSV ORF5-pVAX1 and pig IL-15-pVAX1
2.6 小鼠IFN-γ的检测结果
采用双抗夹心ELISA法检测小鼠血清中的IFN-γ,检测结果见表2。
表2 小鼠血液中IFN-γ的水平(-±S)Table 2 L evel of IFN-γin blood of mice(-±S)
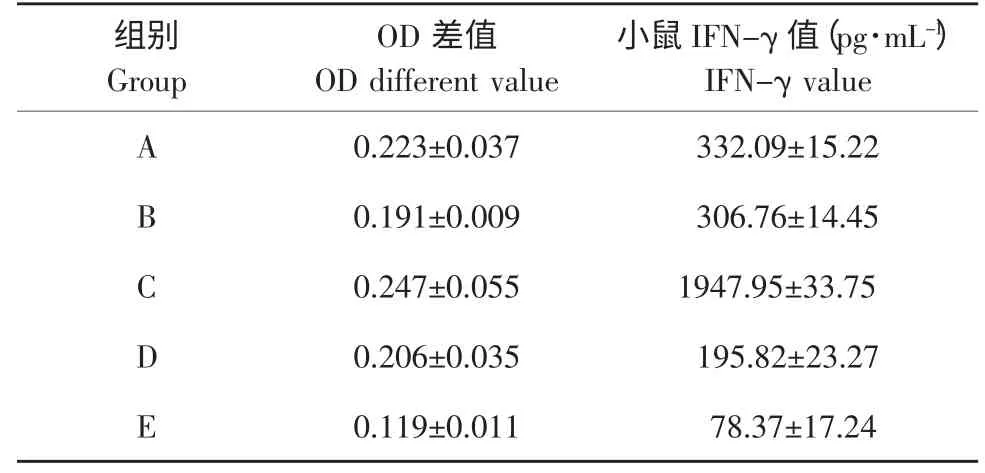
表2 小鼠血液中IFN-γ的水平(-±S)Table 2 L evel of IFN-γin blood of mice(-±S)
注:A-PRRSV ORF5-pVAX1;B-猪IL-15-pVAX1组;C-PR RSV ORF5-pVAX1与猪IL-15-pVAX组;D-pVAX1组;E-PBS组Note:A-PRRSV ORF5-pVAX1;B-Porcine IL-15-pVAX1;C-PR RSV ORF5-pVAX1 and porcine IL-15-pVAX;D-pVAX1;E-PBS
佐剂组小鼠IFN-γ水平明显高于PBS组和空载体组,差异有显著性(P<0.05)。该试验结果进一步证实了猪IL-15可有效提高PRRSV ORF5基因疫苗的免疫效果,但以提高细胞免疫水平为主,而该分子没有明显提高疫苗激发的体液免疫应答能力。
3 讨 论
IL-15具有与IL-2相似的生物学功能,但其不良反应弱于IL-2。将编码IL-15的真核表达载体与PRRSV ORF5-pVAX1疫苗共同免疫小鼠。结果表明,IL-15真核表达载体可在增强宿主特异性细胞免疫功能方面有协同作用。联合注射IL-15-pVAX1与PRRSV ORF5-pVAX1真核表达质粒组抗PRRSV产生能力虽高于单纯注射PRRSV ORF5-pVAX1疫苗组,但两组相比差异无显著性。说明IL-15在提高体液免疫反应方面无明显增强作用。分析其原因可能是由于IL-15属于Th1类细胞因子,可能在诱导细胞因子表达增加的同时,通过免疫网络抑制了Th2细胞的活性,因此降低了其体液免疫水平。
研究认为,IFN-γ的水平可以反映细胞介导的免疫反应的强度[8]。在本试验中,接种了PRRSV ORF5-pVAX1疫苗的小鼠血清中,可以检测到IFN-γ,而PBS及空载体对照组则检测到很少量。说明本试验所采用的PRRSV ORF5-pVAX1基因疫苗具有免疫原性,能够诱导细胞免疫应答,与国内外其他报道一致[9-10]。核酸疫苗既有亚单位疫苗的安全性,又有弱毒疫苗的有效性,能同时诱导机体产生体液和细胞免疫应答,是一种有前景的疫苗[11]。而PRRSV ORF5-pVAX1与猪IL-15-pVAX1共同注射可提高血清中IFN-γ的水平,进一步证实猪IL-15是一个有效的分子佐剂。
4 结论
本试验成功地构建了表达PRRS病毒GP5和猪IL-15的核酸疫苗。通过体外实验证明该两种质粒可在真核细胞中的复制。动物实验表明PRRSV GP5基因疫苗可有效诱导机体的细胞与体液免疫应答水平。猪IL-15可作为分子佐剂提高GP5基因疫苗的免疫效果,并以提高其细胞免疫能力为主要效应。本试验结果及其评价研究为研制PRRS新型疫苗提供了参考数据。
[1]韩银涛,苏柏光.猪繁殖与呼吸综合症病毒生物学特性[J].畜牧兽医杂志,2008,27(1):33-36.
[2]骆爱芳,郭万柱,宋振辉,等.猪白细胞介素-15基因的克隆及生物信息学分析[J].中国畜牧兽医,2007,34(10):37-40.
[3]Lovell D.Biologic agents for the treatment of juvenile rheumatoid arthritis:current status[J].Paediatr Drugs,2004,6(3):137-146.
[4]师东方,李一经,王君伟,等.猪轮状病毒与传染性胃肠炎病毒核酸免疫研究[J].东北农业大学学报,2005,36(5):605-610.
[5]钱刚,冯力,刘胜旺,等.猪传染性胃肠炎病毒纤突蛋白基因的修饰及原核表达的研究[J].东北农业大学学报,2005,36(5):611-614.
[6]任晓峰,李一经,李广兴,等.猪传染性胃肠炎病毒S基因杆状病毒/昆虫细胞表达系统重组质粒的构建[J].东北农业大学学报,2002,33(4):359-363.
[7]Sambrook K J,Fritsh E F,Maniatis T.分子克隆实验指南[M].2版.北京:科学出版社,1992.
[8]Tascon RE,Stavropulos E,Lukacs KV,etal.Protectionagainst Mycobacterum tuberculosis infection by CD8T cells requires the production of gammainterferon IfectImmun[J].1998,66:830-834.
[9]Shimizu M,Yamada S.Changeof lymphocytepopulationsin pigsinfection with porcine reproductive and respiratory syndrome(PRRS)virus[J].Vet Immunol Immunopathol,1996,50:19227.
[10]李华,杨汉春,许勇钢,等.猪繁殖与呼吸综合征病毒感染仔猪淋巴细胞亚群的动态[J].中国免疫学杂志,2001,17:208-211.
[11]师东方,贾永清,李一经,等.昆明鼠对猪轮状病毒核酸免疫的抗体应答[J].东北农业大学学报,2004,35(4):446-448.

