秋水仙素诱导离体培养越橘多倍体研究
李晓艳,张志东,李亚东,吴 林,刘海广
(吉林农业大学园艺学院,长春 130118)
多倍体育种是获得新品种的主要途径之一,利用秋水仙素处理植株是获得多倍体的有效方法。多倍体诱导试验最初多在田间进行,但由于变异细胞往往因层间取代而消失。采用试管苗处理可以使获得的诱变嵌合体在短时间内快速大量继代和分离。越橘属于杜鹃花科(Ericaceae)越橘属(Vaccinium),是一类富含营养的小浆果。关于秋水仙素诱导越橘多倍体研究目前在国内未有相关报道,国外的研究对诱变材料的鉴定仅限于根尖染色体计数和形态方面的观察[1-2]。本试验通过秋水仙素处理对越橘试管苗进行诱导,并对变异株系进行了筛选。越橘多倍体材料的获得将为培育越橘多倍体新品种奠定基础,为今后越橘品种选育提供亲本材料,对指导果树倍性育种具有重要的借鉴意义。
1 材料与方法
1.1 材料
采用3个越橘品种的组培苗:美登(Blomidon)、达柔(Darrow)、埃利奥特(Elliott)。以上3个品种为已知二倍体(2n=2x=24)[3-5],均来自吉林农业大学小浆果研究所。
培养基为改良的WPM基本培养基,添加玉米素(Zeatin,ZT) 0.7 mg·L-1,蔗糖 3%,琼脂 0.7%,pH 5.4。培养基在121℃,1.1 kg·cm-2压力下高温灭菌20 min。培养温度为23±2℃,光照强度为2 000 lx,光周期为16 h光照/8 h黑暗。
1.2 方法
1.2.1 药剂培养基法
将生长健壮的无菌试管苗剪去顶端,促进腋芽萌发,4~6 d后将试管苗剪成带叶的单芽茎段,转接到含有秋水仙素的WPM+ZT 2.0 mg·L-1培养基中。秋水仙素浓度设5个水平:0%(对照)、0.001%、0.002%、0.003%、0.005%。培养30 d左右,待处理的腋芽萌动抽茎长至1~2 cm后继代到不含秋水仙素的新鲜培养基中。
1.2.2 浸渍法
将生长健壮的无菌试管苗剪去顶端,促进腋芽萌发,4~6 d后将试管苗剪成带叶的单芽茎段,浸泡在经高压灭菌的0(对照)、0.05%、0.1%、0.2%秋水仙素水溶液中,然后放在摇床上以100 r·min-1震荡,处理时间分别为6、12和24 h。在超净工作台上将材料从秋水仙素水溶液中取出,无菌水冲洗3次,用无菌滤纸吸干表面水分后,将单芽茎段转接到不含秋水仙素的培养基中。待处理的腋芽萌动抽茎长至1~2 cm后继代到新鲜的培养基中。
1.3 变异材料检测
1.3.1 镜检
采用根尖常规压片进行染色体的观察,染色液选用铁矾-苏木精[6]。待越橘试管苗在生根培养基(1/2WPM+IBA 0.2 mg·L-1+活性炭 1 g·L-1)中的根长到0.5~1.0 cm左右进行压片镜检。选择染色体分散好的细胞在OLYMPUS显微镜下观察并拍照。每种材料观察30个以上的中期分裂细胞。
1.3.2 流式细胞光度法鉴定
参照Dolezel等利用流式细胞仪检测染色体的方法[7]。每个品种重复3次,以达柔为对照。采用美国B-D公司的B-D FACSCalibur流式细胞仪测定、分析细胞倍性。
存活率(%)=(成活个数/接种个数)×100%
变异率(%)=(变异个数/成活个数)×100%
2 结果与分析
2.1 药剂培养基法对越橘试管苗茎段诱导多倍体的影响
在本研究中3个供试越橘品种表现出相同的变化趋势,即在不添加秋水仙素的培养基中存活率都在90%以上,而只加入0.001%的秋水仙素存活率就大副下降,埃利奥特只加浓度为0.001%秋水仙素存活率由对照95.7%下降到30.0%,但没有检测出染色体加倍的细胞。秋水仙素浓度为0.003%和0.005%的处理中,因浓度高出现明显的药害作用。从存活率和变异率两方面考虑,本研究认为秋水仙素浓度为0.002%处理效果较好,结果见表1。

表1 秋水仙素药剂培养基法对越橘3个品种诱导多倍体的影响Table 1 Effect of medium with colchicine on polypoid induction of three blueberry cultivars
由表1可知,在对不同越橘品种处理效果方面,埃利奥特好于达柔,达柔好于美登。通过对达柔和埃利奥特2个品种第一次继代处理材料进行根尖染色体鉴定,变异率不到8.0%。由于变异细胞较少,在第二次继代培养后没有发现变异植株。
2.2 浸渍法对越橘试管苗茎段诱导多倍体的影响
在秋水仙素浓度0.05%的浸渍处理中,除美登在24 h浸渍处理中得到变异植株外,其他品种在6、12和24 h均没有得到变异植株。在0.1%的处理中,3个供试品种诱变效果较好,尤其是在24 h浸渍处理中得到了较高的变异率(见表2)。在0.2%的处理中,随着浸渍时间的延长,存活率和变异率都明显下降。从存活率和变异率两方面考虑,本研究认为秋水仙素浓度为0.1%,浸渍24 h效果最好。
从表2中可知,不同的越橘品种表现出相同的变化趋势。即在时间一定的情况下,存活率呈直线下降,而变异率则呈单峰曲线。综合3个品种的处理结果来看,达柔的诱导效果最好,在秋水仙素浓度为0.1%,浸渍处理24 h的试验组合中,存活率为28.9%,变异率22.6%。对得到的变异植株进行继代培养,并对其后代进行鉴定。
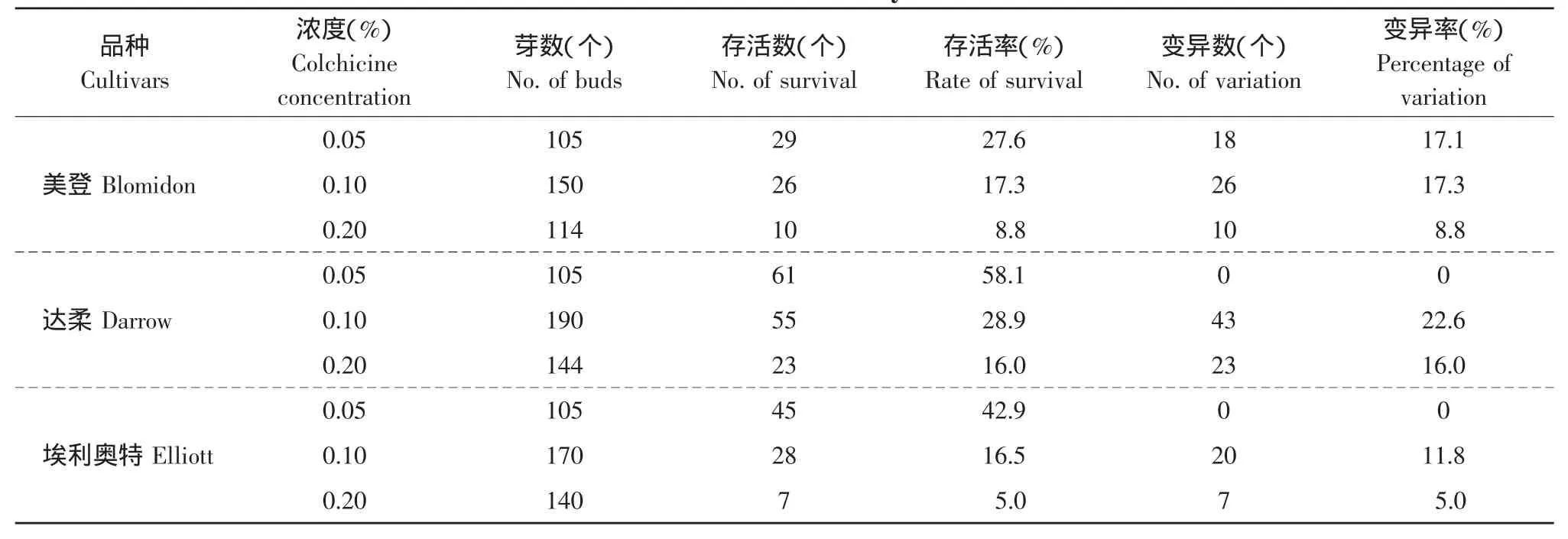
表2 不同秋水仙素浓度浸渍24 h对不同品种单芽茎段诱导多倍体的影响Table 2 Effect of different colchicine concentration and soaking 24 h on polypoid induction of mutation from blueberry buds
2.3 细胞学鉴定比较
2.3.1 根尖细胞染色体计数
对所获得的3个品种诱变株系进行根尖染色体鉴定(见表3)。第一次继代的8个株系全为嵌合体,无一株是同质四倍体。从整体上看,几乎所有异常株系染色体加倍细胞比例均较低,变动幅度13.2%~36.4%之间。其中最高是达柔,诱变株系染色体加倍细胞为36.4%,二倍体细胞占多数(见图1)。

表3 秋水仙素浸渍单芽茎段诱变株系倍性鉴定Table 3 Chromosome variation of mutational lines induced by soaking buds in colchicine liquid

图1 达柔组培苗根尖染色体计数Fig.1 Chromosomes of root-tip cell in Darrow
2.3.2 流式细胞光度法鉴定
结果见图2。
利用流式细胞仪对植物细胞倍性进行检测,横座标是所测的荧光或散射光的强度,用“道数”(Channel No.)来表示,其值与细胞内DNA含量成正比。纵座标表示被测细胞的绝对数目。对变异株系进行DNA含量测定,达柔对照二倍体植株只有一个主峰,位于横坐标大约50的位置。变异株有两个主峰,第一个峰的位置与对照相同,第二个峰的位置是对照峰值的二倍。由于荧光强度与细胞内DNA含量成正比,说明经秋水仙素浸渍诱导的变异株系体内含有两种DNA含量的细胞,即二倍体和四倍体细胞的嵌合体。在嵌合体中,二倍体细胞占优势,这与根尖染色体压片所得结果一致。
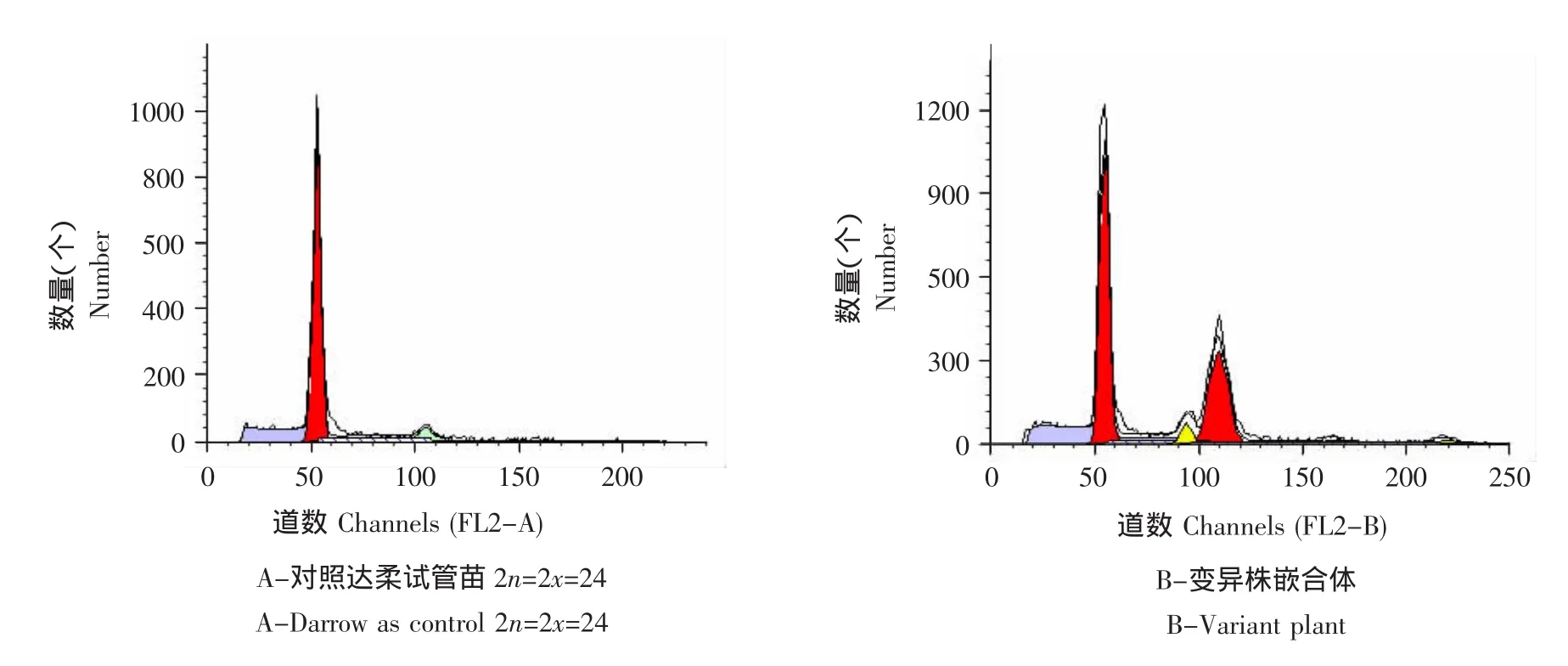
图2 越橘达柔变异植株DNA含量分析Fig.2 DNA content distribution of mutational Darrow plant
3 讨论与结论
试验中选用了两种秋水仙素处理材料的方法,但药剂培养基法处理效果不如浸渍法。浸渍法诱导在本试验中获得了变异株系,其中达柔品种最高变异率达22.6%。本研究认为诱导处理中保证植株良好的生长状况、创造细胞分裂的最佳生长条件、选择适宜的秋水仙素浓度和作用时间,是诱导多倍体成功的关键。王娜等用50 mg·L-1秋水仙素处理40 d诱导酸枣和冬枣,得到了同质的四倍体[8]。刘庆忠等将皇家嘎拉苹果离体新梢的叶片放入含0~200 mg·L-1秋水仙素的液体分化培养基上培养5 d,获得四倍体植株[9]。
在诱导植物多倍体时,嵌合体是一种常见的现象。韩礼星等在诱导猕猴桃多倍体研究中发现诱导后代全部为嵌合体[10]。马爱红等在进行四倍体葡萄诱导的试验中得到了二倍体和四倍体的嵌合体[11]。本研究通过根尖进行染色体鉴定,发现变异株系多为二倍体和四倍体的嵌合体。利用流式细胞仪对DNA含量进行检测也证明诱变材料后代均为嵌合体。如何进行越橘诱变株系嵌合体的分离和纯化将是下一步研究的重点。
利用流式细胞仪检测植物细胞倍性是近几年在我国兴起的一项新技术。本试验对越橘组培苗变异株鉴定采用根尖染色体计数和流式细胞仪测定DNA含量相结合的方法,鉴定结果一致,说明流式细胞仪检测方法可靠。李等将流式细胞光度术用于草莓倍性的鉴定,结果也证明随着倍性水平的增加细胞核DNA含量随之成倍增加[12]。张俊娥等采用倍性分析仪成功地鉴定了柑橘愈伤组织的遗传变异[13]。但由于越橘试管苗单株小,单株重达不到流式细胞仪测试用量(约0.5~1.0 g),故测试结果只能反应群体试管苗的倍性,不能反映越橘试管苗单株的倍性。所以采用根尖压片法和流式细胞仪分析相结合的方法鉴定越橘试管苗倍性是必要的。
[1]Lyrene P M,Percy J L.Production and selection of blueberry polyploidy in vitro[J].The Journal of Heredity,1982,73∶377-378.
[2]Percy J L,Lyrene P M.In vitro induction of tetraploidy in Vaccinium darrowi,V.elliottii and V.darrowi×V.elliotii with colchicine treatment[J].J Amer Soc Hort Sci,1984,109(1)∶4-6.
[3]张志东,李亚东,吴林.适宜高寒山区栽培的越橘优良品种-美登[J].园艺学报,1999,26(2)∶135.
[4]Susan H H,Galleta G J.Comparative chromosome morphology of diploid Vaccinium species[J].J Amer Soc Hort Sci,1971,96(3)∶289-292.
[5]Ballington J R,Galletta G J.Potential fertility levels in four diploid Vaccinium species[J].JAmerSocHortSci,1976,101(5)∶507-509.
[7]Dolezel J,Binarovā P,Lucrettr S.Analysis of nuclear DNA content in plant cells by flow cytometry[J].Biol Plant,1989,31∶113-120.
[8]王娜,刘孟军,代丽,等.秋水仙素离体诱导冬枣和酸枣四倍体[J].园艺学报,2005,32(6)∶1008-1012.
[9]刘庆忠,赵红军,刘鹏.秋水仙素处理离体叶片获得皇家嘎拉苹果四倍体植株[J].果树学报,2001,18(1)∶7-10.
[10]韩礼星,赵改荣,李玉红.猕猴桃多倍体诱导研究[J].果树科学,1998,15(3)∶273-276.
[11]马爱红,范培格,孙建设.四倍体葡萄诱导技术的研究[J].中国农业科学,2005,38(8)∶1645-1651.
[13]张俊娥,刘继红,邓秀新.采用倍性分析仪鉴定柑橘愈伤组织的遗传变异[J].遗传学报,2003,30(2)∶169-174.

