培养基添加物对马铃薯花药褐化及愈伤诱导的影响
赵 欣,卢翠华,陈伊里,石 瑛,邸 宏,张丽莉,张正国,张 欢
(东北农业大学农学院,哈尔滨 150030)
马铃薯是同源四倍体植物,基因分离复杂,隐性基因的表现频率低,建立在四倍体水平上的杂种实生苗和无性系选择的常规育种方法效率比较低。此外,马铃薯普通栽培种基因库比较狭窄,而具有丰富基因的大量野生种质资源约75%为二倍体,普通栽培种与其杂交受到倍性障碍而难以成功,限制了野生种质中优良基因的利用。因此,开展马铃薯花药培养研究对于优良品种的选育和改良具有重要意义。
我国从20世纪80年代开始进行马铃薯花药培养研究,但是一直存在诱导率低、白化苗、混倍现象等问题,因此,一直没能在马铃薯育种中得到广泛应用[1-3]。马铃薯花药培养受基因型、激素配比、温度和甘露醇处理等因素的影响[4-5],培养基中添加的硝酸银、活性炭、马铃薯提取液也是影响花药培养的重要因素。
本试验以马铃薯栽培种(Solanum tuberosum L.)为材料,对培养基添加物硝酸银、活性炭、马铃薯提取液进行研究,以期建立高效稳定的马铃薯花药培养体系,为马铃薯新品种的选育提供有效的育种途径。
1 材料与方法
1.1 材料
试验以Vangal、波C、讷16、春薯4号和内薯7号5个马铃薯品种(系)为材料,由大兴安岭地区农业科学研究所、黑龙江省农业科学院克山马铃薯研究所、东北农业大学马铃薯研究室、内蒙古呼盟农业科学研究所提供。
1.2 方法
1.2.1 花蕾的采集及花粉发育时期的检测
2008年7月,在马铃薯盛花期采集长度约5~6 mm的花蕾,取蕾时间8:00~9:00 am,撕开花瓣,取出花药(花药长度3~4 mm),用卡诺固定液固定,采用醋酸洋红染色,在40倍显微镜下观察花粉的发育阶段,选取小孢子处于单核靠边期花药,接种在培养基上。
1.2.2 培养基配方
诱导培养基:MS+0.5 mg·L-1NAA+0.5 mg·L-12,4-D+1.0 mg·L-1KT+6%蔗糖+0.7%琼脂;分化培养基:MS+0.5 mg·L-1IAA+0.5 mg·L-16-BA+1.0 mg·L-1KT+3%蔗糖+0.7%琼脂。
1.2.3 消毒与接种
将花蕾用自来水冲洗10~20 min,在超净工作台上,用70%的酒精灭菌30 s,0.1%的HgCl2消毒10 min,无菌水冲洗3~4次,用镊子取出花药接种于愈伤组织诱导培养基上。接种密度为每100 mL三角瓶40个,每个处理5瓶。置于25℃黑暗条件下培养,待诱导出愈伤组织或胚状体后,将其放于光下培养。光照 16 h·d-1,黑暗 8 h·d-1。
1.2.4 诱导培养基不同添加物的处理
1.2.4.1 硝酸银处理
将内薯7号和Vangal接种在诱导培养基中。培养基中分别添加10、20、30 mg·L-1的硝酸银,以不加硝酸银的为对照,30 d后统计褐化率及愈伤诱导率。
1.2.4.2 活性炭处理
将讷16和Vangal接种在诱导培养基中。培养基中分别添加0.25、0.50、0.75 g·L-1的活性炭,以不加活性炭为对照,30 d后统计褐化率及愈伤诱导率。
1.2.4.3 马铃薯提取液处理
将讷16、春薯4号、内薯7号和波C接种在诱导培养基中。培养基中添加马铃薯提取液50 g·L-1,以不添加马铃薯提取液为对照,30 d后统计愈伤诱导率。
1.2.4.4 统计方法
褐化率(%)=褐化的花药数/接种的花药数×100%
愈伤组织诱导率(%)=形成愈伤组织的花药数/接种的花药数×100%
1.2.5 分化培养基的筛选
选用内薯7号、讷16、波C和春薯4号的愈伤组织为试验材料,转入以下4种分化培养基。每个处理5瓶,置于光下培养,调查愈伤组织分化情况。
分化培养基如下:
A:MS+0.5 mg·L-1IAA+0.5 mg·L-16-BA+1.0 mg·L-1KT+3%蔗糖+0.7%琼脂
B:MS+0.5 mg·L-1NAA+0.5 mg·L-16-BA+1.0 mg·L-1KT+3%蔗糖+0.7%琼脂
C:MS+0.5 mg·L-1NAA+0.5 mg·L-16-BA+0.5 mg·L-1KT+3%蔗糖+0.7%琼脂
D:MS+0.5 mg·L-1NAA+1.0 mg·L-16-BA+1.0 mg·L-1KT+3%蔗糖+0.7%琼脂
1.2.6 再生植株根尖染色体倍性鉴定
再生植株在生根培养基(MS+0.5 mg·L-1NAA)中诱导生根,根长约1 cm时,7:00~8:00 am剪取根,洗去根上残存的培养基,置于冰水混合物中预处理24 h,用固定液(95%乙醇:冰乙酸=3:1)固定24 h,取出根用蒸馏水冲洗3~4遍,用醋酸洋红染色后制片,在100倍光学显微镜下观察染色体数目。
2 结果与分析
2.1 硝酸银对马铃薯花药褐化及愈伤组织诱导的影响
培养基中加入适量的硝酸银有助于减轻花药的褐化程度。由表1可知,随着硝酸银浓度的增加,花药的褐化率呈逐渐下降趋势,各处理间差异显著。内薯7号和Vangal的变化趋势基本一致,硝酸银浓度从10 mg·L-1增加到30 mg·L-1时,褐化率分别从77.5%和89.5%分别降到67%和71%,且均低于对照。
试验材料内薯7号和Vangal,随着硝酸银浓度的增加,愈伤组织诱导率呈先升后降趋势。当硝酸银浓度为20 mg·L-1时愈伤组织诱导率达到最大值,分别为10.5%和8.0%,与10、30 mg·L-1及对照相比差异显著。当硝酸银浓度增加到30 mg·L-1时,愈伤组织诱导率分别降到7.0%和3.5%,仍高于对照,但差异不显著。

表1 硝酸银对花药褐化率及愈伤组织诱导率的影响Table 1 Effect of silver nitrate on anther browning rate and callus induction rate
2.2 活性炭对马铃薯花药褐化及愈伤组织诱导的影响
由表2可知,讷16和Vangal在加入活性炭的培养基中褐化率均显著低于对照。随着活性炭浓度的增加,花药褐化率逐渐降低。其中讷16的褐化率从80%降到75%,Vangal从90%降到84%。
当活性炭浓度为0.50 g·L-1时,愈伤组织诱导率最高,讷16从原来的4.5%提高到11%,Vangal从原来的3.0%提高到8.0%,但当活性炭浓度增加到0.75g·L-1时,愈伤组织诱导率又分别降到7.5%和2.0%。Vangal的降幅较大,诱导率低于对照(见表 2)。

表2 活性炭对花药褐化率及愈伤组织诱导率的影响Table 2 Effect of active carbon on anther browning rate and callus induction rate
2.3 马铃薯提取液对马铃薯花药愈伤组织诱导的影响
由图1可知,讷16、春薯4号、内薯7号、波C这4份材料的愈伤组织诱导率均高于对照。其中波C的增幅较大,从0.5%提高到2.5%,提取液对其他3份材料的促进作用也非常明显。因此,培养基中加入适量的马铃薯提取液能促进愈伤组织的诱导。
2.4 不同培养基对花药分化的影响
利用新复极差法,对各培养基的出苗率在0.05水平下进行多重比较。由表3可知,愈伤组织在分化培养基A、B、C、D中均分化出苗,但各培养基间差异显著,出苗率大小为:A>B>D>C。培养基A的出苗率最高达15%,培养基C的出苗率最低为1.3%。
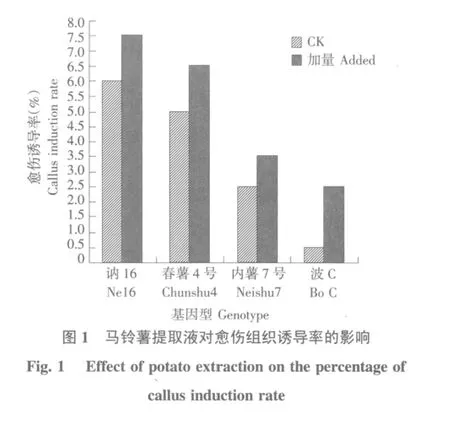
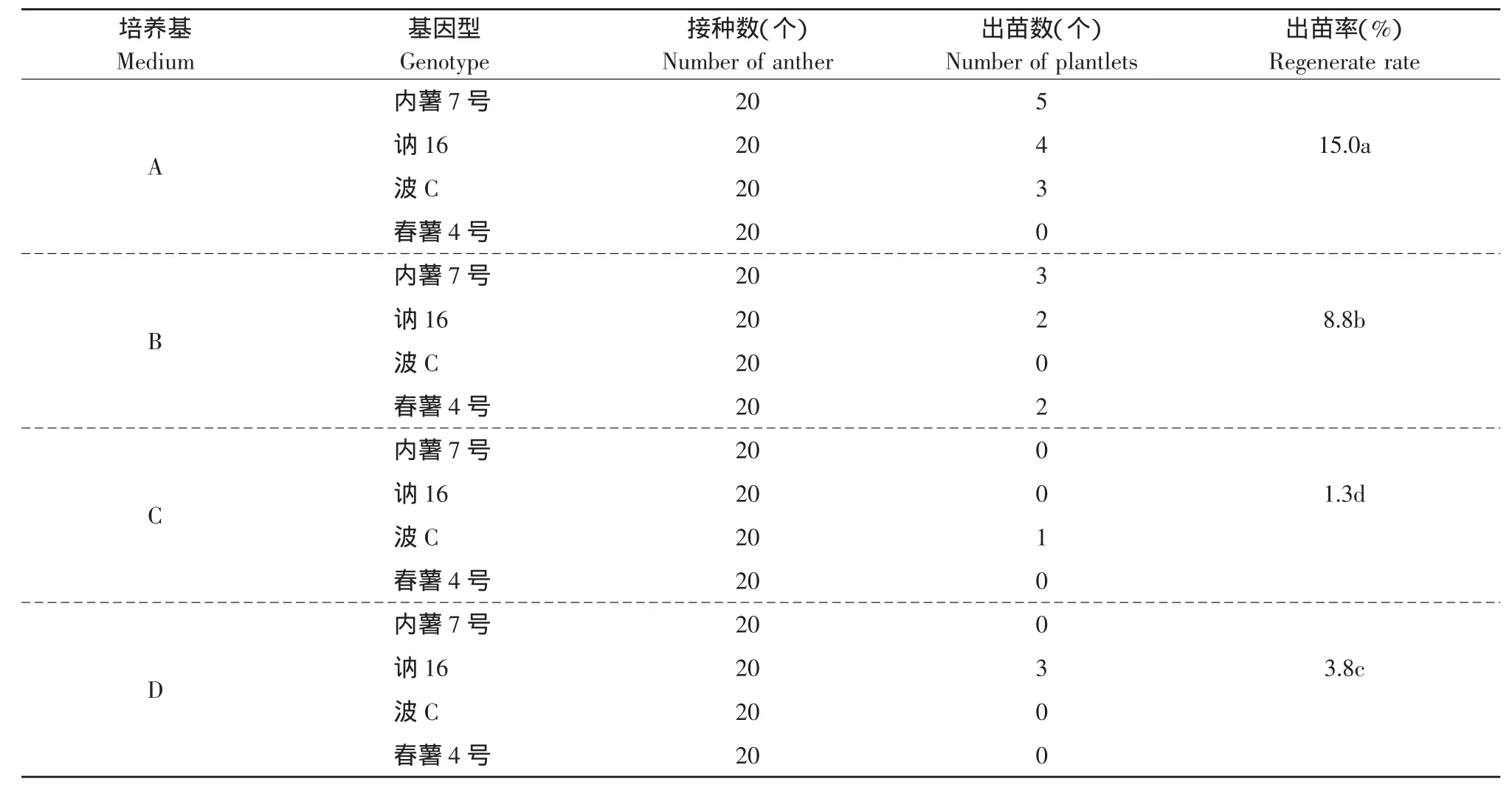
表3 不同的培养基对花药愈伤组织分化的影响Table 3 Effect of different culture media on differentiation of callus
2.5 再生植株染色体倍性鉴定
利用根尖染色体计数法对所获得的23株再生植株进行倍性鉴定。
由表4可知,双单倍体植株(2n=24)15株,发生率为65.2%,三倍体植株(2n=36)3株,占总数的13%,四倍体5株,占21.7%。
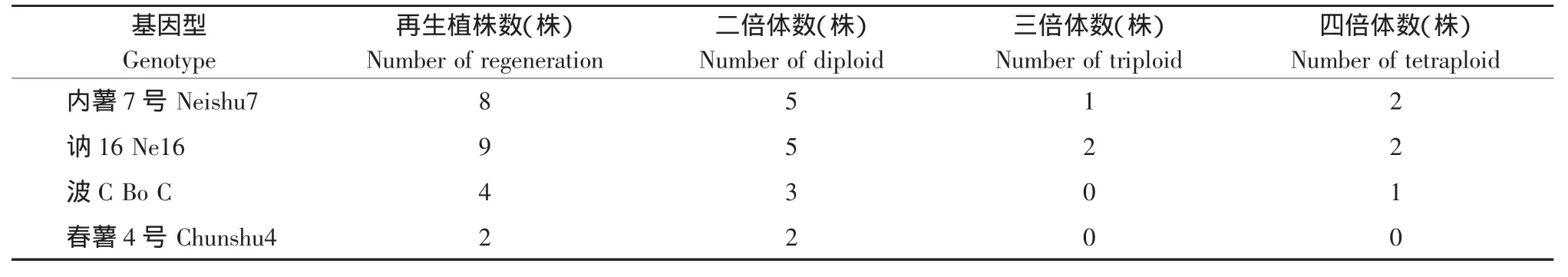
表4 花药再生植株的倍性Table 4 Ploidy of anther regenerated plants
3 讨论与结论
适量的培养基添加物有利于马铃薯花药培养。在培养基中加入20 mg·L-1硝酸银花药愈伤诱导率最高,褐化率明显降低;培养基中添加活性炭浓度为0.5 g·L-1时,效果最佳;添加5%的马铃薯提取液有利于马铃薯花药诱导。
3.1 硝酸银对马铃薯花药培养的影响
许多研究表明,在一定浓度范围内,硝酸银能促进单子叶及双子叶植物愈伤组织的诱导及植株再生[6-12]。硝酸银能够促进愈伤组织产生的主要原因是硝酸银能够抑制乙稀的产生,延缓花药褐化衰变所致。肖莉杰等认为硝酸银在玉米愈伤组织的诱导及其质量的提高方面有一定的作用[13]。张淑红等发现,硝酸银可抑制马铃薯叶肉原生质体的褐化,从而提高其细胞分裂频率[14]。虽然硝酸银对愈伤组织的诱导和分化有促进作用,但高浓度对植物细胞的生理代谢造成毒害,并导致畸形芽的形成。本研究表明,在一定的浓度范围内,硝酸银不仅可以促进愈伤组织的诱导还可防止褐化,这与前人的研究结果一致[13,15]。
3.2 活性炭对马铃薯花药培养的影响
众所周知,活性炭能吸附培养基中的有害物质,但只是在一定的浓度范围内有促进作用,当超过一定量时,反而抑制愈伤组织的形成。这是由于活性炭的吸收作用无选择性,在吸附培养基中有毒物质的同时,也吸附培养基中的生长调节剂、铁盐、维生素等与花药培养密切相关的物质,可能对花药培养有抑制作用[16-18]。本试验活性炭的浓度在0.25~0.50 g·L-1范围内有利于马铃薯花药培养。
3.3 马铃薯提取液对马铃薯花药培养的影响
利用天然植物提取液和多种类植物生长激素及生长物质,如月光花素、落地生根汁液、杂交稻根提取液和水稻幼穗汁液等,以提高水稻花粉植株诱导率和绿苗分化频率[19-20]。据报道,马铃薯提取液可大幅度提高植物花药培养时愈伤组织及胚状体的诱导率。戴朝曦研究证明5%的马铃薯提取液可明显提高愈伤组织的诱导率[21]。本试验结果与其一致,在诱导培养基中加入5%的马铃薯提取液有利于花药培养。
3.4 再生植株倍性鉴定
染色体计数法是确定倍性最基本和最可靠的方法。在单倍体育种中,通过花药培养、花粉培养及孤雌生殖等方法获得的再生植株一般是单倍体、双单倍体及其他倍性植株的混合群体。本试验利用根尖染色体计数法对获得的马铃薯再生植株进行了倍性鉴定,明确了各植株倍性。
[1]卢翠华,邸宏,张丽莉.马铃薯组织培养原理与技术[M].北京∶中国农业科学技术出版社,2009∶143.
[2]金黎平,杨宏福.马铃薯双单倍体的产生及其在遗传育种中的应用[J].马铃薯杂志,1996,10(3)∶181-186.
[3]梁彦涛,邸宏,卢翠华,等.马铃薯花药培养影响因素的研究[J].东北农业大学学报,2006,37(5)∶604-609.
[4]姜丽静,卢翠华,石瑛,等.温度对马铃薯花药愈伤诱导率的影响[J].中国马铃薯,2008,22(2)∶88-90.
[5]刘辉,卢翠华,邸宏,等.甘露醇预处理对马铃薯花药愈伤诱导率和褐化率的影响[J].中国马铃薯,2009,23(1)∶19-21.
[6]张鹏,傅爱根,王爱国.AgNO3在植物离体培养中的作用及可能的机制[J].植物生理学通讯,1997,33(5)∶376-379.
[7]Songstad D D,Duncan D R,Widholm J M.Effect of laminocyclopropane carboxylic acid,silver nitrate and morbornadiene on plant regeneration[J].Plant Cell Rep,1988(7)∶262.
[8]张鹏,凌定厚.提高菜心离体植株再生频率的研究[J].植物学报,1995,37(11)∶902.
[9]Chraibi K M,Latche A,Roustan J P,et al.Stimulation of shoot regeneration from cotyledons of Helianthus annuns by ethylene inhibitors silver and cobalt[J].Plant Cell Rep,1991(10)∶204.
[10]Marlon L,Browse J.Fascile transformation of Arabidopsis[J].Plant Cell Rep,1991(10)∶204.
[11]孙红炜,尚佑芬,杨崇良,等.影响玉米愈伤组织诱导和植株再生的有关因素研究[J].山东农业科学,2002,19(6)∶30-31.
[12]祝红艺,张显,崔维红.提高非洲菊试管苗叶片再生频率的研究[J].西北农业学报,2006,15(5)∶233-235.
[13]肖莉杰,苍晶,徐仲,等.黑龙江省骨干玉米自交系愈伤组织的诱导及植株再生[J].东北农业大学学报,2003,34(1)∶63-67.
[14]张淑红,王蒂,王清.影响马铃薯叶肉原生质体褐化的因素及AgNO3对其褐化和分裂的作用[J].中国马铃薯,2004,18(2)∶77-81.
[15]赵巧阳,赖钟雄.硝酸银在离体培养和转化中的作用及其机理[J].亚热带农业研究,2008,4(1)∶62-66.
[16]卜学贤,陈维伦.活性炭对培养基中生长调节物质的吸附作用[J].植物生理学报,1988,14(4)∶401.
[17]刘用生,殷桂勤,汪涛.GA3、6-BA、IBA与活性炭对李胚萌发及幼苗生长的影响[J].植物生理学通讯,1993,29(1)∶32.
[18]Ebert A,Taylor H F,Assessment of the changes of 2,4-D concentration in plant tissue media in presence of AC[J].Plant Cell Tissue and Organ Culture Plant Cell Rep,1990,20(3)∶165.
[19]王再生.月光花素对水稻花粉愈伤组织分化绿苗的影响[C].花药培养学术讨论会文集,1977∶271.
[20]黄斌.杂交水稻根提取液对诱导花粉愈伤组织和形成绿苗的影响[C].花药培养学术讨论会文集,1977∶271.
[21]戴朝曦.用花药培养法诱导马铃薯产生双单倍体植株的研究[J].科学通报,1982(24)∶1529-1532.

