TNF参与内毒素诱导肥大细胞HMGB1释放
杨 岚,李 蕾,许 飞,帅朝霞,陈国千*
(1.南京医科大学附属无锡妇幼保健院检验科,江苏无锡 214002;2.南京医科大学附属无锡人民医院医学检验科;3.皖南医学院第二附属医院检验科)
TNF参与内毒素诱导肥大细胞HMGB1释放
杨 岚1,李 蕾2,许 飞1,帅朝霞3,陈国千2*
(1.南京医科大学附属无锡妇幼保健院检验科,江苏无锡 214002;2.南京医科大学附属无锡人民医院医学检验科;3.皖南医学院第二附属医院检验科)
目的探讨肿瘤坏死因子-α(TNF-α)在内毒素诱导肥大细胞高迁移率族蛋白B1(HMGB1)释放中的作用。方法采用小鼠肥大细胞株P815培养物,观察100 μ g/L脂多糖(LPS)诱导后培养上清液中HMGB1、TNF-α含量的变化,不同剂量抗TNF-α中和抗体IgG对 LPS诱导HMGB1释放的影响,及TNF-α对HMGB1释放的诱导作用。HMGB1含量采用酶联免疫吸附试验检测。结果培养上清液中HMGB1含量随LPS诱导时间而升高,而TNF-α含量于诱导6 h时达到峰值;5、25 mg/L抗TNF-α抗体对LPS诱导HMGB1释放有明显的抑制作用(P<0.05);TNF-α显示具有诱导肥大细胞释放HMGB1的作用,并呈时间、剂量相关性。结论TNF-α参与内毒素诱导肥大细胞释放HMGB1的过程。
高迁移率族蛋白B1;肥大细胞;内毒素;肿瘤坏死因子-α
(Chin J Lab Diagn,2010,14:0985)
肥大细胞为体内的一种重要免疫细胞。近年研究[1-4]显示,肥大细胞在内毒素作用下,释放肿瘤坏死因子(TNF)、白介素、组胺等多种细胞因子或生物活性介质,参与急慢性炎症反应。胞外高迁移率族蛋白B1(high mobility group box 1,HMGB1)作为近年发现的一种重要晚期炎症介质,受到广泛关注和重视[5];多种组织细胞如巨噬细胞、上皮细胞、肝细胞等受内毒素等激活后释放HMGB1,参与诸多疾病如脓毒症、关节炎、急性胰腺炎、肺炎等的发病过程[6-9]。我们最近研究发现,内毒素能诱导肥大细胞释放HMGB1,为了解TNF-α在内毒素诱导HMGB1释放中的作用,进行如下研究。
1 材料与方法
1.1 材料
小鼠肥大细胞株P815购自中国科学院细胞库。脂多糖(LPS)、小鼠 TNF-α和羊 IgG(正常对照)为Sigma公司产品,羊抗小鼠TNF-α抗体 IgG和小鼠TNF-αELISA试剂盒为 R&D公司产品,HMGB1 ELISA试剂盒为Shino-Test公司产品,RPMI 1640和OPTI-MEM I培养液为Gibco公司产品。
1.2 方法
1.2.1 培养细胞实验 小鼠肥大细胞株P815以含10%新生牛血清的 RPMI 1640培养液在37℃、5%CO2培养箱中进行培养,实验前2 h用无血清OPTIMEM I培养液置换,并调节细胞浓度为2×106/ml。诱导一定时间后,收集细胞培养上清液,保存于-20℃待测。实验均重复5次。
1.2.2 HMGB1、TNF-α含量测定 细胞培养上清液中HMGB1、TNF-α含量采用ELISA试剂盒检测,按产品使用说明书进行。
1.3 统计学方法
采用SPSS 11.0统计软件包进行双侧 t检验分析和多样本均数间两两比较(Dunnett-t检验法),P<0.05为有统计学意义。
2 结果
2.1 LPS对肥大细胞HMGB1、TNF-α释放的诱导作用
小鼠肥大细胞株P815经100 μ g/L LPS诱导后,培养上清液中HMGB1含量于6 h时显示升高,并随时间延长而进一步升高,TNF-α含量于6 h时达峰值,随后逐渐降低(图1)。通过台盼蓝细胞染色显示,100 μ g/L LPS对肥大细胞株P815未见明显细胞毒作用。
2.2 抗TNF-α抗体对LPS诱导肥大细胞HMGB1释放的影响
5、25 mg/L 抗 TNF-α抗体 IgG 对 100 μ g/L LPS诱导(24 h)小鼠肥大细胞株P815的HMGB1释放显示明显的抑制作用(P<0.05),后者抑制率为40.1%,而正常对照IgG没有影响(P>0.05)(图2)。
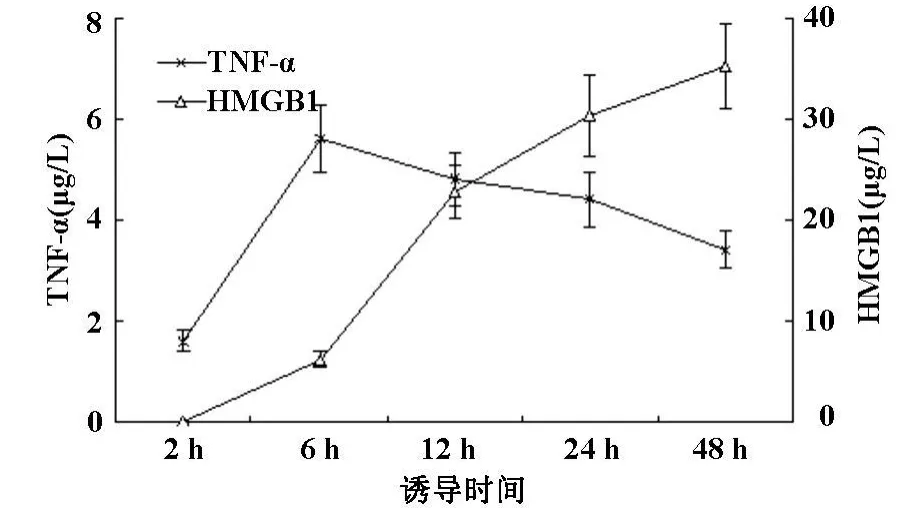
图1 脂多糖诱导后肥大细胞培养上清液中HMGB1和TNF-α含量的变化

图2 抗TNF-α抗体对脂多糖诱导肥大细胞HMGB1释放的影响
2.3 TNF-α对肥大细胞HMGB1释放的诱导作用
2、10 μ g/L TNF-α均显示能诱导小鼠肥大细胞株P815释放HMGB1,并呈时间、剂量相关性,10 μ g/L TNF-α对肥大细胞株P815释放HMGB1的诱导作用(6、12、24 h)明显强于 2 μ g/L TNF-α(P <0.01)(表1)。
表1 TNF-α诱导后肥大细胞培养上清液中HMGB1含量的变化(μ g/L,n=5,±s)

表1 TNF-α诱导后肥大细胞培养上清液中HMGB1含量的变化(μ g/L,n=5,±s)
与TNF-α 2 μ g/L组比较,*P<0.01
组别 诱导时间2 h 6 h 12 h 24 h TNF-α2μ g/L 0 3.6±0.8 6.1±1.6 7.8±1.5 TNF-α10 μ g/L 0 7.6±1.8*14.6±3.1* 16.3±3.7*
3 讨论
HMGB1为一种非组蛋白,广泛分布于各种组织细胞中,主要存在于胞核,分子量约为3万道尔顿,因其在聚丙烯酰胺凝胶电泳中的高迁移能力而得名。1999年,Wang等[6]发现HMGB1可以释放到胞外并介导炎症反应,为内毒素血症和脓毒症的重要炎症介质。随后诸多研究[5,8,9]表明,炎症介质HMGB1还参与关节炎、急性胰腺炎、肺炎、脑膜炎、系统性红斑狼疮、动脉粥样硬化、烫伤、机械外伤、缺血再灌注损伤等的病理过程。LPS可诱导巨噬细胞、单核细胞、树突状细胞、上皮细胞、肝细胞等释放HMGB1[5-7],但对肥大细胞HMGB1释放的诱导作用尚未见报道。动物实验和细胞实验结果显示,LPS诱导HMGB1释放要晚于TNF-α、白介素-1等细胞因子的产生,因此,HMGB1被认为是一种晚期炎症介质[6,10]。
肥大细胞作为一种重要的机体免疫细胞,广泛分布于全身结缔组织中,不仅在超敏反应中起重要作用,也参与急慢性炎症反应。近年一些研究[1-4]显示,LPS可诱导肥大细胞释放TNF-α、白介素-4、白介素-5、白介素-6、白介素-10、白介素-13、组胺等多种细胞因子或生物活性介质。最近Passante等[11]报道RBL-2H3肥大细胞不宜用于介质释放的研究。为了探讨LPS诱导后肥大细胞是否释放HMGB1,本研究使用小鼠肥大细胞株P815实验,结果显示肥大细胞经LPS诱导后HMGB1释放明显增多,提示炎症介质HMGB1参与肥大细胞在内毒素介导的炎症反应中的作用;同时,结果也表明LPS激活肥大细胞后,诱导产生的HMGB1峰值明显晚于TNF-α,与在其它种类细胞中观察到的现象[10]一致。
细胞受LPS等激活后,胞内HMGB1因缺乏引导肽结构而不能以高尔基体/内质网途径但可通过非经典途径释放到胞外,其释放机制还未完全清楚。胥彩林等[12]研究显示核转录因子NF-κ B信号转导通路参与LPS介导多种器官组织HMGB1基因表达的调控过程,最近Kim[13]和张健[14]等报道LPS诱导HMGB1释放涉及JAK/STAT通路,但“早期”的致炎细胞因子TNF-α是否参与LPS诱导晚期炎症介质HMGB1释放过程研究甚少。Wang等[15]和Wahamaa等[16]分别报道,TNF-α诱导垂体细胞和巨噬细胞释放HMGB1,我们近年研究[17]表明LPS诱导巨噬细胞HMGB1释放与CD14、TNF-α依赖途径有关。本研究结果显示,TNF-α对肥大细胞释放HMGB1具有诱导作用,使用抗TNF-α中和抗体能部分抑制LPS诱导后肥大细胞的HMGB1释放,表明内毒素诱导肥大细胞释放HMGB1部分与TNF-α有关。
[1]Yamamoto N,Kaneko I,Motohashi K,et al.Fatty acid-binding protein regulates LPS-induced TNF-alpha production in mastcells[J].Prostaglandins Leukot Essent Fatty Acids,2008,79(1-2):21.
[2]Chiba N,Masuda A,Yoshikai Y,et al.Ceramide inhibits LPS-induced production of IL-5,IL-10,and IL-13 from mast cells[J].J Cell Physiol,2007,213(1):126.
[3]Kagami S,Kanari H,Suto A,et al.HMG-CoA reductase inhibitor simvastatin inhibits proinflammatory cytokine production from murine mast cells[J].Int Arch Allergy Immunol,2008,146(Suppl 1):61.
[4]王沁芳,赵龙凤,郝彦琴,等.内毒素对肥大细胞释放白细胞介素-4的影响[J].中华传染病杂志,2009,27(1):16.
[5]Yang H,Tracey KJ.Targeting HMGB1 in inflammation[J].Biochim Biophys Acta,2009 Dec 4.[Epub ahead of print]
[6]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediatorof endotoxin lethality in mice[J].Science,1999,285(5425):248.
[7]陈国千,邵耀明,王春新,等.脂多糖诱导肝细胞HMGB1释放及其信号通路研究[J].中国实验诊断学,2009,13(11):1518.
[8]Bianchi ME,Manfredi AA.Immunology.Dangers in and out[J].Science,2009,323(5922):1683.
[9]Karlsson S,Pettilä V,Tenhunen J,et al.H MGB1 as a predictor of organ dysfunction and outcome in patients with severe sepsis[J].Intensive Care Med,2008,34(6):1046.
[10]Wang H,Yang H,Tracey KJ.Extracellular role of HMGB1 in inflammation and sepsis[J].J Intern Med,2004,255(3):320.
[11]Passante E,Ehrhardt C,SheridanH,et al.RBL-2H3 cells are an imprecise model for mast cell mediator release[J].Inflamm Res,2009,58(9):611.
[12]胥彩林,姚咏明,于 燕,等.NF-κ B抑制剂对内毒素休克大鼠高迁移率族蛋白B1表达的影响[J].解放军医学杂志,2004,29(1):45.
[13]Kim JH,Kim SJ,Lee IS,et al.Bacterial endotoxin induces the release of high mobility group box 1 via the IFN-beta signaling pathway[J].J Immunol,2009,182(4):2458.
[14]张 健,帅朝霞,胡志刚,等.JAK/STAT通路在脂多糖诱导肝细胞HMGB1释放中的作用[J].南京医科大学学报(自然科学版),2009,29(11):1514-1516,1533.
[15]Wang H,Vishnubhakat JM,Bloom O,et al.Proinflammatory cytokines(tumor necrosis factorand interleukin1)stimulate release of high mobility group protein-1 by pituicytes[J].Surgery,1999,126(2):389.
[16]Wahamaa H,Vallerskog T,Qin S,et al.HMGB1-secreting capacity of multiple cell lineages revealed by a novel HMGB1 ELISPOT assay[J].J Leukoc Biol,2007,81:129.
[17]Chen G,Li J,Ochani M,et al.Bacterial endotoxin stimulates macrophages to release HMGB1 partly through CD14-and TNF-dependent mechanisms[J].J Leukoc Biol,2004,76:994.
Involvement of TNF in HMGB1 release of lipopolysaccharide-induced mast cells
YANGLan,LI Lei,XU Fei,et al.(Department of Clinical Laboratory,Wuxi Maternal and Child Health Hospital Affiliated to NJMU,Wuxi214002,China)
ObjectiveTo study the effect of TNF-αin extracellular release of high mobility groupbox 1(HMGB1)in endotoxininduced mast cells.MethodsThe concentrations of HMGB1 andTNF-αin the culture mediumwere analysed by ELISA,and the effect of anti-TNF-αneutralizing antibody with various concentrations was observed on HMGB1 release,after P815 mast cells were induced with 100 μ g/L lipopolysaccharide(LPS).HMGB1 release was investigated in P815 mast cells induced by mouse TNF-α.ResultsHMGB1 level in the culture medium time-dependently increased after mast cells were inducedwith LPS,andTNF-αlevel tended to peak 6 hours after induction.Anti-TNF-αantibody with 5 mg/L and 25 mg/L significantly inhibited LPS-induced production of HMGB1 by mast cells(P<0.05).TNF-αdose-and time-dependently induced extracellular release of HMGB1.ConclusionEndotoxin induces mast cells to release HMGB1 partly through TNF-α-dependent mechanism.
HMGB1 protein;mast cells;endotoxin;tumor necrosis factor-alpha
R392.1
A
1007-4287(2010)07-0985-03
江苏省自然科学基金(BK2006027);教育部留学回国人员科研启动基金
*通讯作者
杨岚(1979-),女,硕士研究生,研究方向:炎症介质高迁移率族蛋白B1的基础和临床。陈国千,博士生导师,教授。
2010-01-17)

