缓激肽对脑胶质瘤大鼠occludin和ZO-1mRNA的调节和机制
刘丽波,薛一雪,王萍
(中国医科大学 基础医学院神经生物学教研室,沈阳 110001)
脑胶质瘤是严重影响人类健康的疾病,其预后差、生存期短,除手术治疗外,化疗是脑胶质瘤治疗的主要手段之一,但由于血肿瘤屏障(blood-tumor barrier,BTB)的存在限制了抗肿瘤药物进入中枢神经系统,严重影响了化疗疗效[1]。为了将药物转运到肿瘤组织,选择性地增加血肿瘤屏障的通透性是一个理想的策略,研究发现小剂量缓激肽(bradykinin,BK)可以选择性开放血肿瘤屏障,却不影响正常脑组织毛细血管的通透性[2]。药物通过血肿瘤屏障到达肿瘤细胞主要有两条途径:增加吞饮小泡数量的跨细胞途径和开放紧密连接的细胞旁途径,研究证明缓激肽可同时通过上述两条途径选择性开放血肿瘤屏障[3,4]。我们的前期研究进一步证明BK可通过降低肿瘤微血管的紧密连接相关蛋白occludin、zonula occluden-1(ZO-1)和 claudin-5 的蛋白水平开放紧密连接[5],但BK是否能够影响紧密连接相关蛋白的mRNA水平及其调节机制仍不清楚。cAMP反应元件结合蛋白 (cAMP response element binding protein,CREB)是一种重要的核转录因子,可能通过影响紧密连接相关蛋白的转录调节血脑屏障的通透性[6]。本研究旨在探讨BK对紧密连接相关蛋白occludin和ZO-1的转录调节作用,并分析可能的调节机制,进一步完善BK开放血肿瘤屏障紧密连接机制的阐述。
1 材料与方法
1.1 材料
1.1.1 动物:健康雌性Wistar大鼠112只,体质量180~200 g,购于中国医科大学实验动物中心。
1.1.2 试剂和器材:缓激肽、葡聚糖购于Sigma Chemical公司;TRIzol购于Invit rogen公司;RT-PCR试剂盒购于大连TaKaRa公司;兔抗大鼠CREB和兔抗大鼠p-CREB抗体购于Cell Signaling公司;小鼠抗大鼠β-actin抗体购于Santa Cruz公司;辣根过氧化物酶标记的山羊抗兔、山羊抗小鼠二抗购于北京中杉公司。
二氧化碳培养箱(Forma Scientific,美国);超净工作台(苏净集团安泰公司SW-CJ-1FD型);立体定向仪(日本光电株式会社);微量输液泵(B.Braun Melsungen AG,德国);台式低温超速离心机(3K18,德国);分光光度计(Bausch&Lomb,美国);PCR 扩增仪 (Biometra,GER);聚丙烯酰胺凝胶电泳仪(Bio-Rad,美国);转印仪(DYY-Ⅲ 40B,北京市六一仪器厂);-80℃超低温冰箱(SANYO,日本);恒温冷冻切片机(Leica,德国)。
1.2 方法
1.2.1 动物分组和模型制备:实验动物随机分为假手术组,模型组,BK 5 min组,BK 10 min组,BK 15 min组,BK 30 min组,BK 60 min组。每组16只大鼠。假手术组为未进行肿瘤细胞移植的正常大鼠,模型组仅给予生理盐水。
常规培养C6大鼠胶质瘤细胞,用含有1.2%甲基纤维素的DMEM培养基制备C6胶质瘤细胞悬液,浓度为1×105/μl备用。大鼠用10%水合氯醛(3.5 ml·kg-1)麻醉后,将其固定在脑立体定位仪上;将制备好的细胞悬液用微量注射器注入右侧大脑基底核(前囟前1 mm,矢状缝旁开3 mm,深4.5 mm)。肿瘤移植2周后用备用。
1.2.2 缓激肽灌注:C6胶质瘤细胞移植2周后,用水合氯醛麻醉胶质瘤大鼠,使其仰卧于操作台上,进行腹侧颈部正中切口,分离右侧的颈总和颈外动脉,结扎颈外动脉远端,以10 μg·kg-1·min-1的速度从颈总动脉的近端灌注BK。在操作的同时监测大鼠的体温和血压。
1.2.3 RT-PCR法检测occludin和ZO-1mRNA表达:采用15%葡聚糖梯度离心的方法提取正常脑组织和肿瘤组织的微血管段,应用TRIzol提取微血管段的总RNA,逆转录合成cDNA,进行PCR扩增。occludin引物:Sense 5′-GACCACTATGAAACCGAC TA-3′;Antisense 5′-CTCACTTCTCCAGCAACC-3′,扩增长度为 411 bp;ZO-1引物:Sense 5′-TGCTATTAC ACGGTCCTC-3′;Antisense 5′-TGGTGCTCCTAAACAATC-3′,扩增长度为 316 bp;β-actin引物:Sense 5′-GTGGGGCGCCCCAGGCACCA-3′;Antisense 5′-GCTCGGCCGTGGTGGTGAAGC-3′,扩增长度为 493 bp。以上引物由北京三博远志公司合成。PCR反应参数:94 ℃2 min,94 ℃30 s,58 ℃30 s,72 ℃45 s,共30个循环,72℃延伸10 min。扩增产物经1.2%琼脂糖凝胶电泳,溴化乙锭染色后用Bio-Rad凝胶成像仪成像,用Fluor Chen V 2.0 Stand Alone软件对图像进行分析,结果以 occludin/β-actin、ZO-1/β-actin 的整合光密度值 (integrated density value,IDV)的比值表示。
1.2.4 Western blot检测CREB和p-CREB的蛋白表达:提取正常脑组织和肿瘤组织微血管段,将各组微血管段置于裂解缓冲液中匀浆,离心,取上清液,用考马斯亮蓝G-250结合法进行蛋白定量;等量蛋白(10~20 μg)经12%SDS-PAGE分离后,电转移到硝酸纤维素膜上,在5%脱脂奶粉中4℃封闭过夜;分别用兔抗大鼠CREB多克隆抗体(1∶500稀释)、兔抗大鼠p-CREB多克隆抗体(1∶800稀释)和小鼠抗大鼠β-actin多克隆抗体(1∶1 000稀释)与硝酸纤维素膜室温孵育2 h;经相应二抗(1∶4 000稀释)室温孵育2 h后用增强的化学发光法检测免疫复合物的表达。采用Chemi Imager 5500 V2.03软件对蛋白条带进行扫描,用Fluor Chen 2.0计算机图像分析系统计算各条带IDV,结果以CREB/β-actin和p-CREB/β-actin的IDV比值表示。
1.3 统计学分析
实验数据用±s表示,用SPSS 13.0统计软件对数据进行处理。组间比较用单因素方差分析,P<0.05认为有统计学差异。
2 结果
2.1 RT-PCR法检测occludin和ZO-1mRNA的表达
在假手术组和模型组occludin和ZO-1mRNA有较高的表达,BK作用5 min后,肿瘤微血管中oc-cludin和ZO-1mRNA表达开始减少,最低值出现在BK作用15 min时,而后逐渐增加,在60 min时基本恢复到模型组水平(图1)。与假手术组和模型组相比,BK 15 min组occludinmRNA的表达分别减少了24.56%和42.22%,ZO-1mRNA的表达分别减少了32.58%和44.49%(表1)。
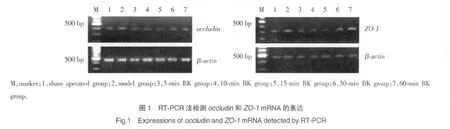
表1 缓激肽对occludin与ZO-1mRNA表达和CREB与p-CREB蛋白表达的影响(±s)Tab.1 Effect of bradykinin on the mRNAexpression of occludin and ZO-1 and the protein expression of CREB and p-CREB(±s)
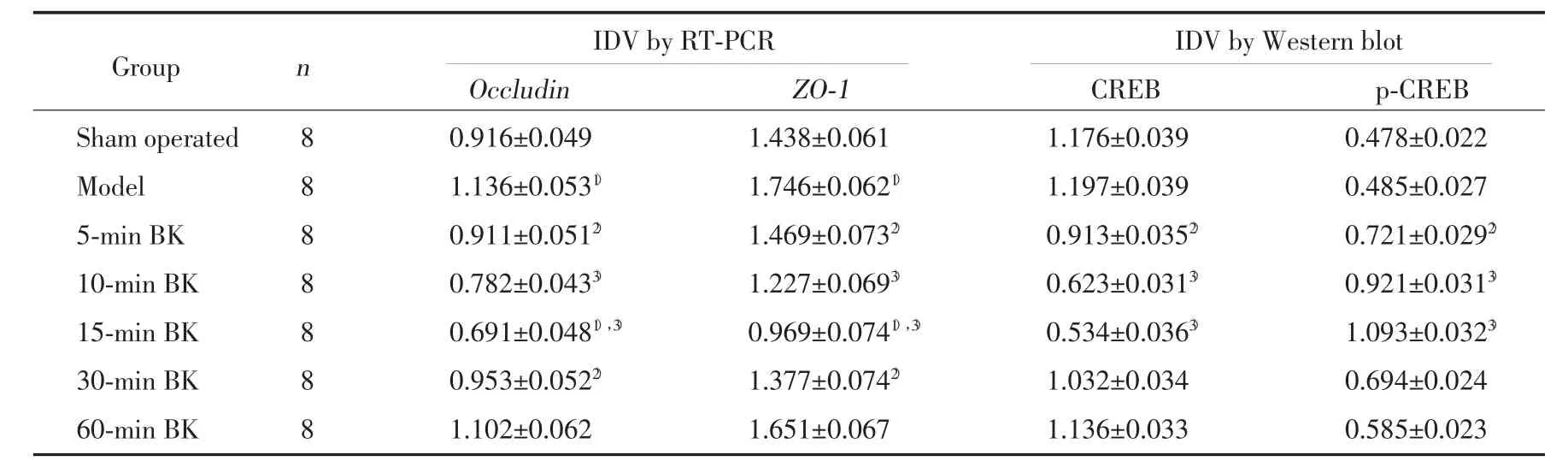
表1 缓激肽对occludin与ZO-1mRNA表达和CREB与p-CREB蛋白表达的影响(±s)Tab.1 Effect of bradykinin on the mRNAexpression of occludin and ZO-1 and the protein expression of CREB and p-CREB(±s)
1)P<0.05 vs sham operated group;2)P<0.05 vs model group;3)P<0.01 vs model group.
IDV by RT-PCR IDV by Western blot Occludin ZO-1 CREB p-CREB Sham operated 8 0.916±0.049 1.438±0.061 1.176±0.039 0.478±0.022 Model 8 1.136±0.0531) 1.746±0.0621) 1.197±0.039 0.485±0.027 5-min BK 8 0.911±0.0512) 1.469±0.0732) 0.913±0.0352) 0.721±0.0292)10-min BK 8 0.782±0.0433) 1.227±0.0693) 0.623±0.0313) 0.921±0.0313)15-min BK 8 0.691±0.0481),3) 0.969±0.0741),3) 0.534±0.0363) 1.093±0.0323)30-min BK 8 0.953±0.0522) 1.377±0.0742) 1.032±0.034 0.694±0.024 60-min BK 8 1.102±0.062 1.651±0.067 1.136±0.033 0.585±0.023 Group n
2.2 Western blot检测CREB和p-CREB的表达
在假手术组和模型组CREB有较高的表达,两组相比差异无统计学意义(P>0.05);BK作用5 min后,肿瘤微血管中CREB的蛋白表达水平开始降低,在BK作用15 min时降低最明显(P<0.01),而后逐渐增加,在60 min时基本恢复到模型组的水平。与CREB的表达趋势相反,在假手术组和模型组p-CREB仅有少量表达,两组相比差异无统计学意义(P>0.05);BK作用5 min后,肿瘤微血管中p-CREB的蛋白表达水平开始升高,在BK作用15 min时达到峰值(P<0.01),而后逐渐减弱,在60 min时基本恢复到模型组的水平(图2,表1)。

3 讨论
血脑屏障由基膜、周细胞、星型胶质细胞终足和脑内皮细胞组成,其中存在于相邻内皮细胞间的紧密连接在维持血脑屏障的结构和功能中起重要作用,它可以限制亲水性物质和大分子物质在细胞旁的扩散[7]。紧密连接主要由跨膜蛋白、胞质附着蛋白和细胞骨架蛋白组成,已经确定的几个组成紧密连接的跨膜蛋白包括occludin、claudins和黏附连接分子;胞质附着蛋白 ZO-1、ZO-2、ZO-3 和 cingulin[8]。ZO-1是第一个被确定的紧密连接相关蛋白,它是连接跨膜蛋白(如occludin和claudin-5)和细胞骨架蛋白actin的桥梁[9]。occludin是第一个被确定的定位于紧密连接的完整膜蛋白[10],经过4次跨膜形成两个细胞外环,细胞外环与相邻内皮细胞的occludin细胞外环相互作用封闭细胞间缝隙[11]。尽管occludin在维持紧密连接完整性中的作用仍有争议,但大多数研究者认为occludin的缺失会引起紧密连接开放[7,12]。这些紧密连接相关蛋白彼此之间存在多重联系,不仅维持紧密连接的完整性,而且为脑内皮提供结构支持,如果这些蛋白发生紊乱将会直接影响紧密连接的完整性,进而改变血脑屏障的功能。本研究结果显示BK降低了血肿瘤屏障微血管内皮细胞紧密连接相关蛋白occludin和ZO-1mRNA的表达,我们的前期研究已经证明BK能够降低occludin和ZO-1的蛋白表达水平,说明BK能够在转录和蛋白水平上调节occludin和ZO-1的表达。紧密连接相关蛋白occludin表达的减少可使其封闭细胞旁缝隙的能力缺失,引起紧密连接开放;ZO-1表达减少后则会引起occludin等跨膜蛋白从细胞骨架上解离,也可使occludin封闭细胞旁缝隙的能力缺失,引起紧密连接开放。这些结果说明BK能够在不同水平上降低occludin和ZO-1的表达,通过细胞旁途径开放血肿瘤屏障。
CREB是重要的核转录因子,具有广泛而复杂的功能,在生理和病理条件下都发挥非常重要的作用[13]。CREB可被多种信号转导通路调控,磷酸化的CREB是其活性形式,研究显示CREB激活后可引起内皮细胞紧密连接相关蛋白在DNA水平上发生改变,进而引起血脑屏障结构和功能的破坏[6],但CREB在BK调节紧密连接相关蛋白转录中的作用尚不清楚。研究显示CREB参与了BK对人气管平滑肌环氧化酶2的转录调节[14],同时我们研究小组证明BK作用后能够诱导C6胶质瘤细胞内CREB蛋白的磷酸化[15],因此推测BK可能通过激活CREB实现对肿瘤微血管内皮细胞紧密连接相关蛋白的转录调节。本研究发现BK能够引起肿瘤微血管内皮细胞p-CREB蛋白表达的上调,降低CREB蛋白的表达,二者最明显的变化均出现在BK作用15 min时,其变化时相与紧密连接相关蛋白occludin和ZO-1mRNA的变化时相相对应,提示BK可能通过CREB途径调节紧密连接相关蛋白mRNA的表达,进而开放紧密连接,增加血肿瘤屏障的通透性。
综上所述,我们的研究结果提示BK能够在转录水平上调节紧密连接相关蛋白occludin和ZO-1的表达,核转录因子CREB可能参与了该过程。
[1]Black KL,Ningaraj NS.Modulation of brain tumor capillaries for enhanced drug delivery selectively to brain tumor[J].Cancer Control,2004,11(3):165-173.
[2]Inamura T,Black KL.Bradykinin selectively opens blood-tumor barrier in experimental brain tumors [J].J Cereb Blood Flow Metab,1994,14(5):862-870.
[3]Hashizume K,Black KL.Increased endothelial vesicular transport correlates with increased blood-tumor barrier permeability induced by bradykinin and leukotriene C4 [J].J Neuropathol Exp Neurol,2002,61(8):725-735.
[4]Sanovich E,Bartus RT,Friden PM,et al.Pathway across blood-brain barrier opened by the bradykinin agonist,RMP-7 [J].Brain Res,1995,705(1-2):125-135.
[5]Liu LB,Xue YX,Liu YH,et al.Bradykinin increases blood-tumor barrier permeability by down-regulating the expression levels of ZO-1,occludin,and claudin-5 and rearranging actin cytoskeleton [J].J Neurosci Res,2008,86(5):1153-1168.
[6]Cruzalegui FH,Bading H.Calcium-regulated protein kinase cascades and their transcription factor targets[J].Cell Mol Life Sci,2000,57(3):402-410.
[7]Bernacki J,Dobrowolska A,Nierwińska K,et al.Physiology and pharmacological role of the blood-brain barrier[J].Pharmacol Rep,2008,60(5):600-622.
[8]BallabhP,BraunA,NedergaardM.Theblood-brainbarrier:an overview.Structure,regulation,andclinicalimplications[J].NeurobiolDis,2004(1),16:1-13.
[9]Fanning AS,Anderson JM.Zonula occludens-1 and-2 are cytosolic scaffolds that regulate the assembly of cellular junctions[J].Ann N Y Acad Sci,2009,1165:113-120.
[10]F觟ster C.Tight junctions and the modulation of barrier function in disease[J].Histochem Cell Biol,2008,130(1):55-70.
[11]Wong V,Gumbiner BM.A synthetic peptide corresponding to the extracellular domain of occludin perturbs the tight junction permeability barrier[J].J Cell Bio,1997,136(2):399-409.
[12]Kondoh M,Yoshida T,Kakutani H,et al.Targeting tight junction proteins-significance for drug development[J].Drug Discov Today,2008,13(3-4):180-186.
[13]Tanaka K.Alteration of second messengers during acute cerebral ischemia-adenylate cyclase,cyclic AMP-dependent protein kinase,and cyclic AMP response element binding protein[J].Prog Neurobiol,2001,65(2):173-207.
[14]Nie M,Pang L,Inoue H,et al.Transcriptional regulation of cyclooxygenase 2 by bradykinin and interleukin-1beta in human airway smooth muscle cells:involvement of different promoter elements,transcription factors,and histone h4 acetylation[J].Mol Cell Biol,2003,23(24):9233-9244.
[15]王振华,薛一雪,刘丽波,等.缓激肽诱导胶质瘤细胞内cAMP反应元件结合蛋白磷酸化的实验研究[J].中国药理学通报,2006,22(12):1444-1447.

