Smad 2/3和Smad 4在子宫内膜癌中的表达及其相关性
刘贵鹏,王东娇,李莹莹,张莹,张璐,刘宁
(1.中国医科大学 附属盛京医院妇产科,沈阳 110004;2.中国医科大学 附属第一医院临床流行病学教研室,沈阳 110001;3.辽阳市第三人民医院 妇产科,辽宁 辽阳 111000)
子宫内膜癌为女性生殖器三大恶性肿瘤之一,目前对子宫内膜癌的病因、发病机制仍不十分清楚,转化生长因子β(transforming growth factor-β,TGF-β)是一种重要的细胞因子,具有抑制细胞分裂和增殖的作用,大量证据表明肿瘤的发生和恶性细胞对TGF-β产生抵抗作用关系密切[1]。Smad蛋白家族是生长因子信号传递途径中从胞浆进入胞核的中转分子[2]。TGF-β/Smad通路与多种人类癌症、恶性肿瘤及其生物学行为有关。Smad2/3、Smad4均为Smad家族的主要成员,且二者作为肿瘤抑制基因,在TGF-β信号转导途径中发挥重要作用。许多研究表明,Smad2/3和Smad4在甲状腺癌、乳腺癌、胃癌等许多癌症中异常表达,在恶性肿瘤发生、发展过程中起重要作用。本研究检测了体外正常子宫内膜组织、非典型增生子宫内膜组织和子宫内膜癌组织中Smad2/3和Smad4蛋白的表达,比较3种组织中二者表达的差异,从而阐明二者在子宫内膜癌中的相关性。
1 材料与方法
1.1 标本来源
收集2007-2009年中国医科大学附属盛京医院经手术证实的子宫内膜癌标本42例,子宫内膜非典型增生标本20例。42例子宫内膜癌标本中腺癌标本33例,其他类型癌标本9例;按照FIGO标准行手术-病理分期:Ⅰ期14例,Ⅱ期12例,Ⅲ期10例,Ⅳ期6例;按WHO标准分级:G1期15例、G2期12例、G3期15例。20例子宫内膜非典型增生标本中轻度7例,中度6例,重度7例。选取同期因宫颈上皮内瘤变Ⅲ级、宫颈癌、附件肿瘤且未累及子宫而行手术切除的正常子宫内膜组织标本20例,其中分泌期和增生期各10例,作为对照组。全部标本均经病理科专家确诊。所有研究对象术前未行放、化疗或激素治疗,各组之间年龄无显著性差异(Kruskal-Wallis H 检验,P=0.100)。
1.2 实验方法
石蜡标本4 μm连续切片,采用免疫组化S-P法。Smad2/3和Smad4的浓度为1∶100,按S-P试剂盒(产品编号SP-0023)实验步骤操作,DAB染色试剂盒(产品编号C-0010)显色,苏木素复染,脱水,透明,封片。采用PBS代替一抗作空白对照,已知胃癌切片作为阳性对照。实验所需一抗为兔抗人Smad2/3和Smad4多克隆抗体,二抗免疫组化试剂盒、S-P试剂盒、DAB染色试剂盒均购自北京博奥森生物技术有限公司。
1.3 结果判断
根据细胞着色强度(A):无色为0分,浅黄为1分,棕黄为2分,棕褐为3分。根据显色细胞的比例(B):无显色细胞为0分,<10%为1分,10%~50%为2分,50%~75%为3分,≥75%为4分。A×B≤2分为(-),3分为阳性(+),4分为强阳性(++),5分及以上为强阳性(+++)。
1.4 统计学方法
组间比较应用SPSS 13.0统计软件中的χ2检验或SAS 8.2统计软件中的Fisher确切概率法,相关性用SPSS 13.0统计软件中的Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组Smad2/3和Smad4蛋白的表达情况
免疫组化染色结果显示,Smad2/3蛋白为棕黄色或橘黄色颗粒,存在于细胞胞质中(少数位于胞核中),Smad4蛋白为棕黄色或橘黄色颗粒,存在于细胞胞质或胞核中。Smad2/3在正常子宫内膜组织、非典型增生子宫内膜组织和子宫内膜癌中的表达阳性率分别为 85.0%、55.0%和 28.6%(χ2=17.676,P<0.01);Smad4在正常子宫内膜组织、非典型增生子宫内膜组织和子宫内膜癌中的表达阳性率分别为90.0%、70.0%和 31.0%(χ2=21.520,P< 0.01)。见图1,图 2。
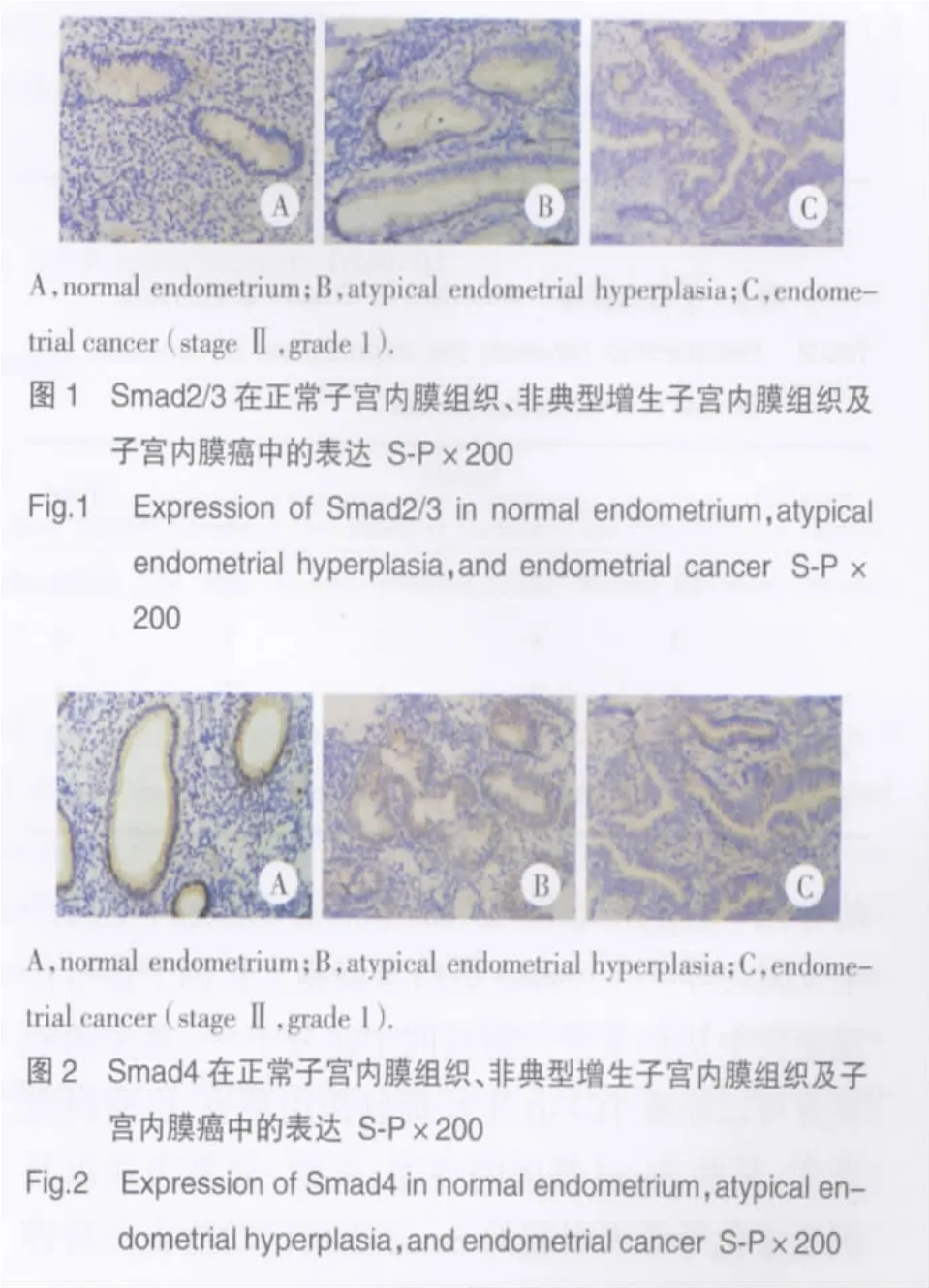
2.2 Smad2/3、Smad4蛋白的表达与子宫内膜癌手术-病理分期及组织学分级的关系
Smad2/3、Smad4的表达均与手术-病理分期无关 (χ2=1.540 0,P>0.05;χ2=0.757 6,P>0.05);Smad2/3的表达与组织学分级有关,随组织学分级的增加而表达减少(χ2=8.108 3,P< 0.05)。见表 1。
2.3 Smad2/3与Smad4蛋白表达的相关性
42例子宫内膜癌组织中Smad2/3与Smad4同时表达阳性者14例,同时表达阴性者21例,Smad2/3阴性而Smad4阳性表达者3例,表达一致率为83.3%,Spearman等级相关分析显示Smad2/3与Smad4表达呈正相关(r=0.671,P<0.01)。见表2。
3 讨论
TGF-β是一种重要的细胞因子,广泛参与细胞的分化、增殖、形态改变、黏附、转移、细胞外基质产生及凋亡等[3,4]。Smad蛋白家族是生长因子信号传递途径中从胞浆进入胞核的中转分子[2],其失活或突变可以导致TGF-β生长抑制作用消失,已有研究证实,某些Smad基因的突变、失活、异常表达以及因泛素化等原因引起的Smad蛋白的功能丧失与许多人类肿瘤的发生、发展有关[5~7]。

表1 Smad2/3、Smad4蛋白的表达与子宫内膜癌手术-病理分期的关系Tab.1 Correlation of the expressions of Smad2/3 and Smad4 with surgical-pathologial staging and histological grade in endometrialcancer

表2 子宫内膜癌中Smad2/3与Smad4表达的关系Tab.2 Relationship between the expressions of Smad2/3 and Smad4 in endometrialcancer
Smad家族成员分为3类[8]。第一类是R-Smad,即受体Smad,包括Smad1、Smad2/3、Smad5 和Smad8。Smad2/3由TGF-β激活素激活,特点是C端具有特征性丝氨酸序列,可被活化的TGF-βⅠ型受体磷酸化。第二类是Co-Smad,即Smad4,又称共同伙伴基因,是肿瘤抑制基因DPC4的产物,是不同TGF-β超家族成员信号传递必需的中心转导分子,亦是TGF-β信号系统中抗增殖反应和调节转录的重要分子,在肿瘤的灭活中起着关键的作用[9]。第三类是 I-Smad,即抑制 Smad,包括 Smad6和Smad7,对TGF-β信号转导起抑制作用。
在Samd家族中只有Smad2/3和Smad4的基因突变在人类肿瘤中被证实,而且已被确定为肿瘤抑制基因。本研究中,Smad2/3、Smad4在子宫内膜癌中的表达均较非典型增生及正常子宫内膜组织中明显减少。Smad2/3(R-Smad)的表达缺失,导致在TGF-β信号传导途径中活化的Ⅰ型受体失去激活的靶蛋白,信号传递中断,细胞可逃脱TGF-β的抑制作用。在低分化子宫内膜癌中,Smad2/3蛋白的表达较中分化、高分化癌明显减少,推测Smad2/3的表达缺失与癌组织的分化有一定的关系。Smad4蛋白控制着TGF-β信号通路,在子宫内膜组织中Smad4(Co-Smad)的突变及表达缺失使其不能与R-Smad形成复合物,不能进入细胞核,TGF-β信号传导中断,TGF-β对子宫内膜癌细胞的生长增殖抑制作用丧失,从而促进了子宫内膜癌的发生和发展。但Smad4蛋白在子宫内膜癌Ⅰ、Ⅱ、Ⅲ、Ⅳ期中及在低分化、中分化、高分化子宫内膜癌中的表达均未见明显差异,尚不能说明Smad4在已发生癌变的组织中继续参与子宫内膜癌的侵袭及演进。
本研究相关性分析结果显示,Smad2/3与Smad4在子宫内膜癌中的表达呈正相关,这与已知的二者的生物学特性相一致。首先从二者在染色体18q21.1上的位置关系而言,Smad2/3和Smad4紧密相连[10]。另外,Smad2/3 属于 R-Smad,Smad4 为 Co-Smad4,在TGF-β信号传导时,R-Smad蛋白被活化的Ⅰ型受体激活后,与Co-Smad蛋白形成复合体,一并转入细胞核,复合体在细胞核中指导目的基因的转录,通过与核转录调节因子及靶基因启动子的结合,达到调节细胞生长的作用。二者缺失,导致信号传递中断,使细胞逃脱TGF-β的抑制作用。
本研究结果进一步证明了Smad2/3和Smad4的基因突变与子宫内膜癌的发生、发展关系密切,且二者作为癌基因可能协同发挥作用。联合检测Smad2/3和Smad4蛋白在子宫内膜癌变时的异常表达及二者之间的内在关系,有助于从基因调控及蛋白表达水平认识子宫内膜癌及增殖性病变的病理机制、进一步寻找靶向治疗方法。
[1]Pennison M,Pasche B.Targeting transformiting growth factor-beta signaling[J].Curr Opin Oncol,2007,199(6):579-585.
[2]Derynck R,Zhang YE.Smad-dependent and Smad-independent pathways in TGF-β family signalling[J].Nature,2003,425(6958):577-584.
[3]Kohei M,Hiroyuki S,Takeshi M,et al.Imamura regulation of TGF-β signaling and its roles in progression of tumor[J].Cancer,2003,94(3):230-234.
[4]Yamamura Y,Hua X,Bergelson S,et al.Critical role of Smads and AP-1 complex intransforming growth factor-beta-dependent apoptosis[J].J Bol Chem,2000,275(46):36295-36302.
[5]Maliekal TT,Antony ML,Nair A,et al.Loss of expression,and mutation of Smad2 and Smad4 in human cervical cancer[J].Oncogene,2003,22(31):4889-4897.
[6]Piestrzeniewicz Ulanska D,Brys M,Semczuk A,et al.Expression and intracellular localization of Smad proteins in human endometrial cancer[J].Oncol Rep,2003,10(5):1539-1544.
[7]Nicolas FJ,Hill CS.Attenuation of the TGF-beta-Smad signaling pathway in pancreatic tumor cells confers resistance to TGF-betainduced growth arrest[J].Oncogene,2003,22(24):3698-3711.
[8]Massague J.How cells read TGF-beta signals[J].Nat Rev Mol Cell Biol,2000,1(3):169-178.
[9]Chen W,FU X,Sheng Z.Review of current progress in the structure and function of Smad proteins[J].Chin Med J(Eng1),2002,115(3):446-450.
[10]Toda T,Oku H,Khaskhely NM,et al.Analysis of microsatelliteinstability and loss of heterozygosity in uterine endometrial adenocarcinoma[J].Cancer Genet Cytogenet,2001,126(2):120-127.

