耐力训练对生长期大鼠血清OPG、sRANKL及骨代谢生化因子、骨量的影响
何淑敏 陈明
温州大学体育学院(浙江温州 325035)
OPG/RANKL/RANK系统是新近发现的调节破骨细胞分化的重要信号传导通路[1-3]。破骨细胞分化因子RANKL(receptor activator of nuclear factor κB ligand)是由成骨细胞和骨髓基质细胞分泌的核因子-κB受体活化因子配体,它与破骨细胞的RANK(receptor activator of nuclear factorκB)结合,促进破骨细胞分化、成熟,提高其活性。RANKL的作用被认为是拮抗骨细胞分泌的另一因子—护骨素(osteoprotegerin,OPG)。OPG/RANKL/RANK系统的作用机制是:成骨细胞及骨髓基质细胞表达RANKL,与破骨细胞前体细胞或破骨细胞表面上的RANK结合后,促进破骨细胞分化和激活。成骨细胞及骨髓基质细胞则分泌OPG与RANKL竞争性结合,阻止RANKL与RANK结合,从而抑制破骨细胞活性。许多激素和因子通过影响OPG和RANKL的表达来影响骨代谢。在运动促进骨骼生长发育中,OPG/RANKL/RANK系统可能在其中起到重要的作用。已有文献[4]认为适宜运动可以维持良好的钙代谢平衡,提高钙调节激素的分泌,促进钙的吸收和沉积,但目前尚无从OPG/RANKL/RANK系统角度阐明运动促进骨密度、骨量增长机制的研究。本研究从OPG/RANKL/RANK系统变化角度探讨耐力运动对生长期大鼠骨代谢、骨密度和骨量影响的可能机制。
1 材料和方法
1.1 实验动物
选用20只3周健康雌性大鼠,由上海中国科学院实验动物有限公司提供。以国家标准啮齿类动物饲料饲养,自由饮食,室温23±2℃,相对湿度55±5%,光照时间每天12小时,维持正常的24小时昼夜节律。经过3周喂养和对环境的适应,大鼠达到6周龄,然后随机分组实验。
1.2 运动方案
20只6周龄大鼠称重后随机分成2组:对照组(Sed group)10只,不参加运动训练,正常饮食及生活;②12周训练组(Ex group)10只,进行12周跑台训练,每天1次,坡度为 0,第 1周 8m/min×10min,第 2周 15m/min×45min,第3周及以后25m/min×60min。本实验模拟田径运动中的有氧耐力跑形式。采用段氏PT98型鼠类跑台进行训练。
1.3 测试指标及检测方法
1.3.1 血液标本的制备和检测
12周实验后,运动组停训24小时,所有大鼠于安静状态下称重后迅速断头取血,注入预冷的1%肝素塑料试管内,混匀,低温离心(3000r/min)10~15分钟,取上清液置于-70°冰箱中待测血清维生素D3(VD3)、骨钙素(OC)、骨碱性磷酸酶(ALP)、抗酒石酸酸性磷酸酶(TRAP)及 OPG和(可溶性)sRANKL。OPG和 sRANKL采用酶联免疫法测定(由上海西唐生物科技有限公司提供试剂盒),OPG组内、组间差异分别是3~5%和6~9%,sRANKL组内、组间差异分别是4~10%和7~8%。血清OC、ALP、TRAP采用酶联免疫法测定(试剂盒由上海沪尚生物科技有限公司提供),OC组内、组间误差分别是8%和5%;ALP组内、组间误差分别是5.2%和5.8%;TRAP组内、组间误差分别是5.7%和2.7%。维生素D由酶联免疫法测定(英国IDS Ltd试剂盒),组内、组间误差分别是4.6%和5.3%。
1.3.2 骨骼标本的制备和检测
动物断头后,取大鼠右侧股骨、胫骨和第5腰椎,去除软组织。测量3次股骨长度,取平均值。采用双能X线骨密度仪(DEXA)(Madison,W I,USA)测定胫骨和腰椎骨密度(BMD)和骨量(BMC)。胫骨测定骨密度(BMD)和骨量(BMC)位置为中间部位。DEXA测定有效范围是:胫骨宽15毫米、长50毫米;第5腰椎宽15毫米,长20毫米。骨密度和骨量测量误差小于2%。
1.4 统计学分析
采用 SAS 8.1(SAS Institute Inc.,Cary,NC,USA)统计软件进行数据分析处理,数据以平均值和标准差表示,采用配对t检验对运动组与对照组相关指标之间差异的显著性进行检验,P<0.05为有显著性差异。
2 结果
2.1 体重、股骨长度、胫骨和腰椎BMD、BMC
表1显示,两组大鼠实验前基础体重无显著性差异。经过12周运动训练,两组体重也无显著差异。但运动组股骨显著长于对照组(P<0.05)。而运动组大鼠胫骨BMC明显高于对照组(P<0.01),BMD两组无显著性差异;同样,运动组大鼠腰椎BMC显著高于对照组(P<0.05),BMD两组无显著性差异。

表1 两组大鼠体重、胫骨和腰椎BMD、BMC比较
2.2 血清OPG/sRANKL、维生素D及骨代谢生化标记物
表2显示,运动组大鼠血清OPG水平明显高于对照组(P<0.05),而 sRANKL明显低于对照组(P<0.01)。运动组 OC(P<0.05)和 ALP(P<0.05)明显高于对照组,而TRAP显著低于对照组(P<0.05)。运动组血清维生素D也显著高于对照组(P<0.05)。
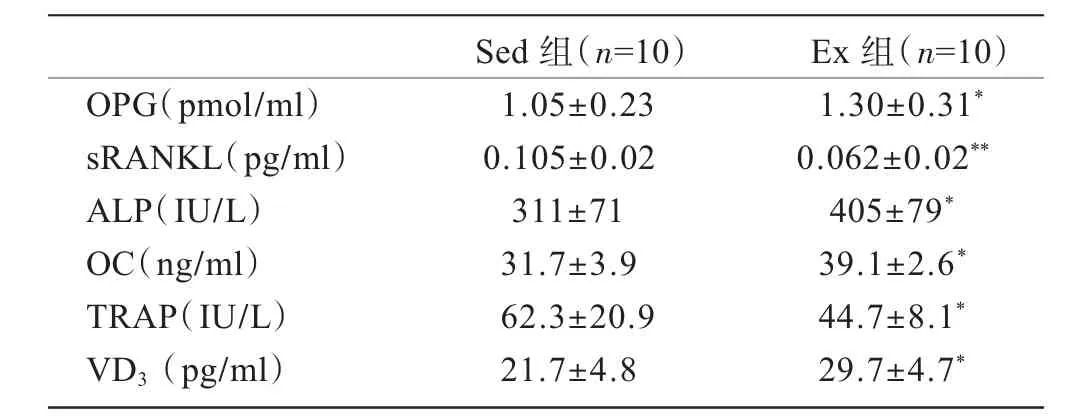
表2 两组大鼠血清骨代谢生化标记物、骨代谢调节因子比较
3 讨论
本实验结果显示,12周实验后,与对照组比较,运动组大鼠血清OPG升高而sRANKL下降,反映合成代谢指标OC、ALP升高而分解代谢指标TRAP降低;与此相应,运动组大鼠有更高的胫骨、腰椎骨量,提示OPG/RANKL系统的变化可能是运动促进生长期大鼠骨量增加的一个重要因素。有文献报道OPG/RANKL系统是最重要的调节骨代谢的分子机制[1-3]。本研究结果表明:中等强度耐力运动使大鼠循环血OPG含量升高,sRANKL水平下降。这种变化可能是导致运动组大鼠骨量高于对照组的一个重要原因,其可能机制是:OPG升高和sRANKL下降都会导致sRANKL与破骨细胞膜上RANK受体结合的数量减少。由于RANKL-RANK配体受体结合是促进破骨细胞分化成熟的重要机制[1-3],因此它们结合减少会导致破骨细胞分化、成熟受到抑制,破骨细胞数量下降,这样成骨细胞和破骨细胞之间的动态平衡向成骨方向倾斜,结果是骨形成大于骨吸收,骨量增加。这在本实验结果中也得到证实:运动组大鼠腰椎、颈骨骨量更高,而且反映骨吸收的代谢因子TRAP也比对照组低,反映骨合成的代谢指标OC和ALP却高于对照组,这表明破骨细胞活性下降而成骨细胞活性增加,与OPG和sRANKL变化对骨组织的调节作用结果一致。Ziegler[5]报道耐力运动员循环血OPG水平升高,而sRANKL水平下降。这与本研究结果一致,但他们的实验仅单独测定OPG和sRANKL变化,未测定骨量、骨密度和骨代谢因子。miyazaki等[6]报道卵巢切除大鼠RNAKL水平显著增加,骨吸收过程非常活跃,指出RANKL是调节骨组织吸收过程的主要因素。因此,运动导致OPG升高和sRANKL下降可能是耐力运动促进大鼠骨量增加的重要原因。
那么,运动如何改变OPG和RANKL分泌呢?机械力刺激是调节OPG、RANKL变化的一个重要因素。刘丽等[7]的研究表明,骨骼在机械力作用下,RANKL mRNA表达减少34.4%,而OPG mRNA表达增加73%,表明生理性应力作用显著影响大鼠骨细胞OPG和RANKL mRNA表达,提示对骨骼的机械力作用能减少骨组织吸收、促进骨组织形成。其它文献也证明OPG/RANKL比例增加主要是运动本身对骨组织机械力作用的结果,以及间接通过改变激素分泌而影响OPG/RANKL比例[8]。
破骨细胞和成骨细胞在代谢过程中产生许多代谢因子,监测其变化可以反映骨组织代谢平衡情况[9,10]。本实验结果表明,运动组血清OC、ALP升高,而TRAP下降。这说明运动组大鼠成骨细胞活性增强而破骨细胞活性减弱,成骨作用大于骨吸收作用,导致骨量增加。这在实验中也得到证明,运动组大鼠有更多的骨量。其它文献也表明运动通过改变骨代谢过程而影响骨骼的生长发育[9,11]。本实验结果表明耐力运动大鼠胫骨、腰椎骨量明显比对照组增加,而BMD却无显著性差异。有文献报道耐力运动对骨密度和骨量产生重要影响[10],而本研究只发现骨量增加。分析原因,我们的研究对象是生长期大鼠,快速生长期大鼠骨骼体积迅速增加,而矿物质积累明显滞后,因此这个时期骨密度增长不明显。而骨量由骨骼体积增长和矿物质增加两方面决定,因此,即使矿物质增加不明显而骨骼体积增加也会导致骨量增长,这也能从运动组股骨长度比对照组更长的结果得到证实。因此,耐力运动通过刺激骨骼体积增长而促进骨量增加。Iwamoto[4]也报道运动通过影响骨代谢变化而促进骨量增长,并认为这种良性变化是钙的良性平衡结果,与调节钙代谢的激素相关。本实验结果也表明,运动组血清维生素D明显高于对照组,故运动也通过影响激素分泌促进骨量增长。因此,运动通过本身对骨组织的机械力作用和影响激素分泌而起到促进骨骼生长发育的作用。
4 总结
运动导致OPG/sRANKL比例增加可能是耐力运动促进生长期大鼠骨量增加的重要因素,其可能机制是:运动对骨组织产生的机械力刺激导致OPG/sRANKL比率升高,而抑制破骨细胞活性,骨合成增加、吸收减少,腰椎、股骨骨量增加。
[1] Ominsky MS,Li X,Asuncion FJ,et al.RANKL inhibition w ith osteoprotegerin increases bone strength by improving cortical and trabecular bone architecture in ovariectomized rats.JBone miner Res,2008,23(5):672-82.
[2]姚静,侯加法.OPG/RANKL/RANK系统的研究进展.动物医学进展,2006,27(2):5-9.
[3]刘继中,纪宗玲,陈苏民.OPG/RANKL/RANK系统与骨破坏性疾病.生物工程学报,2003,19(6):654-660.
[4] Iwamoto J,Shimamura C,Takeda T,et al.Ef fects of treadmill exercise on bonemass,bonemetabolism,and calciotropic hormones in young grow ing rats.J Bone miner Metab,2004,22(1):26-31.
[5] Ziegler S,Niessner A,Richter B,et al.Endurance running acutely raises plasma osteoprotegerin and lowers plasma receptor activator of nuclear factor κB ligand.Metabolism,2005,54:935-938.
[6] miyazaki T,Matsunaga T,miyazaki S,et al.Changes in receptor activator of nuclear factor-kappaB,and its ligand,os teoprotegerin,bone-type alkaline phosphatase,and tartrateresistant acid phosphatase in ovariectomized rats.J Cell Biochem,2004,93:503-512.
[7]刘丽,张晓聪,郑茜聪,等.机械应力影响鼠骨髓基质细胞骨保护素/NF-kB受体活化剂配体mRNA表达变化.细胞生物学杂志,2006,(5):747-751.
[8] Verborgt O,Tatton NA,Majeska RJ,et al.Spatial distribution of Bax and Bcl-2 in osteocyes after bone fatigue:complementary roles in bone remodeling regulation.J Bone miner Res,2002,17(5):907-714.
[9] IkiM,Morita A,Ikeda Y,et al.Biochemicalmarkers of bone turnover may predict progression to osteoporosis in osteopenic women:the JPOS Cohort Study.J Bone miner Metab,2007,25(2):122-9.
[10]赵仁清.青春期女孩骨代谢生化标志物的变化特点及雌激素的调节作用.体育科研,2008,29(3):94-96.
[11] Jurimae J,Purge P,Jurimae T,et al.Bone metabolismin elite male rowers:adaptation to volume-extended training.Eur JAppl Physiol,2006,97(1):127-32.

