猪附红细胞体PCR与光镜检测方法的比较研究
谢建中
附红细胞体病是由附红细胞体寄生在人或多种动物红细胞表面、血浆和骨髓而引起的一种人兽共患病,Doyle首次在印度发现猪附红细胞体并归入立克次氏体[1],但近年根据16S rRNA基因序列分析将其归为支原体属(Mycoplasma)[2-3],2002年Nemark等[4]将该病原体更名为 Mycoplasma suis(M.suis),现分类作为支原体属的单个新种,近年来该病在全国呈暴发流行趋势,引起广大医学和畜牧工作者的注意。
目前临床上对该病的诊断尤为重视,本研究对鲜血压片、姬姆萨染色、吖啶橙染色以及PCR法4种诊断方法进行临床比较,以期找到更为科学准确的诊断手段。
1 材料和方法
1.1 待测血样
血样来源于兽医门诊具有猪附红细胞体病临床症状的疑似病例猪体。
1.2 鲜血压片和姬姆萨染色
鲜血压片检查以血浆中和红细胞表面见到多形淡绿色小体为阳性。姬姆萨染色采用改进方法,包括血液推片,火焰固定,加温染色0.5 min,自然染色5 min,以油镜观察红细胞上出现青紫色小体为阳性。
1.3 吖啶橙染色
具体染色方法是将涂有标本的涂片用95%乙醇固定标本15~30 min,用滤纸吸去载玻片上的残液,用1%醋酸酸化30 s,用 PBS清洗 1 min,加 0.01%吖啶橙染液染色1~5 min,用 PBS清洗1 min,加0.1mol/l CaCl2分化30 s~2 min,用PBS清洗3次,每次数秒,荧光显微镜观察,以红细胞边缘上出现淡绿色荧光为阳性。
1.4 猪附红细胞体DNA基因提取
取400 μlACD抗凝血加入1.5 mlEP管中,加入200 μl裂解液(100 mmol Tris,10.0 mmol EDTA,1.0 mol NaCl,pH 值 7.4),再加入 8 μl蛋白酶 K(20mg/ml)和100 μl 10%SDS溶液56℃水浴3 h。于100℃ 10 min灭活蛋白酶K,加入等体积的苯酚:氯仿:异戊醇(25: 24: 1)抽提两次,4℃离心15 000 g 10 min。加入等体积的氯仿:异戊醇(24:1)抽提1次,4℃离心15 000 g 10 min。取上清液加入两倍体积的无水乙醇和1/10体积的2 mol/l的NaAc,-70℃沉淀30 min,4℃离心15 000 g 30 min。用70%的无水乙醇漂洗1次,自然干燥,用30 μl的ddH2O溶解,-20℃保存备用。
1.5 引物设计与合成
根据Genbank中的猪附红细胞体新基因组序列(AJ504999),利用Primer5.0设计1对特异性引物:
F1 5'CAGCGGTGAGAAAGCAAG 3'
F2 5'CTGGGTGTATGAAGAGTGGTGT 3'。
引物由上海生工生物工程技术有限公司合成,扩增的目的片段为603 bp。
1.6 PCR反应体系及反应程序
对样本DNA用上述引物在TECHNE,TC 512基因扩增仪上进行PCR扩增。50 μl反应体系如下:DNA Taq聚合酶1.25 U,10×PCR Buffer(Mg2+Free)5 μl,dNTP Mixture(各 2.5 mmol/l)4 μl,MgCl2(25 mmol/l)2.5 μl,模板 DNA 2 μl,引物(20 μmol/l)各 1 μl,加灭菌蒸馏水至50 μl。反应程序如下:预变性95℃5 min;(变性94℃ 50 s,退火56℃ 50 s,延伸 72℃ 50 s)×35个循环;终末延伸72℃10 min。
1.7 特异性试验
用F1和F2为引物,以多杀性巴氏杆菌、猪链球菌、弓形虫、牛巴贝斯虫、猪圆环病毒的基因组、血液基因组DNA作为特异性试验的模板进行PCR扩增。
1.8 敏感性试验
提取猪附红细胞体血液基因组DNA,测定其OD260nm值,并进行10倍稀释,用F1和F2为引物进行扩增,确定PCR方法敏感性。
1.9 临床样本检测试验
对临床20例疑似病例分别利用鲜血压片、姬姆萨染色、吖啶橙染液染色和PCR方法检测,确定阳性检出率。
2 结果
2.1 PCR特异性反应试验结果(见图1)

图1 特异性试验结果
结果表明,只有猪附红细胞体扩增出特异性条带,其他病原体未见条带。
2.2 PCR反应敏感性试验结果
试验结果表明,能检测到的血液基因组DNA最高敏感度为0.65 ng。
2.3 20例临床样品的检测结果(见图2)
鲜血压片、姬姆萨染色、吖啶橙染色及PCR检出率分别为20%、35%、50%、70%,PCR扩增结果如图2。
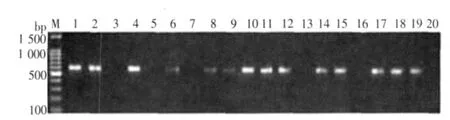
图2 临床样品检测结果
3 讨论
从试验检测结果可以看出,PCR方法(70%))的检出率最高,而吖啶橙染色(50%)、姬姆萨染色(35%)和鲜血压片(20%)的阳性检出率较低,有力的证实了PCR方法比其他诊断方法在检测猪附红细胞体方面更加科学准确。
本试验研究表明,从临床症状疑似的病例PCR诊断结果并不一定是猪附红细胞体病,因此,凭借临床症状诊断存在较大缺陷,另外光镜检查存在假阳性率较高,许多原因造成红细胞变形,如染色剂附着在红细胞上,贫血会造成棘形、锯齿形红细胞增多,尤其当红细胞表面附红细胞体数量少,或由于贫血等原因而导致血片中有大量的变形红细胞和红细胞碎片时,很难与红细胞中出现的一些嗜碱性物质,如帕彭海姆体(Pappenheimer bodies)、海因茨体(Heinz bodies)和豪厄尔一若利小体(Howell-Jolly bodies)相区别[5],影响了检测结果,PCR技术具有快速、灵敏、特异性强等一系列优点,它能大量扩增低拷贝甚至单拷贝基因序列,很容易被琼脂糖凝胶电泳检测[6],许多轻微差别的疾病诊断也可通过PCR方法在短时间内得到结论,本试验基于血液基因组设计引物建立的PCR诊断方法有较高诊断特异性,DNA最低检测量为0.65 ng,同时可以和其他相关的猪病原体进行区别诊断,保证了检测结果的准确性,凭借PCR诊断方法的自身优势可以成为临床诊断猪附红细胞体病的一种必要手段,值得在临床上推广应用。
[1]Doyle L P.A rickettsia-like or anaplasmosis-like disease in swine[J].J.Am.Vet.Med.Ass.,1932(8):668-671.
[2]Neimark H,Johansson K E,Rikihisa Y,et al.Proposal to transfer some members of the genera Haemobartonella and Eperythrozoon to the genus Mycoplasma with descriptions of'Candidatus Mycoplasma haemofelis','Candidatus Mycoplasma haemomuris''Candidatus Mycoplasma haemosuis'and'Candidatus Mycoplasma wenyonii'[J].Int.J.Syst.Evol.Microbiol.,2001,51(3):891-899.
[3]Messick JB,WalkerP G,RaphaelW,etal.'Candidatus Mycoplasma haemodidelphidis′sp.nov., 'Can- didatus Mycoplasma haemolamae′sp.nov.and Mycop lasma haemocanis comb.nov.,haemotrophic parasites from a naturally infected opossum (Didelphis virginiana),alpaca (Lama pacos)and dog(Canis familiaris) : phylogenetic and secondary structural relatedness of their 16S rRNA gene to other mycoplasmas[J].Int.J.Syst.Evol.Microbiol.,2002,52:693-698.
[4]Neimark H,K.E.Johansson,Y.Rikihisa,et al.Revision of haemotrophic Mycoplasma species names[J].Int.J.Syst.Evol.Microbiol.,2002,52:683.
[5]Messiek J B,Smith G,Berent L,et al.Genome size of Eperythrozoon suis and Hybridization with 16S rRNA gene[J].Can.J.M.icrobiol.,2000,46:1082-1086.
[6]Hoelzle L E,Adelt D,Hoelzle K,et al.Development of a diagnostic PCR assay based on novel DNA sequences for the detection of Mycoplasma suis(Eperythrozoon suis)in porcine blood[J].Vet Microbiol.,2003,93(3):185-196.

