143例胃肠道间质瘤的外科诊治及预后分析
刘鹏,郑志魁,戚峰,刘彤
论著
143例胃肠道间质瘤的外科诊治及预后分析
刘鹏,郑志魁,戚峰,刘彤
目的:探讨胃肠道间质瘤的临床病理特征及外科诊治情况,分析影响预后相关因素。方法:回顾性分析经手术治疗的143例患者的临床资料。结果:发生于胃42.7%,小肠35.0%,腹痛不适44.1%,消化道出血或贫血28.0%。131例手术完整切除,免疫组化表型CD117阳性率为98.5%。中位生存时间为64.0个月,1、3、5年生存率分别为89.7%,72.4%和53.4%。手术切除的完整性和危险程度分级是影响预后的独立因素(P<0.05)。结论:胃肠道间质瘤术前确诊率较低,手术完整切除是主要治疗手段,伊马替尼治疗晚期患者有一定疗效。影响患者预后的独立因素是肿瘤危险程度分级、手术切除的完整性和伊马替尼治疗。
胃肠道间质瘤;诊断;外科治疗;免疫组织化学;伊马替尼;预后因素
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是独立起源于胃肠道间质干细胞的肿瘤,其年发病率为1/10万~2/10万[1-2],近10年来随着对其发病机制和临床病理特点的深入研究,GIST的诊治水平有了很大的提高。我们根据天津医科大学总医院2000年1月—2008年10月收治的143例患者的临床资料,回顾性分析了本病的临床病理特点、诊治效果及预后影响因素。
1 资料与方法
1.1 一般资料143例患者中男79例,女64例;年龄20~81岁,平均年龄(48.0±5.3)岁。平均住院时间21 d。均接受手术治疗。术前无伊马替尼等药物使用史。
1.2 研究方法收集患者的病历资料,分析GIST患者的年份分布、临床病理特点、影响预后的相关因素等,其中参照Fletcher等[3]推荐的标准以肿瘤大小和核分裂数来判定恶性程度:GIST直径<2 cm,核分裂数<5个/50 HPF,为极低危;直径2~5 cm,核分裂数<5个/50 HPF,为低危;直径<5 cm,核分裂数6~10个/50 HPF,或直径5~10 cm,核分裂数<5个/50 HPF,为中危;直径>5cm,核分裂数>5个/50 HPF,或仅直径>10 cm,或核分裂数>10个/50 HPF,为高危。随访方式包括定期复查、电话随访等。生存期按自确诊之日至末次随访日或死亡时间计算。
1.3 统计学方法采用SPSS 16.0统计软件包进行数据处理,Kaplan-Meier乘积极限法计算生存率,单因素分析应用log-rank检验,多因素分析应用Cox比例风险回归模型。P<0.05认为差异具有统计学意义。
2 结果
2.1 病例年份分布特点GIST例数呈逐年上升趋势,其中体积较小(<5 cm)者所占比例逐年增加,体积较大(>5 cm)例数基本持平(图1)。

图1 143例GIST患者年份分布
2.2 临床表现与发生部位本组143例患者中临床首发症状主要为腹痛不适44.1%(63例)、消化道出血18.2%(26例)或贫血9.8%(14例);无临床症状10.5%(15例),其中以小肠患者无症状率最高(14.0%)。详见表1。GIST位于胃61例(42.7%)、十二指肠11例(7.7%)、小肠50例(35.0%)、结直肠13例(9.1%)、其他部位8例(5.2%)。

表1 GIST的首发临床表现与发生部位(n=143)
2.3 辅助检查和术前诊断119例术前行内镜检查,其中胃镜89例、小肠镜38例和结肠镜17例。106例表现为黏膜下肿瘤。103例行超声内镜检查,提示肿瘤起源于固有肌层。术前仅6例获得活检病理确诊。114例行螺旋CT检查,101例确定肿瘤位置。4例行MRI检查发现2例肝转移灶,1例腹膜转移灶。23例贫血。92例(64.3%)术前临床诊断为GIST。
2.4 治疗方式按组织病理学检查距瘤体边缘1 cm或大于1 cm的范围内瘤细胞阴性,定义为完整切除。143例手术患者中131例完整切除,12例未完整切除(姑息性切除术8例,短路手术4例)。完整切除术后复发/转移32例。13例接受了伊马替尼治疗,其中包括4例未完整切除及9例完整切除术后复发/转移患者;具有服药适应证而未服药31例,失访2例。
2.5 病理及免疫组化特点143例患者均经病理检查确诊为GIST,其中139例切除标本中肿瘤直径最小0.5~19 cm,平均(5.2±1.1)cm。肿瘤镜下表现为梭形细胞型112例(78.3%)、上皮样细胞型21例(14.7%)、多形性细胞型10例(7.0%)3种基本细胞类型;极低危组23例、低危组52例、中危组21例、高危组43例。免疫组化CD117(酪氨酸激酶因子受体)阳性140例(98.0%),CD34(骨髓干/祖细胞抗原)阳性98例(68.5%)。
2.6 随访随访截止时间为2009年12月,有效随访137例,随访时间14~117个月,死亡59例。中位生存期64.0个月,1、3和5年的总生存率分别为89.7%,72.4%,53.4%,总体生存曲线见图2。
2.7 影响预后的因素单因素分析结果显示,年龄、肿瘤部位、危险程度分级、肿瘤直径大小、核分裂计数、手术切除的完整性、伊马替尼治疗是影响预后的因素。多因素分析显示,危险程度分级、手术切除的完整性是影响预后的独立因素。见表2。手术切除完整性、危险程度分级及伊马替尼治疗的生存曲线见图3、图4、图5。

表2 相关因素对59例死亡患者预后的影响
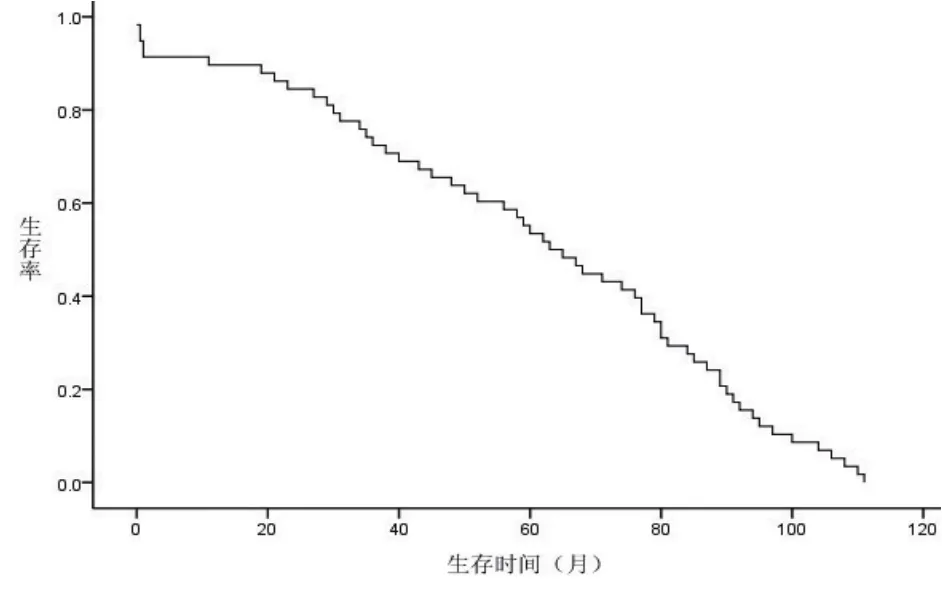
图2 59例死亡患者生存曲线
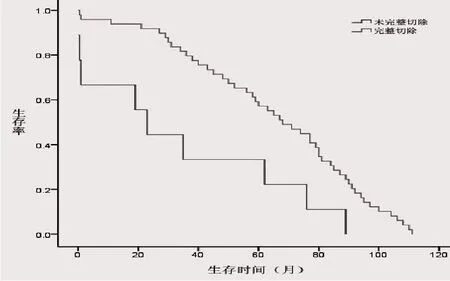
图3 59例死亡患者2种术式生存曲线

图4 59例死亡患者4种危险程度生存曲线

图5 伊马替尼治疗的生存曲线
3 讨论
GIST起源于胃肠壁Cajal细胞或与Cajal细胞同源的间叶干细胞,好发于胃(40%~60%)和小肠(30%~40%)[4-5],本组发生在胃者占44.1%,小肠者33.2%,与文献报道一致。本组GIST手术治疗病例数呈逐年上升趋势,体积较小(<5 cm)的所占比例逐年增加,这可能与人们对GIST的诊治水平不断提高有关。
GIST的诊断主要靠免疫组化CD117检查。近年来临床研究发现,80%~85%的GIST存在c-kit基因突变蛋白CD117的表达[6]。本组中CD117阳性率为98.5%。GIST术前诊断较困难,一是临床表现缺乏特异性,二是术前辅助检查对GIST的诊断大多无定性价值。本组调查中,腹痛不适、消化道出血及贫血症无一具有诊断的特异性。内镜下活检不易获取肿瘤组织,本组术前仅6例确诊。CT仅能定位并显示瘤体与周围组织结构的关系。
国外学者认为,所有GIST均具有潜在恶性[5],因此应尽早进行治疗。但GIST对化疗、放疗均不敏感,所以现有治疗方法主要是手术切除[7]。Haluk[8]认为,切缘距瘤体1 mm以上无肿瘤细胞残存为完整切除。本组将距瘤体边缘1 cm或大于1 cm的范围内瘤细胞阴性视为完整切除。GIST以腹膜及肝转移为主,极少发生淋巴结转移,所以手术不需要行根治性淋巴结清扫[9]。GIST术后常复发转移,即使首次完整切除肿瘤,术后仍有50%左右的复发转移率[10]。因此所有的GIST患者都应长期随访。本组完整切除术后复发及转移者32例,平均复发/转移时间17个月,9例行二次手术完全整切除。但有文献[11]报道再次手术并不提高生存率。
伊马替尼的应用开辟了GIST治疗的新领域。本组有13例患者应用,均为无法再次手术治疗的晚期患者,生存期12~61个月,中位生存期49.0个月,显著高于29例未应用伊马替尼的晚期患者(P< 0.05)。本组2例出现眼睑周围水肿,症状较轻,未给予处理。Jason等[12]认为:用伊马替尼治疗约两年后,Kit基因外显子11序列的突变,会造成大部分患者会产生药效抵抗,从而降低伊马替尼的治疗效果。由于本组应用伊马替尼例数较少,并未进行相应的实验室研究及疗效的评估。
近年来相关研究对于GIST患者的预后影响因素已逐渐明确,已有相当数量的文献报道,肿瘤部位、危险程度分级、肿瘤大小、核分裂计数、手术切除的完整性是影响预后的因素。本组对死亡患者的调查中,对于肿瘤位置分析,25例胃间质瘤患者的1、3、5年存活率为92.0%、68.0%、56.0%,20例小肠间质瘤患者为85.0%、65.0%、50.0%。单因素生存分析显示,不同部位间质瘤的存活率差异有统计学意义。年龄(60岁为临界)作为本组单因素分析中的预后因素(P<0.05),可能与本组年龄大的患者手术耐受力差且合并心血管等重要脏器疾病较多的原因有关。单因素分析,完整切除组与未完整切除组的中位生存时间分别为69.0个月和23.0个月,差异具有统计学意义(P<0.001)。并且多因素生存分析显示,手术切除完整与否是独立的预后因素。危险程度分级也作为本组独立的预后因素。极低危组、低危组、中危组及高危组的5年存活率分别为75.0%、61.9%、50.0%和36.8%,差异具有统计学意义(P< 0.001)。国外文献[13]报道,P16基因的阳性表达在高危组和复发转移组提示更差的预后。本组逐步回归结果显示,最终对GIST患者生存率有影响的因素是手术切除的完整性和肿瘤的危险程度分级,从相对危险程度的符号与大小来看,与完整手术切除相比,未完整手术切除患者术后死亡风险将增大到3.257倍;未应用伊马替尼治疗患者术后死亡风险将增大到3.941倍。患者危险程度分级每大一级,术后死亡风险将增大到1.631倍。本组研究提示,完整手术切除可能延长GIST患者的手术后生存期;危险程度分级低和应用伊马替尼的患者预后要分别优于危险程度高和未用伊马替尼的患者。
[1]Kindblom LG,Meis-Kindblom JM,Bumming P,et al.Inci⁃dence,prevalence,pheotype and biologic spectrum of gastrointesti⁃nal stromal cell tumors(GIST)-a population-based study of 600 cases[J].Ann Oncol 2002,13(15):157.
[2]Jason S.Gold,Ronald P,DeMatteo.Combined surgical and mo⁃lecular therapy the gastrointestinal stromal tumor model[J].Ann Surg,2006,244(2):176.
[3]Fletcher CD,Berman JJ,Corless C,et al.Diagnosis of gastroin⁃testinal stromal tumors:a consensus approach[J].Hum Pathol,2002,33(5):459.
[4]Joensuu H.Gastrointestinal stromal tumor(GIST)[J].Ann Oncol,2006,17(Suppl 10):280.
[5]Bengt Nilsson,Per Bümming,Jeanne M.Meis-Kindblom.et al. Gastrointestinal stromal tumors:the incidence,prevalence,clinical course,and prognostication in the preimatinib mesylate era——a population-based study in western Sweden[J].Cancer,2005,103 (4):821.
[6]Kitamura Y,Hirota S.Kit as a human oncogenic tyrosine kinase[J]. Cell Mol Life Sci,2004,61(23):2924.
[7]Joensun H,Kindblom L G.Gastrointestinal stromal tumors review [J].Acta Orthop Scand,2004,75(311):62.
[8]Haluk R.Unalp,Hayrullah Derici,Erdinc Kamer,et al.Gastrointes⁃tinal stromal tumours:outcomes of surgical management and analy⁃sis of prognostic variables[J].Can J Surg,2009,52(1):31.
[9]Fujimoto Y,Nakanishi Y,Yoshimura K,et al.Clinicopathologic study of primary malignant gastrointestinal stromal tumor of the stomach,with special reference to prognostic factors:analysis of re⁃sults in 140 surgically resected patients[J].Gastric Cancer,2003, 6(1):39.
[10]LI Jincheng,LI Shizheng.Clinical diagnosis of gastrointestinal stro⁃mal tumor[J].China Journal of Modern Medicine,2009,19(14): 2221.
[11]Rossi CR,Mocellin S,Mencarelli R,et al.Gastrointestinal stromal tumors:from a surgical to a molecular approach[J].Int J Cancer, 2003,107(2):171.
[12]Jason S.Gold1 and Ronald P.Neoadjuvant therapy for gastrointes⁃tinal stromal tumor(GIST):racing against resistance[J].Annals of Surgical Oncology 2007,14(4):1247.
[13]Michael Schmieder,Sebastian Wolf,Bettina Danner,et al.p16 ex⁃pression differentiates high-risk gastrointestinal stromal tumor and predicts poor outcome[J].Neoplasia,2008,10(10):1154.
(收稿:2010-03-06修回:2010-06-10)
(责任编辑齐清会)
Surgical Treatment of 143 Cases of Gastrointestinal Stromal Tumors
Liu Peng,Zheng Zhikui,Qi Feng,
et al.Department of General Surgery,Tianjin Medical University,General Hospital,Tianjin General Surgery Institute(300052),China
ObjectiveTo explore the clinicopathological characteristics,demonstrate the condition of diagnosis and treatment and analyze the risk factors of prognosis of gastrointestinal stromal tumors(GIST). MethodsThe clinical data of 143 operated cases of GTST were enrolled into retrospective analysis.Results The stomach and intestine were the two most common locations with the constituent ratios of 42.7%and 35.0% respectively.The common and first clinical symptoms were abdominal pain or discomfort(44.1%),and gastrointestinal(GI)tract bleeding and anemia(28%).The tumors were completely removed in 131 cases.The immunohistochemical analysis revealed that the positive rate of CD117 was 98.5%.The median survival time was 65.0 months.The overall 1,3,and 5 year survival rates were 91.8%,73.3%and 52.1%respectively.Using multivariate analysis,it was found that tumor completely resected and malignant risk of tumor were two independent prognostic factors(P<0.05).ConclusionThe primary treatment of GIST is complete surgical resection.Patients with advanced GISTs achieved clinical benefit with imatinib.Tumor completely resected risk of malignancy and imatinib treatment are independent prognostic factors.
gastrointestinal stromal tumors,diagnosis,surgical treatment,immunohistochemistry,imatinib, prognosis
R656.6
A
1007-6948(2010)05-0522-04
10.3969/j.issn.1007-6948.2010.05.002
天津医科大学总医院普通外科(天津300052)
刘彤,Tel:022-63063901,E-mail:gfc980218@yahoo. cn

