鸡IFN-γDNA壳聚糖纳米粒的制备及外源基因表达
殷 吉吉,张文龙,刘霓红,杨 涛,步志高,王君伟,吴东来*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部兽医公共卫生重点开放实验室,黑龙江哈尔滨150001;2.东北农业大学动物医学学院,黑龙江哈尔滨150030)
干扰素(Interferon,IFN)分为两类:Ⅰ类IFN主要包括IFN-α、IFN-β;Ⅱ类IFN又称为IFN-γ[1]。IFN-γ具有提高MHC分子表达、增强NK细胞杀伤作用、促进巨噬细胞的吞噬能力和炎症反应等免疫调节功能。IFN-γ作为一种天然的免疫应答介导物,具有良好免疫佐剂作用。
壳聚糖(Chitosan,CS)是由甲壳素经脱乙酰化作用处理后的产物,其化学名为聚-2-氨基-2-脱氧-β-D-葡萄糖。作为一种天然的聚阳离子多糖化合物,CS广泛分布于藻类、真菌、节肢动物及贝类等软体动物的贝壳中。由于CS具有天然无毒性、良好的生物相容性、可降解、可再生性且原材料丰富、成本低等特点,有望成为广泛使用的药物载体。已有研究表明CS具有较强的核酸结合能力,可提高核酸对核酸裂解酶的稳定性[2-3],同时由于CS具有的天然免疫活性,还能协同增强核酸免疫作用[4]。
本实验利用CS包裹含有禽源高效启动子β-acting启动子的鸡IFN-γ表达重组质粒pCAGGS-ChIFN-γ制备了CS纳米颗粒(CNPs),并对粒径大小、Zeta电势、DNA保护性能及体外转染能力等方面进行了研究。
1 材料和方法
1.1 菌种、质粒与实验动物 鸡IFN-γ真核表达重组质粒pCAGGS-ChIFN-γ[5]、大肠杆菌(Escherichia coli)DH5α感受态菌种由本实验室保存;9日龄~10日龄SPF鸡胚由本所提供。
1.2 主要试剂及仪器 CS:分子量147 ku,脱乙酰度96.2%购自山东奥康生物制品有限公司;抗鸡IFN-γ多克隆血清为哈尔滨兽医研究所刘胜旺博士提供;DNA Marker、DNaseⅠ购自宝生物工程(大连)有限公司;质粒中提试剂盒购自美国Promega公司;分析纯级茚三酮购自上海化学试剂公司;LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;Opti-MEM、DMEM和胎牛血清购自美国GIBCO公司;壳聚糖酶、FITC标记绵羊抗兔IgG和Hoechst 33258购自美国Sigma公司。Microplate Fluorescence Reader(FLx800)为Bio-Tek公司产品;JEM-1200透射电子显微镜为日本电子公司产品;3000HS型光子相关色谱仪为英国Malvern Instruments公司产品。
1.3 CNPs制备 将CS溶解在5 mmol/L NaAC缓冲液(pH5.5)中制成浓度为 200 μg/mL的 CS溶液,与含有 5 mmol/L Na2SO4的 DNA 溶液(100 μg/mL)分别预先加热到50℃~55℃,等体积迅速混合,涡旋30 s,室温放置1 h,即制备成CNPs胶体溶液[6]。
1.4 CNPs的药剂学评价
1.4.1 CNPs纳米粒的形态、粒径和Zeta电势的测定 取少量CNPs胶体溶液滴加于铜网上,2%磷钨酸负染,透射电子显微镜下观察纳米粒的形态。另取纳米粒胶体溶液适量,用PCS测定纳米粒平均粒径、粒径分布及Zeta电位。
1.4.2 CNPs的包封率和载药量测定 包封率测定:取CNPs胶体溶液于高速冷冻离心机上(4℃,50 000 g,30 min)离心分离,按照每100 mL荧光剂缓冲液(2 mol/L NaCl,0.05 mol/L Na3PO4,pH7.4)加入 50 μL Hoechst 33258浓缩液(0.2 g/mL溶于水),配置Hoechst 33258稀释液。在白色96孔板中的4个孔中分别加入 0 μL,0.1 μL,1 μL,10 μL 适量稀释的待测样品,以Hoechst 33258稀释至300 μL。充分混匀,用Microplate Fluorescence Reader测定样品的相对荧光强度(F)。根据标准曲线c(ng/mL)=0.0752 F-1.5234计算溶液中游离的DNA含量,并按下式计算包封率:包封率(%)=(W总-W游)/W总×100%(W总:DNA的加入量;W游:上清液中DNA的测得量)。
载药量测定:取CNPs胶体溶液于高速冷冻离心机上按上述条件离心分离,取上清液1.0mL置10mL量瓶中,加入2 mol/L pH5.5醋酸钠缓冲液和1%茚三酮试剂各1 mL,重蒸水补至3 mL,混合均匀,于沸水浴加热10 min,取出迅速冷却至室温,加60%乙醇稀释至刻度,摇匀,静置20 min,于570 nm处测定吸收度(A);根据标准曲线c(μg/mL)=158.88 A-0.0749,计算溶液中游离CS的含量;按下式计算载药量:载药量(%)=WDNA/(WCS+WDNA)×100%。(WDNA:纳米颗粒中DNA量;WCS:纳米颗粒中CS量)。
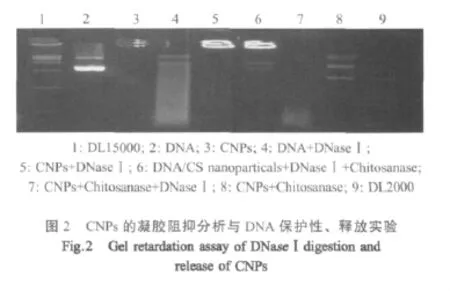
1.4.3 凝胶阻滞分析 CNPs因荷正电而停止向正极的移动,滞留于加样孔中。用凝胶阻滞分析法验证DNA/CS多聚复合物的形成及电荷性质。
1.4.4 DNA保护能力测定 将1 μg DNA和含10 μL CNPs 悬液(含 有 DNA 1 μg)分别 与 10 μL 40 u/mL的DNaseⅠ在37℃下作用15 min。在处理过的纳米颗粒中加入16 μL 0.2 u/mL的CS酶溶液和4 μL 100 u/mL的溶菌酶溶液,37℃反应4 h。同时设置DNaseⅠ阴性对照组与CS酶阴性对照组,以及先加入CS酶后加入DNaseⅠ对照组。反应结束后经0.8%琼脂糖凝胶电泳观察DNA降解情况。
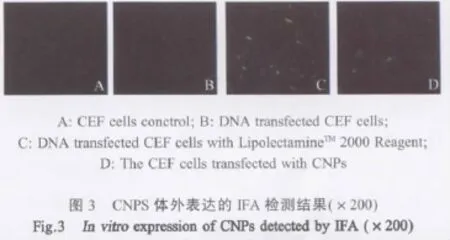
1.4.5 体外转染实验 参照脂质体LipolectamineTM2000使用说明进行转染,同时取DNA相同含量的CNPs悬液转染CEF细胞。72 h后弃去培养液,用PBST洗涤1次后自然干燥,用预冷700 mL/L乙醇4℃固定30 min,自然干燥。用PBST洗涤,取兔抗鸡IFN-γ多克隆抗血清1∶20稀释,每孔加入适量血清稀释液,置湿盒内37℃作用45 min。用PBST洗涤,自然干燥。将FITC标记绵羊抗兔IgG按1∶160稀释,每孔加入适量抗体稀释液,置黑暗湿盒内37℃作用45 min。用PBST洗涤,去离子水洗涤脱盐后,分别利用荧光显微镜和Microplate Fluorescence Reader检测荧光和相对荧光强度。
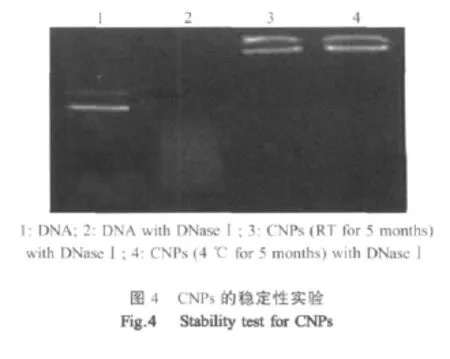
1.4.6 CNPs的稳定性实验 分别取4℃和室温保存 5 个月的 10 μL CNPs子悬液(含有 DNA 1 μg)与10 μL 40 u/mL的 DNaseⅠ在 37℃下作用 30 min,加入碘乙酸溶液(终浓度为5 mM)终止反应。同时设裸DNA对照组。
2 结 果
2.1 CNPs的形态、直径和Zeta电势的测定 制备的CNPs在电镜下呈不规则球形,结构紧密,大小较均一(图1)。激光粒度分析仪测定结果表明,CNPs的平均粒径为172.6 nm±5.1 nm,Zeta电势20.8 mV±2.9 mV。

2.2 CNPs的包封率和载药量的测定 测定结果表明制备的CNPs的包封率为91.21%±2.54%,载药量为31.93%±0.16%。
2.3 凝胶阻滞分析与DNA保护性、释放实验 电泳结果显示(图2),制备的CNPs滞留在上样孔中,而DNA由负极向正极移动。CNPs在与CS酶作用后可以将包裹的DNA释放。在DNaseⅠ的条件下裸露的DNA已经被大部分降解,而CNPs由于有CS的保护未被DNaseⅠ降解,在与CS酶作用后依然可以释放DNA。并且释放后的DNA经DNaseⅠ作用同样可以被降解。
2.4 体外转染实验 分别在荧光显微镜下观察和在Microplate Fluorescence Reader中检测荧光和相对荧光强度。结果显示(图3),CNPs可以在体外正确表达(图3C),但表达效率较低。CEF细胞对照组、CNPs子转染CEF细胞组、DNA LipolectamineTM2000Reagent转染 CEF组的 Microplate Fluorescence Readerp检测结果分别为:26、134、820。CNPs体外转染效率约为LipolectamineTM2000转染效率的16.3%。
2.5 CNPs的稳定性实验 室温与4℃保存5个月的CNPs均产生了不同程度的絮凝,去上清悬液,经琼脂糖凝胶电泳结果显示:在与40 u/mL的DNaseⅠ反应30 min,裸露的DNA几乎被完全降解,而室温与4℃保存5个月的CNPs均可以保持良好的DNA保护能力(图4)。
3 讨 论
CS具有良好的生物相容性和生物降解性,制备的CNPs具有缓慢释放、靶向作用等特点,已被广泛地用作药物、酶等的载体[7]。1995年,Alexaki等首次报道CS溶液与DNA以自聚集的方式沉淀能得到一种大小为150 nm~500 nm的复合物,于是初步认为CS具有用于基因治疗载体的潜在价值[8]。随后的实验证实:以CS作为载体物质的疫苗经口免疫能诱导产生对弓形虫的有效免疫反应[9]。李惠等通过体内实验证实,包裹后的质粒DNA可以显著提高目的基因-IL-2基因在体内的表达,明显增强体液和细胞免疫水平,增强对大肠杆菌的抗病能力[10]。
本研究将pCAGGS-ChIFN-γ[6]与CS进行包装,形成CNPs。由于CS的包裹,使得包装后的CNPs对DNA的保护能力明显增强。实验过程中所使用的DNaesⅠ的浓度(40 u/mL)远远高于生理环境下核酸酶的浓度,所以在正常生理条件下CNPs会对DNA起到非常好的保护作用。在保存5个月后CNPs已经产生不同程度的絮凝,但上清中的CNPs依然具有良好的DNA保护作用。实验中CNPs产生了絮凝,将会严重影响其产量与质量,所以如何保存CNPs是今后需要解决的问题。
本研究采用的CS分子中96%以上的部分是由2-氨基葡萄糖苷重复单位组成,氨基基团重复单位的pKa为6.5左右,在pH5.5的条件下,CS带大量正电荷。DNA的磷酸基团带有多聚负电荷,因此CNPs通过两者之间的电荷凝聚作用形成。实验中将溶液加热到50℃~55℃,可以降低溶液黏度,防止形成的CNPs发生聚集,而这个温度不会对DNA造成损伤。通过DNA的释放实验证实,包装成CNPs在与CS酶作用后依旧可以释放出完整的DNA。同时在体外转染实验中证明细胞内CNPs释放后的DNA可以正确表达。
CS作为一种基因药物载体存在许多优点,但同样也存在很多不足。笔者在实验中发现CNPs的转染效率较低(约为脂质体的16.3%),而且CS只溶于微酸溶液,这将影响CS在实践中的应用。改造CS使之成为一种高效的基因药物载体已成为目前亟待研究的课题。
[1]Bazer F W.Mediators of maternal recognition of pregnancy in mammals[J].Proc Soc Exp Biol Med,1992,199(4):373-384.
[2]孙纳,徐顺清,孙汉清,等.壳聚糖脱氧核糖核酸纳米球的制备及其相关特性研究[J].医药导报,2005,24(2):97-99.
[3]张红菱,李媛媛,李晓波,等.壳聚糖纳米载体提高抗乙肝免疫核糖核酸免疫活性的研究[J].中国医院药学杂志,2005,25(8):693-695.
[4]柳时,徐吉吉,罗智,等.叶酸偶联壳聚糖纳米粒的制备[J].医药导报,2005,25(6):561-563.
[5]殷吉吉,张文龙,陈伟业,等.鸡γ-干扰素基因的瞬时表达及其抗病毒活性检测[J].农业生物技术学报,2009,17(6):954-959.
[6]Mao H Q,Roy K,Troung-Le V L,et al.Chitosan-DNA nanopaticles as gene carriers:synthesis,characterization and transfection efficiency[J].J Controlled Release,2001,70(3):399-421.
[7]何强芳,李国明,巫海珍,等.5-氟尿嘧啶壳聚糖微球的制备及其释药性能[J].应用化学,2004,21(2):192-196.
[8]Alexakis T,Boadi D K,Quong D,et al.Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for invivo application[J].Appl Biochem Biotechnol,1995,50(1):93-106.
[9]Bivas-Benita M,Laloup M,Versteyhe S,et al.Generation of toxoplasma gondii GRA1 protein and DNA vaccine loaded chitosan particles:preparation,characterization,and preliminary in vivo studies[J].Int J Pharm,2003,266(1-2):17-27.
[10]李惠,高荣,武梅,等.壳聚糖纳米颗粒包裹对鼠白细胞介素2基因表达和调节小鼠免疫效应的影响[J].生物医学工程杂志,2004,21(6):947-952.

