早熟艾美耳球虫上海株的分离鉴定及生物学特性观察
陈兆国,米荣升,于慧珠,郝言明,胡义彬,黄 燕,李正锋,李 艳,林矫矫
(中国农业科学院上海兽医研究所农业部动物寄生虫学重点开放实验室/上海动物生物技术研究中心,上海200241)
鸡球虫病是由艾美耳属(Eimeria)球虫引起的一种寄生虫病,严重危害鸡的生长发育,对雏鸡的危害尤为严重。鸡球虫分为:堆型艾美耳球虫(E.acervulina)、布氏艾美耳球虫(E.brunetti)、巨型艾美耳球虫(E.maxima)、和缓艾美耳球虫(E.mitis)、毒害艾美耳球虫(E.necatrix)、早熟艾美耳球虫(E.praecox)和柔嫩艾美耳球虫(E.tenella)7种。其中E.praecox是一种“早熟型”球虫,卵囊相对较大,最短孢子化时间为12 h,最短潜在期为83 h。由于该虫种对鸡的致病性较弱,因而对其研究较少。由于鸡球虫病多为球虫混合感染引起,并且感染率高,对养鸡业造成的损失巨大,因此愈来愈受到人们的关注。
本研究对上海田间球虫混合样品进行分离和鉴定,为丰富我国鸡球虫虫种资源,发展球虫病防治技术奠定基础。
1 材料和方法
1.1 球虫样品和实验动物 含E.praecox卵囊的多个艾美耳球虫虫种,分离自上海郊区某鸡场,经鸡传代后收集卵囊,孢子化后4℃保存备用;黄羽肉鸡购自上海郊区某大型鸡场。
1.2 菌株和载体E.coliDH5α由本实验室保存;pMD18-T载体购自TaKaRa公司。
1.3 主要试剂 TaKaRa Universal Genomic DNA Extraction Kit Ver.3.0、ExTaq酶、限制性内切酶EcoRⅠ和HindⅢ均购自TaKaRa公司;DNA胶回收试剂盒购自爱思进生物技术有限公司;100 bp DNA Ladder购自北京天根生化科技有限公司。
1.4 引物设计 根据Schnitzler等报道设计鸡球虫虫种鉴定引物[4-5](表1)。根据Barta等报道设计鸡球虫18S rRNA鉴定引物[6],上游引物ERIB1:5'-ACC TGGTTGATCCTGCCAG-3',下游引物ERIB10:5'-C TTCCGCAGGTTCACCTACGG-3'。由上海桑尼生物技术有限公司合成。

表1 鸡球虫虫种鉴定引物Table 1 Primers used forEimeriaspecies identification
1.5E.preacox单一虫株的分离
1.5.1 预分离 收集、纯化球虫样品,经嗉囊感染14日龄黄羽肉鸡10羽,每羽感染5×104个孢子化卵囊。感染后80 h~92 h收集粪便,按常规方法收集卵囊,加入2.5%重铬酸钾水溶液,培养至孢子化卵囊达80%以上,4℃保存备用。
1.5.2 单卵囊分离 按文献[7]方法感染单卵囊,共感染雏鸡15羽。感染后5 d(DPI)开始逐只检查鸡粪中是否含有球虫卵囊,7DPI剖杀阳性鸡,取小肠前1/3部分内容物镜下观察,收集卵囊,28℃培养至孢子化。
1.6 生物学性状检测 取1.5.2培养的孢子化卵囊,感染无球虫雏鸡,从感染后76 h起,每小时收集粪便并检查是否有卵囊排出,至发现卵囊止;7DPI剖杀,检查肠道卵囊寄生部位;收集肠道卵囊进行孢子化培养,观察最短孢子化时间;观察孢子化和未孢子化卵囊的形态。
1.7 单一虫株的虫种鉴定
1.7.1 虫种的初步确定 根据卵囊形态大小、最短潜在期、寄生部位和最短孢子化时间等结果,参考文献,初步确定虫种。
1.7.2 虫种PCR鉴定 取105个经饱和盐水漂浮法纯化的孢子化卵囊,匀浆破碎,按TaKaRa Universal Genomic DNA Extraction Kit Ver.3.0试剂盒说明书操作提取虫体基因组DNA。以基因组DNA为模板,用表1中7对引物分别进行PCR扩增。反应条件:95℃2 min;95℃30 s、62℃30 s、72℃1 min,30个循环;72℃10 min。
1.8 18S rRNA基因的扩增和序列测定
1.8.1 PCR扩增 以基因组DNA为模板,应用18S rRNA引物进行PCR扩增。反应条件:94℃5min;94℃ 30 s、57℃ 30 s、72℃ 1 min,30个循环;72℃10 min。产物经琼脂糖凝胶电泳观察。
1.8.2 扩增片段的克隆及筛选 应用V-gene DNA凝胶回收试剂盒对扩增片段进行回收并纯化,与pMD18-T载体连接,转化感受态细胞DH5α中,采用蓝白斑筛选阳性菌落,提取重组质粒进行PCR鉴定和酶切鉴定,筛选阳性克隆。
1.8.3 序列测定和分析 阳性重组质粒由上海英骏生物技术有限公司测序。利用DNAStar及Mega 4.0软件进行序列比对和分析,构建系统发生树。
1.9 单一虫株的致病性观察 选取1个单一虫株进行致病性试验。将体质量相近的14日龄雏鸡60羽,平均分为 6组,经嗉囊接种 0、1×104、5×104、1×105、2×105、4×105个孢子化卵囊。7DPI称重、剖杀,观察各组实验鸡的增重、饲料转化率和肠道病变。
1.10 数据处理 采用SPSS 12.0进行数据的统计和显著性分析。
2 结 果
2.1 单卵囊分离结果 对粪便和小肠内容物进行检查,单卵囊接种的15羽雏鸡中,有5羽感染,单卵囊接种感染率为33.3%。收集编号为EPSH的单一虫株的卵囊进行重新接种、虫种鉴定和生物学性状测定。
2.2 EPSH的生物学性状测定
2.2.1 卵囊形态 卵囊多数呈椭圆形,少数呈卵圆形或球形,壁光滑,无卵膜孔;经孢子化的卵囊内有一极粒,无卵囊残体,无孢子囊残体。
随机测定从肠道、粪便收集的未孢子化和孢子化卵囊各 50个,大小为 15.00 μm~25.00 μm×13.75 μm~22.5 μm,平均大小为 20.07 μm×17.52 μm,形状指数(shape index,SI)为1.15,具体见表2。

表2 ETSH株球虫卵囊大小Table 2 Oocysts size of ETSH
最小显著差数法(Least-significant difference,LSD)检验分析显示,收集于肠道的EPSH株孢子化卵囊与未孢子化卵囊长和宽的显著性(Sig)分别为0.137和0.071,p>0.05,无显著差异;但收集于肠道的卵囊与收集于粪便的卵囊比较,Sig均为0,p<0.01,差异极显著;收集于粪便的未孢子化卵囊分别与孢子化卵囊的长和宽比较,其中长度的Sig为 0.020,p<0.05,差异显著;宽度的 Sig为 0,p<0.01,差异极显著(表 2)。用 Studednt-Newman-Keuls和Duncan法检验,结果与LSD法一致。
2.2.2 寄生部位 EPSH株寄生于小肠前1/3部位,主要寄生于十二指肠。
2.2.3 最短孢子化时间 经2次以上重复检查,结果显示EPSH株肠道收集到卵囊的最短孢子化时间为16 h。
2.2.4 最短潜在期 将收集的卵囊接种无球虫雏鸡,观察结果显示最短潜在期为81 h。
2.3 虫种PCR鉴定 EPSH株卵囊基因组DNA经7对引物分别扩增后,仅引物EPA/EPR扩增出约400 bp的片段(图1),表明该虫株为E.praecox,命名为E.praecox上海株。

2.4 18S rRNA基因的克隆和系统发生分析 ETSH株球虫18S rRNA基因扩增片段大小约为1 700 bp。将PCR产物连接于pMD18-T载体中,PCR及酶切鉴定结果均正确。序列测定结果表明EPSH株18S rRNA基因序列长1 747 bp,与GenBank登录的E.praecox18S rRNA基因序列(U67120)同源性为 99.4%(表3)。与E.acervulina、E.brunetti、E.maxima、E.mitis、E.necatrix和E.tenella18S rRNA序列(登录号分别为 U67115、U67116、U67117、U67118、U67119 和U67121)同源性分别为97.7%、96.4%、96.7%、94.5%、95.0%和95.5%。已将该序列录入Gen-Bank,登录号为GQ421692。
系统进化树分析显示上海田间分离的EPSH株与GenBank登陆的E.praecox在同一个分支上,与E.mitis、E.brunetti和E.maxima的遗传距离相对较近,但E.acervulina、E.necatrix和E.tenella的遗传距离相对较远(图2)。
2.5 致病性 以不同剂量的EPSH株球虫接种雏鸡,均未死亡。但随着接种剂量的增加,雏鸡相对增重率逐渐下降,而料肉比呈逐渐上升趋势(表3)。感染鸡病变仅局限于十二指肠,主要表现为肠管壁有少量粘液,并有针尖状出血点,而空肠未见眼观病变。其中 1×104、5×104、1×105、2×105和 4×105剂量接种组分别有4羽、4羽、5羽、6羽和5羽出现上述症状。
从排卵囊情况分析,各组均在4 DPI开始排出卵囊,其中1×104感染组在5 DPI达到排卵囊峰值,此后逐渐下降。其余4组均在6 DPI达到排卵囊峰值,7 DPI则明显下降(图3)。
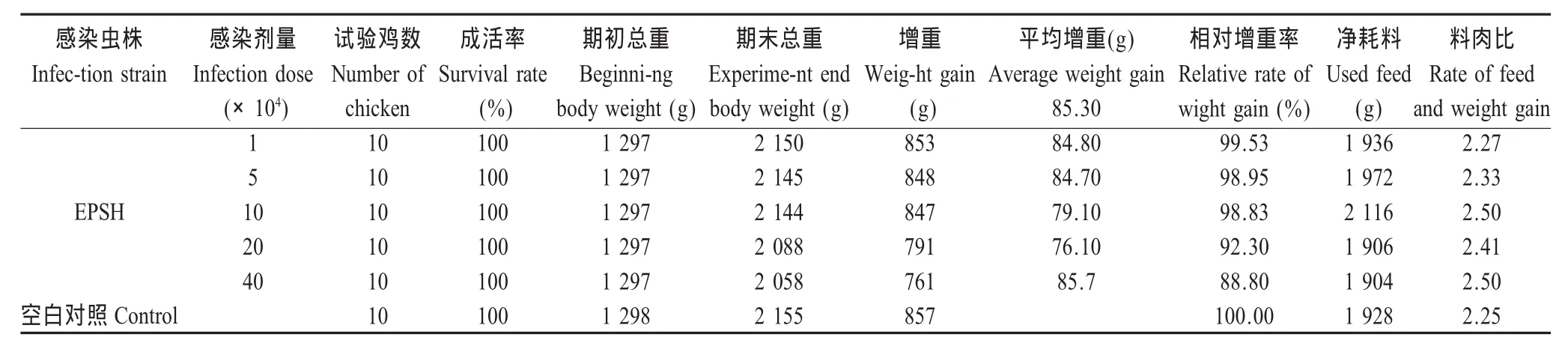
表3 ETSH株球虫卵囊大小Table 3 Oocysts size of ETSH

3 讨 论
本研究利用单卵囊分离技术从上海田间混合样品中分离获得5个鸡艾美耳球虫单一纯化株,通过卵囊形态大小、最短孢子化时间、最短潜在期和寄生部位等生物学特性观察及PCR鉴定,确定编号为EPSH的单一虫株为E.praecox,命名为E.praecox上海株。
卵囊的量度可以作为球虫的一种特征,但不同的研究者报道的E.praecox也存在细微的差异,而且多为孢子化卵囊的报道,其中,Johnson和Gore等报道卵囊的平均大小为 23.00 μm~23.80 μm×19.50 μm~20.6 μm,SI为 1.16~1.17[1,8];Tyzzer和Edgar等报道卵囊的平均大小为21.25 μm~21.30 μm×17.07 μm~17.10 μm,SI为 1.24~1.25[1,9];Long和Jorgensen等报道卵囊的平均大小为20.40 μm~20.60 μm×16.94 μm~17.10 μm,SI为 1.19~1.25[10,11];徐卫东等分离的E.praecox长春株大小为19.43 μm×15.98 μm,SI为 1.11~1.38,平均为 1.22[2]。而未孢子化卵囊的大小报道较少。本研究证实不同来源的E.praecox卵囊大小存在差异,收集自肠道的卵囊明显小于收集自粪便的卵囊;收集自粪便的未孢子化卵囊与孢子化卵囊的大小也有明显差异。造成这种现象的原因目前尚不清楚,推测可能与卵囊所处环境有关,在肠道内,受宿主内环境包括温度、湿度、酸碱度和压力等理化因素、蛋白酶等生物因素的影响,使卵囊处于相对收缩状态;排出体外后,上述因素相对减轻或发生变化,卵囊也处于相对舒展的状态,具体原因需要进一步研究。
关于E.praecox的最短潜在期,文献报道多为83 h~84 h[1,8-10,12],而Jorgensen等报道为92 h[11],徐卫东等报道为89 h[2]。本研究分离的E.praecox的最短潜在期仅为81 h,比上述报道至少提前2 h,其原因尚不清楚,推测可能是特定地理环境造成的。而虫株最短孢子化时间为16 h,比Edgar等的报道晚4 h[9],早于徐卫东等报道的20 h[2]和Norton报道的21 h[13],这可能与培养温度、重铬酸钾溶液的添加量和杂质数量等因素有关。但其最短孢子化时间仍比除E.mitis(15 h)外的其他鸡球虫的时间要短[14]。孢子化速度通常被引证为球虫种的特征,在相同条件下,作为一个特征对两种球虫卵囊的比较,结果是比较可信的,但测量方法应尽量标准。
关于E.pracecox的致病性,文献报道较少。本研究显示,E.pracecox上海株感染雏鸡后,部分雏鸡肠道出现少量粘液,并有针尖状出血点,但病变位置仅在十二指肠。随着感染剂量的增加,出现病变的雏鸡数相应增加,鸡只的相对增重逐渐下降,而饲料转化率则呈递增趋势,表明雏鸡的病变情况与E.pracecox的感染剂量呈正相关,对增重及饲料转化率有较大的影响,同时影响养鸡业的经济效益,应该引起重视。
[1]Tyzzer E E,Theiler H,Jones E E.Coccidiosis in gallinaceous birds.Ⅱ.A comparatire study of species ofEimeriaof the chicken[J].Am J Hyg,1932,15:319-393.
[2]徐卫东,王亮,孙维东.早熟艾美耳球虫地方株的分离与鉴定[J].吉林畜牧兽医,1995,(4):10-13.
[3]Chapman H D.The treatment of coccidiosis:studies on the sensitivity of recent field isolates ofEimeria acervulinatype to anticoccidial drugs given in the drinking water[J].J Comparat Pathol,1982,92:213-218.
[4]Schnitzler B E,Thebo P L,Mattsson J G,et al.Development of a diagnostic PCR assay for the detection and discrimination of four pathogenicEimeriaspecies of the chicken [J].Avian Pathol,1998,27(5):490-497.
[5]Schnitzler B E,Thebo P L,Tomley F M,et al.PCR identification of chickenEimeria:a simplified read-out[J].Avian Pathol,1999,28(1):89-93.
[6]Barta J R,Martin D S,Liberator P A,et al.Phylogenetic relationships among eightEimeriaspecies infecting domestic fowl inferred using complete small subunit ribosomal DNA sequences[J].J Parasitol,1997,83(2):262-271.
[7]黄兵,吴薛忠,史天卫,等.毒害艾美球虫纯种分离的初步鉴定和致病性研究[J].中国兽医寄生虫病,1993,1(4):24-28.
[8]Gore T C,Long P L.The biology and pathogenicity of a recent field isolate ofEimeria praecoxJohnson,1930[J].J Protozool,1982,29(1):82-85.
[9]Edgar S A,Seibold C T.A new coccidium of chickens,Eimeria mivatisp.n.(Protozoa:Eimeriidae)with details of its life history[J].J Parasitol,1964,50(2):193-204.
[10]Long P L.Studies onEimeria praecoxJohnson,1930,in chicken[J].Parasitology,1967,57:351-361.
[11]Jorgensen W K,Stewart N P,Jeston P J,et al.Isolation and pathogenicity of Australian strains ofEimeria praecoxandEimeria mitis[J].Aust Vet J,1997,75(8):592-595.
[12]Salisch H.A study of the life cycle ofEimeria praecox,Johnson 1930[J].Zentralbl Veterinarmed B,1990,37(5):363-368.
[13]Norton C C,Chard M J.The oocyst sporulation time ofEimeriaspecies from the fowl[J].Parasitology,1983,86(2):193-198.
[14]索勋,李国清.鸡球虫病学[M].北京:中国农业大学出版社,1998.

