内源和外源性禽白血病病毒鉴别PCR检测方法的建立
周 刚,牛成明,司昌德,韩凌霞
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150001)
禽白血病(Avian leukosis,AL)是由反转录病毒科甲型反转录病毒属AL病毒(ALV)引起的禽类造血组织中某些细胞成分过度增生的肿瘤性疾病[1];ALV的感染还可引起鸡群的免疫抑制[2]和生产力的严重下降。根据致病性和感染宿主的不同,ALV被划分为A-J 10个亚群[3],其中A-D亚群为外源性ALV,主要感染蛋鸡,A、B亚群主要诱发鸡的淋巴细胞白血病,而C、D亚群在野外极为少见;E~I亚群为内源性ALV,其中E亚群为整合在鸡染色体中一种前病毒DNA,在鸡群中普遍存在[4],而F~I亚群的宿主为野生禽类,包括雉、鹧鸪、鹌鹑和鹰等[5]。J亚群具有独特的亚群特异性,主要引起肉鸡的髓细胞瘤[6]。外源性ALV能诱发肿瘤,可垂直和水平传播,而内源性ALV的致瘤性很低,不能产生感染性病毒粒子[7],但内外源性ALV的重组将导致高致病性毒株的产生[8]。
近年来报道了多种ALV的检测方法,但均无法区分内源性和外源性ALV[9]。本研究根据ALV各亚群共有的p27基因和决定ALV亚群特异性的env基因设计引物,建立了ALV的通用检测并鉴别内、外源性ALV的多重PCR检测方法,以期为ALV的临床诊断提供有效的手段。
1 材料和方法
1.1 病毒株和主要试剂 A亚群ALV标准毒株(RAV-1)购自中国兽医药品监督所,网状内皮组织增生症病病毒(REV)、鸡传染性法氏囊病病毒(IBDV)和DF-1细胞由本实验室保存;SPF鸡胚由中国农业科学院哈尔滨兽医研究所提供;M-MLV反转录酶、rTaqDNA聚合酶、pMD18-T载体等均购自大连宝泰克生物有限公司;胶回收试剂盒、病毒RNA提取试剂盒等均购自上海华舜生物技术有限公司;胎牛血清购自PAA公司。
1.2 重组质粒的构建 ALV p27群通用型特异性引物序列按照文献[8]合成,上下游引物分别为pF:5'-CCATGCCTGTAGTGATTA-3'和 pR:5'-CCCGAC CCAGTTTGTCCAT-3',预期扩增大小为 793 bp。外、内源性ALV的特异性引物的设计根据A亚群标准株RAV-1(DQ365814)和E亚群标准株ev1(AY01313)的env基因保守序列,外源性ALV的上下游引物分别为AF:5'-GACTTTACTGGCGGTCCT GA-3' 和 AR: 5'-CCCCACCTGTGAGCAGTTAT-3',预期扩增大小为387 bp;内源性ALV的上下游引物分别为 EF:5'-ACACCTGTGGAGATGTGCAG-3'和ER:5'-GATCCACGCCCCTGATG-3',预期扩增大小为234 bp。RAV-1种毒通过DF-1细胞增殖,按照RNA提取试剂盒说明书提取总RNA,反转录成cDNA(RAV-cDNA)后,利用p27基因和外源性ALV的特异性引物进行PCR扩增,酚/氯仿法提取疑似感染内源性ALV的鸡胚基因组DNA(ALVE-DNA),并利用内源性ALV特异性引物进行PCR扩增。胶回收p27基因、外源性和内源性ALVenv基因的PCR扩增片段,克隆于pMD18-T中构建重组质粒并测序验证,重组质粒分别命名为pp27、pA和pE。
1.3 多重PCR反应条件的优化 在25 μL反应体系下,以等浓度混合的(100 ng/μL)RAV-cDNA和ALVE-DNA为模板,固定引物AF、AR的浓度,将引物 EF、ER和 PF、PR的浓度在 5 pmol/μL~20 pmol/μL,退火温度在48℃~60℃之间进行调整,以确定多重PCR反应的最佳引物浓度和退火温度;在此基础上将多重PCR的延伸时间在20 s~120 s之间进行优化,以确定最佳延伸时间。
1.4 多重PCR反应的特异性试验 参考病毒RNA提取试剂盒说明书提取REV和IBDV的RNA,反转录成cDNA并利用建立的多重PCR方法分别对RAV-cDNA和ALVE-DNA混合物、RAV-cDNA、ALVE-DNA、REV cDNA、IBDV cDNA进行扩增,以检测该方法的特异性。
1.5 多重PCR反应的敏感性试验 用分光光度计测定RAV-cDNA和ALVE-DNA的浓度,并对各稀释度(109copies/μL ~101copies/μL)的混合 DNA 进行多重PCR扩增,以检测该方法的敏感性。
1.6 多重PCR反应的初步应用和符合性试验 采集现地一只疑似感染ALV的病死鸡的肝脏、脾脏、肾脏、肺脏和心脏,以及10枚不同来源地的疑似感染内源性ALV的鸡胚,按常规方法提取基因组DNA,利用建立的多重PCR方法和IDEXX公司的ALV p27抗原ELISA检测试剂盒检测内、外源性ALV的感染情况。
2 结 果
2.1 pp27、pA和pE重组质粒的测序结果 1株pp27与亲本株RAV-1、B亚群 RAV-2株(KO2374)、ALV-E ev1株的核苷酸序列同源性分别为100%、99.76%和98.24%;1株pA与RAV-1株、RAV-2株的核苷酸序列同源性分别为97.6%和98.6%,与ev1株的同源性仅为74%;1株pE与ALV-E ev3株(AY013304)、ev1株核苷酸序列同源性分别为99.76%和99.28%,与RAV-1、RAV-2株的同源性均为54%。
2.2 多重PCR最佳反应条件的确定 经过对各反应条件的优化,最终确定在25 μL PCR反应体系中,浓度均为20 pmol/μL的p27、ALVA、ALVE引物各 0.6 μL、0.25 μL 和 0.125 μL;最佳退火温度为50℃;最佳延伸时间为40 s。
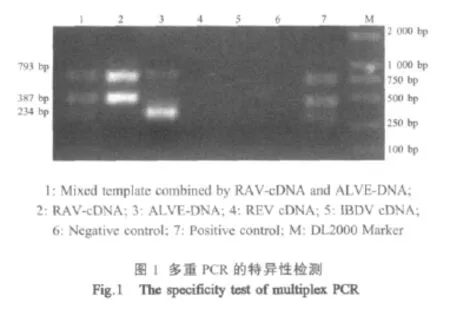
2.3 多重PCR反应的特异性试验 RAV-cDNA和ALVE-DNA混合物扩增出793 bp、387 bp和234 bp的特异性片段,RAV-cDNA仅扩增出793 bp和387 bp的特异性片段,ALVE-DNA仅扩增出793 bp和234 bp的特异性片段,而从REV和IBDV cDNA中均未扩增出任何片段。表明建立的多重PCR方法具有良好的特异性(图1)。
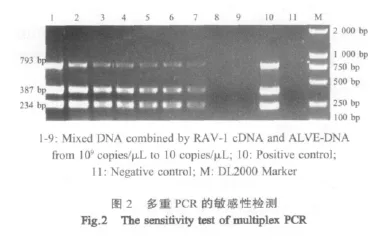
2.4 多重PCR反应的敏感性试验 当RAV-cDNA和ALVE-DNA的浓度均为103copies/μL时仍可得到清晰特异的片段,表明建立的多重PCR方法的灵敏度为 2×103copies(图 2)。
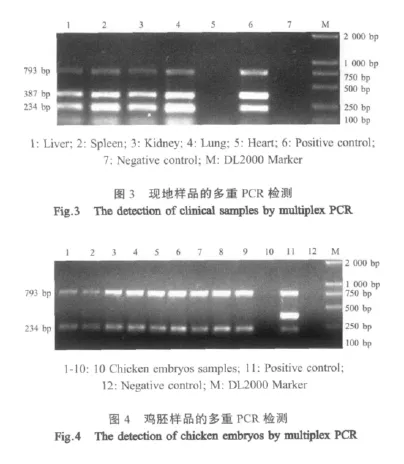
2.5 现地样品的检测 肝、脾、肾和肺均扩增出793 bp、387 bp和234 bp的特异性片段(图3),而9枚鸡胚仅扩增出793 bp和234 bp的特异性片段(图4),而且肝、脾、肾、肺和9枚鸡胚的ELISA检测结果均为阳性(S/P大于0.4),与多重PCR的检测结果完全符合,表明现地患病鸡感染了外源性和内源性ALV,而鸡胚仅感染了内源性ALV。
3 讨 论
本研究选择p27群特异性抗原的基因序列设计一对引物,通过优化反应条件建立了检测ALV并鉴别外源性和内源性ALV的多重PCR检测方法,该方法可鉴定所有亚群的ALV,以此区分从临床上难以鉴别的禽病,如禽网状内皮组织增生症。由于ALV囊膜糖蛋白的编码基因(env)容易发生变异,其在ALV外源性A、B、C、D亚群和内源性E、J亚群中的同源性仅为40%[10],因此,该方法将ALV A亚群标准毒株RAV-1和内源性ALV ev1(ev基因座)的env基因作为靶基因设计2对特异性引物,可对外源性和内源性ALV的感染进行区分。本研究所建立的多重PCR方法具有特异、敏感、经济高效等优点,将为外源性ALV的临床检测、鸡群的防制净化及ALV的试验研究提供重要的手段。
[1]赵振华,杨玉莹,成子强,等.禽白血病[M].北京:中国农业出版社,2006:11-12.
[2]马秀丽.鸡病毒性免疫抑制病的发展趋势与防制措施[J].山东畜牧兽医学报,2000,30(2):37-39.
[3]靳艳玲,罗薇.禽白血病研究进展[J].西南民族大学学报,2005,24(4):44-46.
[4]杨玉莹.J亚群禽白血病病毒研究进展[J].中国病毒学,2003,18(1):93-97.
[5]Payne L N.Developments in avian[J].Leukemia,1999,6(3):150-152.
[6]Jeffrey A,Walid H.Characterization of endogenous avian leukosis viruses in chicken embryonic fibroblast substrates used in production of measles and mumps vaccines[J].Virology,2001,75(8):3605-3612.
[7]Payne L N.The emergence of subgroup J avian leukosis virus[J].Leukemia,2003,27(6):36-45.
[8]李新华.禽白血病流行病学特点及防制措施[J].养禽与禽病防治,1997,20(4):11-12.
[9]罗明星,周碧君,李永明.禽淋巴细胞白血病的诊断与病毒亚群鉴定[J].中国动物检疫,2009,26(3):55-57.
[10]Chesters P M,Howes K,Petherbridge L,et al.The viral envelope is a major determinant for the induction of lymphoid and myeloid tumours by avian leukosis virus subgroups A and J,respectively[J].Gen Virol,2002,83(10),2553-2561.

