茨城病病毒S7基因的截短表达及间接ELISA检测方法的建立
张文龙,殷吉吉,吴东来*,王君伟
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.中国农业科学院哈尔滨兽医研究所农业部兽医公共卫生重点开放实验室/兽医生物技术国家重点实验室,黑龙江哈尔滨150001)
茨城病(Ibaraki disease,IBAD)是由呼肠孤病毒科环状病毒属的流行性出血热病毒群的茨城病病毒(Ibaraki virus,IBAV)引起的牛急性、热性传染病。该病曾在东南亚、澳洲和美洲地区多次暴发,给养牛业造成了一定的经济损失。我国的《中华人民共和国进境动物一、二类传染病、寄生虫病名录》中将其列为二类传染病。
目前,IBAV的血清学检测方法主要是中和试验、血凝抑制试验和琼脂免疫扩散试验。但以上方法存在耗时多、敏感性较低等不足。因此,需要建立一种简捷、敏感性高的血清学检测新方法。
IBAV的VP7蛋白是构成内层衣壳的蛋白之一,由病毒的S7基因节段编码,全长352个氨基酸[1],分子量38 ku[1]。VP7蛋白高度保守,属群特异性抗原[2]。这种保守性使得VP7蛋白在病毒感染的血清学诊断方面受到关注[3-5]。VP7蛋白单体分为上、下两个结构域。上层结构域较小,由多肽链的中央1/3区域构成(121 aa~249 aa),这一结构域位于核心颗粒的最外层,在成熟的病毒粒子中与外层衣壳相互作用。该区域亲水性和抗原性较强。本研究对IBAV No.2株的VP7蛋白中抗原性、亲水性较强的部分(102 aa~293 aa)进行了截短表达,获得了可溶性且抗原性良好的截短VP7蛋白,并利用纯化的截短VP7蛋白作为包被抗原建立了IBAV抗体间接ELISA检测方法。
1 材料和方法
1.1 病毒株、细胞、菌种和质粒 IBAV No.2株、BHK-21细胞系以及大肠杆菌DH5α、BL21(DE3)感受态细胞和pET-32a(+)载体质粒由哈尔滨兽医研究所人畜共患病课题组、分子免疫学研究室(以下简称本实验室)保存。含有IBAV No.2株全长S7基因的pET28S7质粒由本实验室构建并保存。
1.2 主要试剂和血清 各种限制性内切酶、TaqDNA聚合酶、DNA连接试剂盒、DNA分子量Marker均购自宝生物工程(大连)有限公司;质粒小量抽提试剂盒、胶回收小量试剂盒购自上海华舜;蛋白质分子量Marker购自Fermentas公司;辣根过氧化物酶标记兔抗牛IgG购自SIGMA公司;镍离子亲和树脂购自NOVAGEN公司;Bradford蛋白浓度测定试剂盒购自碧云天公司。IBAV标准阳性、阴性血清由日本农林水产省动物卫生研究所惠赠;牛结核、病毒性腹泻、传染性鼻气管炎和口蹄疫阳性血清由本室保存;95份采集自内蒙古自治区和70份采集自云南省的牛血清由哈尔滨兽医研究所辛九庆副研究员惠赠。
1.3 截短S7基因重组表达质粒的构建 采用引物IBAVS7 shortup:5'-CCGGAATTCATGGAATCAGC-gAATGAGATTG-3'(含有EcoRⅠ酶切位点)和IBAVS7 shortlow:5'-CCGCTCGAGTTATATTGGTGGGATAT TATTCG-3'(含有XhoⅠ酶切位点)。以pET28S7重组质粒为模板扩增S7基因307 bp~894 bp(编码102 aa~293 aa)部分。扩增产物经EcoRⅠ和XhoⅠ酶切处理后插入pET-32a(+)质粒中。经酶切鉴定、PCR鉴定正确的重组质粒命名为pET32S-S7,由上海英骏生物技术有限公司进行测序。
1.4 重组蛋白的诱导表达、纯化及鉴定 pET32S-S7质粒及pET-32a(+)质粒分别转化大肠杆菌BL21(DE3)感受态细胞。16℃IPTG诱导过夜。
按照Novagen公司His·BindRKits User Protocol TB054 Rev.F 0106所述步骤纯化截短VP7重组蛋白。用SDS-PAGE及western blot方法对纯化的截短VP7重组蛋白进行鉴定。
按照Bradford试剂盒说明书测定纯化截短VP7蛋白的浓度。在蛋白溶液中加入终浓度为50%的灭菌甘油,-20℃保存。
1.5 间接ELISA检测方法的建立
1.5.1 抗原及一抗工作浓度的确定 将纯化的截短VP7蛋白用0.05 M碳酸盐缓冲液(pH9.6)稀释,包被96孔酶标板,每孔100 μL。4℃湿盒包被过夜。200 μL 1%明胶封闭,37℃温箱中孵育 45 min。IBAV阳性血清、阴性血清分别倍比稀释,每孔100μL进行ELISA方阵试验。HRP标记的兔抗牛IgG抗体1∶8 000稀释,每孔100 μL,37℃温箱中孵育45 min。加入50 μL显色底物,37℃避光显色10 min。50 μL 2 mol/L H2SO4中止反应。测定各孔OD492nm值,确定抗原和一抗工作浓度。
1.5.2 包被条件的确定 按照1.5.1所述步骤,选择3种包被条件进行试验:-37℃湿盒温育2 h、4℃湿盒过夜和室温湿盒过夜。
1.5.3 封闭液的选择 按照1.5.1所述步骤分别选择1%明胶、3%明胶、1%BSA、3%BSA、5%脱脂乳和1%酪蛋白作为封闭液进行试验。
1.5.4 二抗工作浓度的确定 按照1.5.1所述步骤选择二抗分别以 1∶5 000、1∶8 000 和 1∶10 000 倍比稀释进行试验。
1.5.5 ELISA判定标准的确定 按确定的ELISA操作方法检测25份阴性血清(经中和试验检测确认),根据各阴性血清OD492nm值的平均值(X)和标准差(SD)建立判定标准。取X+3×SD为临界值。
1.5.6 交叉反应性试验 用建立的间接ELISA方法检测牛口蹄疫病毒(FMDV)、牛病毒性腹泻病病毒(BVDV)、牛传染性鼻气管炎病毒(IBRV)和牛结核4种常见牛病的阳性血清。每种血清重复4孔。
1.5.7 竞争性抑制试验 在IBAV标准阴、阳性血清稀释液中加入含有IBAV的细胞培养液,37℃作用1 h后进行ELISA检测。
1.5.8 符合率试验 用建立的间接ELISA方法检测95份采集自内蒙古自治区的血清样本。同时,用这些血清进行病毒血清中和试验(SN),逐日观察并记录病变情况。根据Reed-Muench法计算抗体中和效价,以中和抗体效价≥2为血清抗体阳性。将ELISA试验结果与相应的中和试验结果进行比较,计算符合率。
1.5.9 临床样品检测 用建立的间接ELISA方法对来自云南省的70份血清样品进行检测。测定结果根据判定标准确定样品的阴、阳性,并计算血清样本的阳性率。
2 结 果
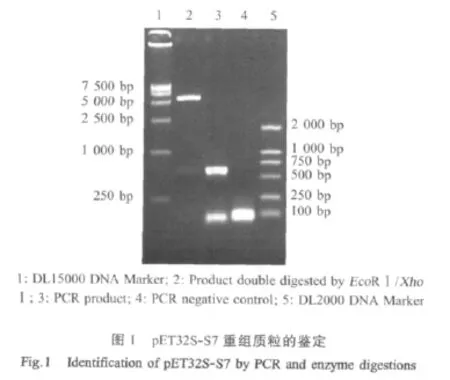
2.1 pET32S-S7重组质粒的鉴定 用EcoRⅠ和XhoⅠ对pET32S-S7重组质粒进行酶切鉴定,获得约600 bp和 5 300 bp两条带,用 IBAV S7 shortup、IBAV S7 shortlow引物对重组质粒进行PCR鉴定获得约600 bp的特异片段(图1);测序结果证明基因序列正确,表明获得了正确的重组质粒。
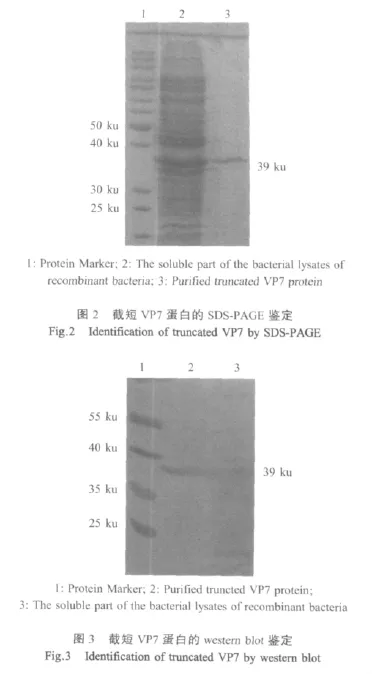
2.2 重组蛋白的鉴定 经SDS-PAGE电泳分析,菌体裂解上清中约40 ku处出现一条带,与预期的截短VP7大小相符。纯化后电泳显示仅在该位置获得一条蛋白质条带(图2)。Western blot分析结果显示在相应的位置有反应条带,表明该蛋白条带是截短VP7蛋白并且具有抗原性(图3)。
2.3 纯化重组蛋白浓度的测定 截短VP7纯化蛋白液的OD595nm值为0.0623,根据标准曲线和标准方程计算蛋白浓度为0.0188 mg/mL。
2.4 工作条件的确定
2.4.1 抗原浓度和一抗工作浓度的确定 以截短VP7蛋白作为包被抗原进行间接ELISA试验,阳性血清反应与阴性对照区分均比较明显(表1)。当抗原包被量为40 ng和50 ng,血清稀释度为1∶200时,阳性值接近1.0。但包被量为50 ng时OD492nm的P/N值比包被40 ng时大,所以选择抗原包被量为50 ng,血清稀释度为1∶200作为抗原和一抗工作浓度。
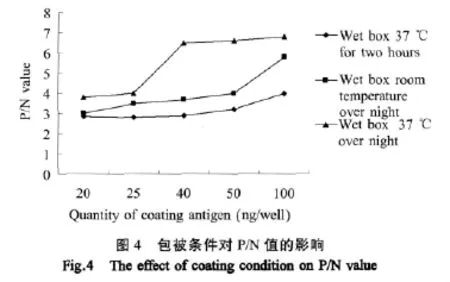
2.4.2 包被条件的确定 如图4所示,3种包被方法中4℃湿盒包被过夜可以显著提高P/N值,因此选择4℃湿盒包被过夜作为包被条件。
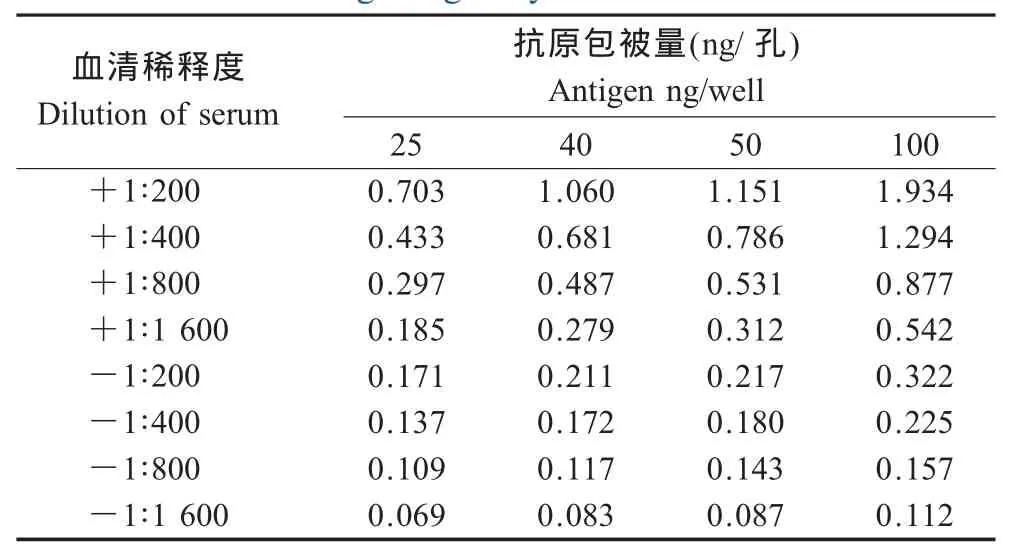
表1 截短VP7蛋白间接ELISA方阵滴定结果Table 1 The phalanx titrimetry of truncated VP7 as coating antigen by indirect ELISA
2.4.3 封闭液的确定 如图5所示,1%明胶、3%明胶、1%BSA、3%BSA和1%酪蛋白作为封闭液时,P/N值都较高。明胶成本更低,因此选择1%明胶作为封闭液。

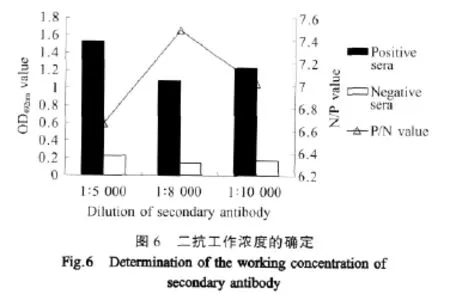
2.4.4 二抗工作浓度的确定 如图6所示,二抗1∶8 000稀释时P/N值最大,因此选择二抗的稀释度为 1∶8 000。
2.4.5 判定标准的确定 根据25份阴性血清的OD492nm的平均值(X=0.146)和标准差(SD=0.059)确定其临界值为0.146+0.059×3=0.323。为了便于判断结果,定义样品OD492nm≥0.32为阳性。
2.4.6 交叉反应性试验 用建立的ELISA方法对4种常见牛病病毒的阳性血清进行检测,结果取平均值。如表2所示,牛结核、BVDV、IBRV和FMDV阳性血清的检测效价都低于0.32,均表现为阴性。
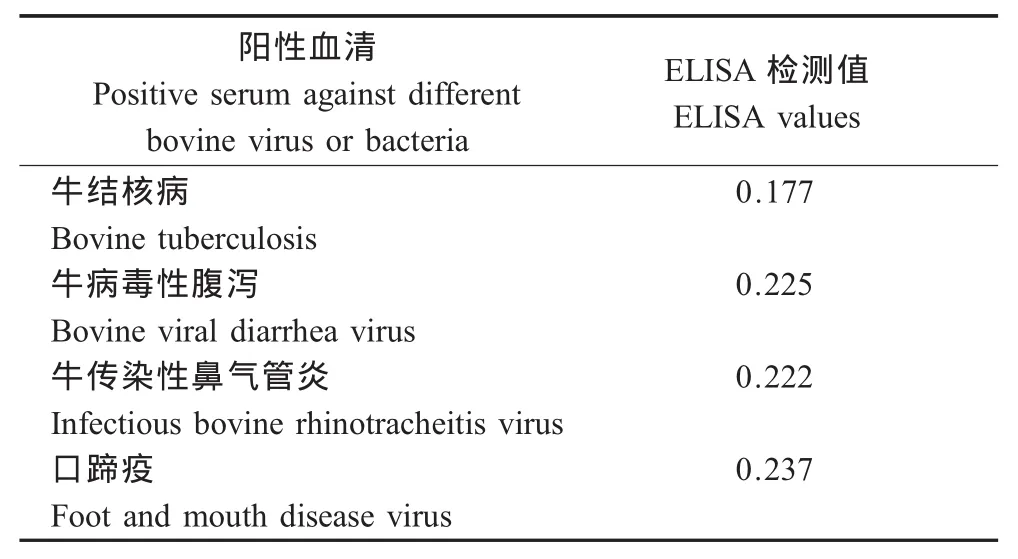
表2 交叉反应试验结果Table 2 Cross reaction test for other bovine virus
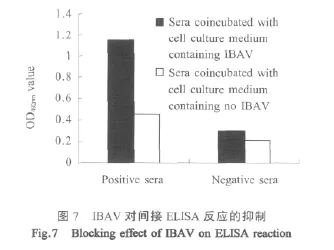
2.4.7 竞争性抑制试验 血清与病毒作用后进行ELISA试验,OD492nm值均有降低,其中阳性血清反应值下降超过50%。表明IBAV可以抑制截短VP7蛋白对IBAV阳性血清的反应(图7)。
2.4.8 ELISA检测结果与中和试验结果的对比 用建立的间接ELISA方法检测95份样本并与中和试验结果进行比较,符合率约为77%。
2.5 临床样品检测 用建立的间接ELISA方法对来自云南省的70份样品进行检测,共检出阳性样品32份,阳性率为45.7%。
3 讨 论
环状病毒属成员的VP7蛋白在病毒粒子的包装及穿越昆虫宿主细胞膜的过程中起着重要的作用[6-7]。VP7蛋白整体疏水性较强,重组VP7蛋白更易形成包涵体,本研究经低温诱导,获得了可溶性表达的截短 VP7。VP7氨基端(1 aa~120 aa)和羧基端(250 aa~349 aa)主要参与VP7蛋白的三聚体化[8],因此疏水性较强。将这部分区域截去利于蛋白以可溶性式表达,降低了纯化难度。另外,非变性条件下纯化可能会一定程度上保留蛋白的构象表位,由于没有变性剂干扰ELISA反应,因此,与本实验室先前的研究结果相比[9],截短VP7蛋白包被量更低,而且检测效果更佳。
实验中用建立的ELISA方法对4种常见牛病的阳性血清进行检测,检测效价均低于0.32;而竞争抑制试验中IBAV可以抑制截短VP7蛋白对茨城病阳性血清的反应,证明了本方法具有较好的特异性。但由于实验条件所限,本研究未能对蓝舌病病毒(BTV)阳性血清进行检测。BTV可以感染牛,而且环状病毒属成员间VP7蛋白的保守程度较高,所以用BTV阳性血清对本ELISA方法的特异性进行检测是非常必要的。应用建立的间接ELISA方法对来自云南省的70份牛血清进行了检测,IBAV抗体阳性率为45.7%。
IBAD在我国还未见流行的报道,但在我国牛场中存在的抗体阳性牛表明,对IBAV的感染状况进行监测是有必要的。本研究应用表达的截短IBAV VP7蛋白初步建立了IBAV血清抗体的间接ELISA检测方法,为实现IBAV的快速诊断提供了一种可行手段。
[1]Iwata H,Manabe S,Yoshida A,et al.The complete nucleotide sequences of L3 and S7 segments of Ibaraki virus encoding for the major inner capsid proteins,VP3 and VP7[J].J Vet Med Sci,2001,63(1):73-78.
[2]Roy P.Bluetongue virus proteins[J].J Gen Virol,1992,73(12):3051-3064.
[3]Kweon C H,Kwon B J,Ko Y J,et al.Development of competitive ELISA for serodiagnosis on African horsesickness virus using baculovirus expressed VP7 and monoclonal antibody[J].J Virol Methods,2003,113(1):13-18.
[4]Mecham J O,Wilson W C.Antigen capture competitive enzyme-linked immunosorbent assays using baculovirus-expressed antigens for diagnosis of bluetongue virus and epizootic hemorrhagic disease virus[J].J Clin Microbiol,2004,42(2):518-523.
[5]Luo L,Sabara M I.Production of a recombinant major inner capsid protein for serological detection of epizootic hemorrhagic disease virus[J].Clin Diagn Lab Immunol,2005,12(8):904-909.
[6]Xu G M,Wilson W M,Mecham J M,et al.VP7:an attachment protein of bluetongue virus for cellular receptors in Culicoides variipennis[J].J Gen Virol,1997,78(Pt 7):1617-1623.
[7]Tan B H,Nason E,Staeuber N,et al.RGD tripeptide of bluetongue virus VP7 protein is responsible for core attachment to Culicoides cells[J].J Virol,2001,75(8):3937-3947.
[8]Grimes J,Basak A K,Roy P,et al.The crystal structure of bluetongue virus VP7[J].Nature,1995,373(6510):167-170.
[9]张文龙,刘光亮,王君伟,等.茨城病毒VP7蛋白基因的克隆表达及间接ELISA方法的初步建立[J].中国兽医科学,2007,37(11):921-925.

