猪繁殖与呼吸综合征病毒CH-1R株全基因组序列测定及遗传变异分析
石文达,刘永刚,王洪峰,王淑杰,马 平,徐 敏,武佳斌,蔡雪辉
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨150001)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种严重危害养猪业的传染病,表现为母猪繁殖障碍和仔猪及生长猪呼吸系统障碍[1]。1987年,美国首先报道了该病的发生。PRRS自20世纪90年代中期在我国发现以来,现已广泛存在,并且疫情较为严重[2-3]。Meulenberg等1993年首先完成了第一个欧洲型PRRS病毒(PRRSV)分离株Lelystad的全基因组克隆和测序,随后,美洲型分离株的全基因组测序相继被完成。Faaberg等2001年对商品化疫苗株RespPRRS MLV进行了全基因组测序,并与亲本株ATCC VR-2332的全序列进行了比较分析,数据显示只有ORF7基因和3'UTR区域未发生变异。而国内对致弱毒株的全基因组测序报道较少。
本研究通过对国内的PRRSV致弱疫苗株CH-1R株进行全基因组的克隆和测序,填补了我国PRRSV致弱毒株基因组信息数据的空白,同时对了解PRRSV致弱毒株的基因型及防制具有重要的意义。
1 材料和方法
1.1 病毒株 PRRSV为CH-1R株[4],由中国农业科学院哈尔滨兽医研究所保存[5]。本研究采用CH-1a致弱毒株的第171代,即CH-1R株。
1.2 菌种、质粒和试剂E.coliJMl09菌种由本室保存;克隆载体pMD18-T载体和常用工具酶及试剂盒购自宝生物技术工程(大连)有限公司。
1.3 引物设计 根据GenBank中登录的16株PRRSV全基因组序列,用Oligo 6.0软件经多重比较后,设计8对顺序重叠的特异性引物(如有需要,作者可以提供)。
1.4 病毒的增殖与RNA的提取 将病毒在Marc-145细胞中培养,收获病毒。按TRIzol LS试剂说明书操作方法,提取病毒总RNA。
1.5 CH-1R株基因片段的RT-PCR
1.5.1 基因编码序列的RT-PCR扩增 PRRSV CH-1R株的RT-PCR扩增按文献[6]进行。
PCR循环参数为:95℃5min;94℃1min、55℃1 min、72℃3 min,共30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测。
1.5.2 基因组5'末端和3'末端的RT-PCR扩增 采用TaKaRa RNA PCR Kit扩增病毒的3'末端; 以5'Full RACE Core Set试剂盒扩增病毒的5'末端。
1.6 RT-PCR产物的克隆和重组质粒的序列测定产物用胶回收试剂盒进行纯化,具体方法参见TaKaRa Agarose Gel DNA Purification Kit Ver.2.0。将经过回收的PCR产物连接转化,筛选阳性重组质粒,对其进行序列的测定。
1.7 序列测定与全基因组序列的拼接及分析为保证序列的准确性,每一个片段分别进行3次独立的克隆,由上海生物工程有限公司测序。根据SeqmanⅡ软件拼接PRRSV CH-1R株全基因组序列,同时应用DNAStar软件对CH-1R株与CH-1a株序列进行比对分析。
2 结 果
2.1 PRRSV CH-1R株的全基因组各片段的克隆和鉴定 应用所设计的引物,对CH-1R株分为8个片段进行RT-PCR扩增,扩增产物经过1%琼脂糖凝胶电泳,结果如图1所示。

2.2 全基因组序列测定及分析 经测序和拼接表明:PRRSV CH-1R株基因组全长15 424 nt;其中,含有9个开放阅读框架(ORF),5'端UTR之后是两个重叠的大 ORF,即 ORF1a和 ORFlb(约 11.9 kb),随后是 6个小的 ORF及 3'端 UTR和 poly(A)尾。全基因组组成及推导的氨基酸位置见表1。其基因组全序列已录入GenBank,登录号为EU807840。
2.3 5'端UTR和3'端UTR的序列分析 测序结果显示PRRSV CH-1R株与亲本株CH-1a株的5'UTR和3'UTR相对保守。其5'UTR仅存在1处(36位)核苷酸变异。3'UTR高度保守的8核苷酸序列中的仅第4位核苷酸由A突变为C。
2.4 病毒非结构蛋白序列分析 PRRSV的13个非结构蛋白基因由ORF1a与ORFlb编码的两个多聚蛋白裂解形成,即 Nsp1(包括 Nsp1α,Nsplβ)~Nsp12。CH-1R株 ORF1a长7 509 nt,共编码 2 501个氨基酸,CH-1R株与CH-1a株的ORF1a推导的氨基酸序列比较,共有18处变异;其中11处变异位于Nsp2蛋白、3处变异位于Nsp3蛋白、1处变异位于Nsp4、2处变异位于Nsp5蛋白及1处变异位于 Nsp7蛋白(图2)。
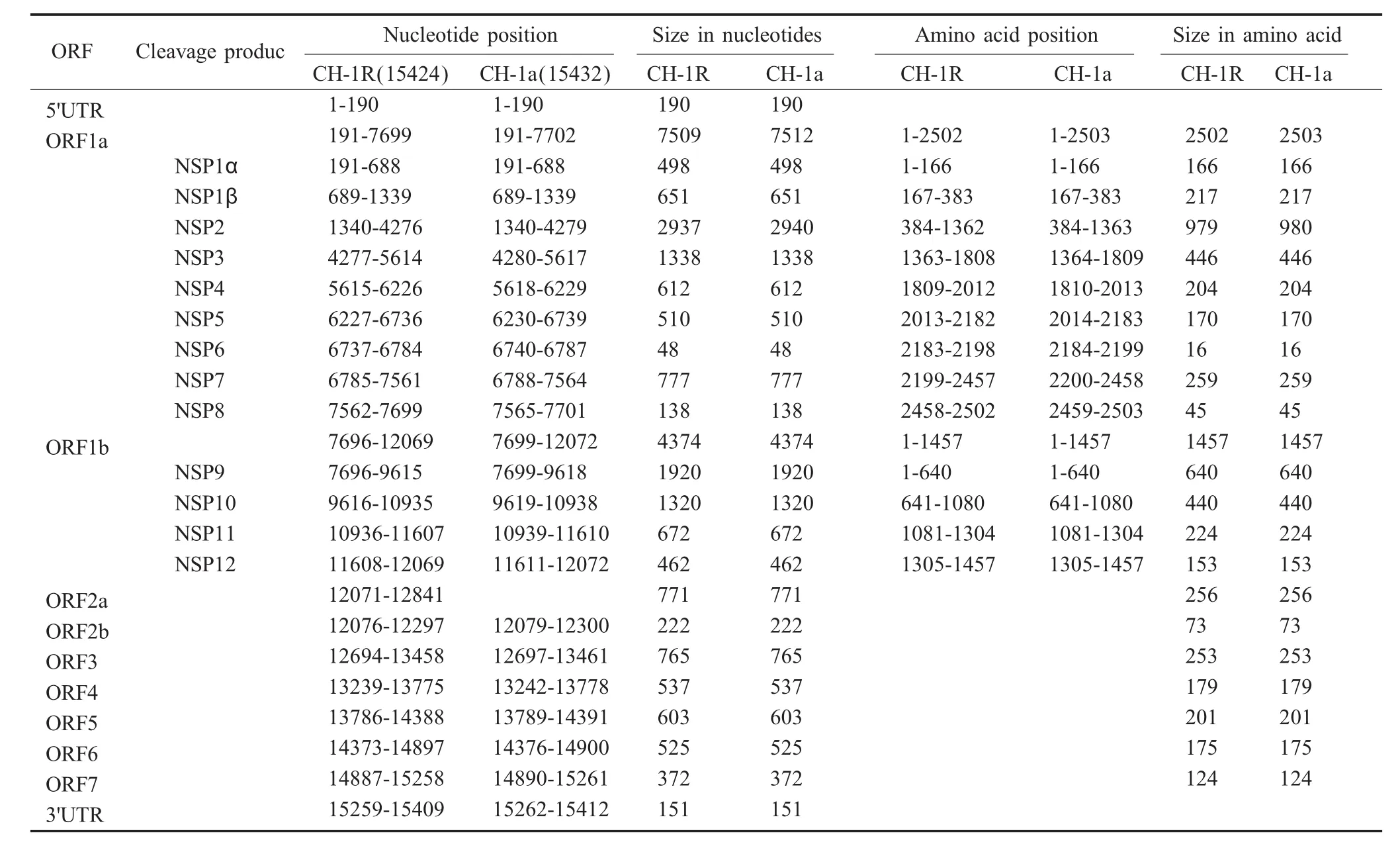
表1 PRRSV CH-1R株和CH-1a株病毒RNA的全基因组组成及编码蛋白Table 1 The comparison of genome organization and the encoded proteins by the CH-1R and CH-1a viral RNA
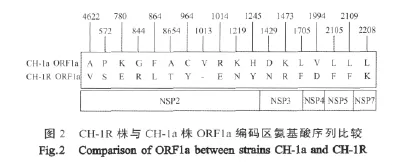
在动脉炎病毒属中,Nsp2为高度变异蛋白,通过CH-1R株与CH-1a序列比较显示,Nsp2存在多处核苷酸的改变;而且在2 191 bp~2 193 bp处发生了连续3个核苷酸的缺失,导致相应位置推导出的2个连续的氨基酸发生改变;其中位于第630位的氨基酸发生缺失以及R631E连续突变,另外还有9个其他位点的氨基酸序列均发生了变异。
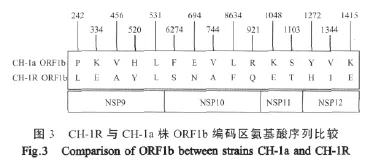
ORF1b编码的聚合蛋白,其中有3个推测的3C-like蛋白酶裂解位点,结果裂解产生4个小蛋白,即 NSP9和推定的裂解产物 NSP10,NSP11,NSP12。但在ORF1b中并没有推定的蛋白酶区域,同其它动脉炎病毒一样,其聚合蛋白可能是由ORFla所编码的蛋白酶来执行切割功能[7]。
CH-1R株与CH-1a株的ORF1b推导的氨基酸序列比较,共有15处发生了变异,其中有6处变异位于Nsp9蛋白、5处变异位于Nsp10蛋白、2处变异位于Nsp11、2处变异位于Nsp12蛋白。特别是在NSP9(456位)和NSP11(1 272位)蛋白的高度保守的区域氨基酸发生了改变(图3)。
2.5 病毒结构蛋白序列分析 比较CH-1R株与CH-1a株的各结构蛋白的推导氨基酸序列,共有17处变异,突变氨基酸及其位置详见表2。表中数据显示,在各结构蛋白序列中GP5和GP3变异较大,而相对保守M蛋白和N蛋白同样也发生了变异。通过对变异较大的GP5蛋白的序列比较显示,在5位、38位、146位氨基酸发生了变异。这3处氨基酸是否是毒力的决定位点,还有待进一步证实。

表2 结构蛋白毒力相关氨基酸的推测及变异分析Table 2 Comparison of predicted amino acids mutations of structural protein involved in pathogenisis
3 讨 论
RNA病毒的5'UTR区和3'UTR区与病毒基因组的复制、转录及mRNA的翻译密切相关[8]。通过序列比较,CH-1R株5'UTR区和3'UTR区各存在一处核苷酸变异,是否与病毒的细胞中的生长特性有关,有待进一步验证。非结构蛋白编码区的序列比较显示,ORF1b的序列变异不大,但ORF1a的变异相对较大,尤其是Nsp2的变异,同CH-la株相比,CH-1R株存在11处核苷酸的点突变,包括3个连续核苷酸发生缺失,导致推导出的2个连续氨基酸突变,即其中位于630位的氨基酸发生缺失以及R631E连续突变,因此我们推测R631可能是一个重要的毒力决定位点。
PRRSV编码的6种结构蛋白与亲本株序列比较共有11处氨基酸发生了变异。GP5、M和N是PRRSV的3种主要结构蛋白,美洲型毒株间GP5蛋白氨基酸的置换主要发生在邻近信号肽序列外区近端的高变区内(26 aa~39 aa)[9],将CH-1R株的高变区序列与CH-1a株序列进行比较,发现C5Y和L146Q位发生了变异。其中L146Q位于糖蛋白的疏水区,该氨基酸的变异有可能与病毒毒力的降低有关。
M蛋白在所有PRRSV结构蛋白中具有高度保守性,通过序列比较显示,CH-1R株只有Q16L发生了点突变。M蛋白与受体介导的病毒感染密切相关,可能在病毒装配和出芽中起重要作用,因此推测Q16L可能是毒力致弱的一个决定位点。
一般认为PRRSV和其它动脉炎病毒一样,整个复制过程只在胞浆中进行,而最新的研究表明N蛋白主要集中在细胞核和核仁中[10]。N蛋白有两个保守区分别位于10 aa~13 aa和41 aa~47 aa处,这2处氨基酸分别组成2个不同类型的核定位信号区(NLS:pat4和pat7)。CH-1R株与亲本株CH-1a的序列比较显示有两处发生变异(R9Q和K46N),K46N位于核定位信号区(pat7 NLS,41 aa~47 aa),该区的功能是引导N蛋白进入到细胞核中与宿主细胞纤维蛋白结合,同时具有与18S和28S的核糖体核糖核酸结合功能。而CH-1R株是在体外传代致弱获得的,是否由于宿主细胞的改变导致pat7 NLS区域的变异,进而改变了病毒的嗜性,还有待深入的研究。
综上所述,CH-1R株的变异具有规律性,ORF1a基因的R631E、ORF5基因的 L146Q、ORF6基因的Q16L和ORF7基因的K46N这4处氨基酸在CH-1R株的致弱过程中发生的变异是否与毒力的减弱有关,还有待于进一步的研究。
[1]Allende R,Kutish G F,Laegreid W,et al.Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J].Arch Virol,2000,145,1149-1161.
[2]郝晓芳,周艳君,童光志,等.高致病性猪繁殖与呼吸综合征病毒RT-PCR鉴别诊断方法的建立[J].中国兽医学报,2007,29(5):323-326.
[3]蔡雪辉,李艳华,刘永刚,等.PRRS疫苗研究进展及PRRS的综合防制[J].畜牧兽医科技信息,2004,(4):49-51.
[4]郭宝清,陈章水,刘文兴,等.从疑似PRRSV流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,18(2):1-4.
[5]王洪峰,蔡雪辉,刘永刚,等.猪繁殖与呼吸综合征活疫苗对仔猪的安全性试验[J].中国预防兽医学报,2005,28(3):341-343.
[6]仇华吉,郭宝清,童光志,等.猪繁殖-呼吸道综合征病毒(PRRSV)CH-la株的基因型鉴定[J].中国兽医学报,1998,1(2):118-121.
[7]Allende R,Lewis T L,Lu Z,et al.North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions[J].Gen Virol,2002,80:307-315.
[8]Han J,Wang Y,Faaberg K S,et al.Complete genome analysis of RFLP 184 isolates of porcine reproductive and respiratory syndrome virus[J].Virus Res,2006,122(1-2):175-182.
[9]Mardassi H,Mounir S,Gagnon C A,et al.Molecular analysis of the ORF3-7 of porcine reproductive and respiratory syndrome virus,Quebec reference strain[J].Arch Viro1,2005,140:1405-1418.
[10]Niu Y M,Pirzadeh B,Lai S T,et al.A nuclear export signal and phosphorylation regulate Dok1 subcellular localization and functions[J].Bioessays,2006,26(11):288-301

