MMP-2、12在兔脊髓损伤中的表达及与损伤程度的相关性研究
翟文亮,陈志文,王兴盛,练克俭,周 亮
基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类与神经障碍后炎症反应、伤口愈合、细胞凋亡以及其他病理过程密切相关的蛋白水解酶家族[1],近年来在脊髓损伤,尤其是继发性脊髓损伤中的作用越来越受到学者们的关注。本实验旨在观察兔在不同时间点损伤段脊髓组织中MMP-2、12表达的变化,并对其与损伤程度的相关性进行探讨,以阐明MMPs在脊髓损伤发展过程中的作用。
1 材料和方法
1.1 主要实验试剂和仪器
Trizol(美国Gibco公司),Taq酶、RNA酶抑制剂、TBE、Loading buffer(上海捷兰生物技术有限公司),荧光定量专用Taq酶(美国Promega公司),免疫组化检测试剂盒EnVisionTM Two-step Histostaining Reagent(丹麦DAKO公司),MMP-2 rabbit多克隆抗体(武汉博士德生物技术公司);DY-50IB型电泳仪、H6-I微型电泳槽(上海琪特分析仪器有限公司),基因扩增仪TC-96/T/H(a)(杭州大和热磁电子有限公司),荧光定量PCR仪(Applied Biosystems 7000 Real Time PCR System),凝胶成像系统GIS-2008(上海天能科技有限公司)。
1.2 实验模型与分组
健康新西兰大耳白家兔135只[福建省动物实验中心提供,合格证号为SYXK(军)2008-047],体重2.5~3.0 kg,雌雄不拘。随机分成3组:全瘫组(A组)、不全瘫组(B组)和假手术对照组(C组),每组45只。A、B组实验动物分别以3%戊巴比妥钠30 mg/kg静脉全麻后,俯卧位固定于手术台上,备皮、消毒,以T8棘突为中心作纵形切口,长度约2 cm,向两侧推开骶棘肌,咬除T7~T8棘突、椎板,暴露脊髓8 mm×6 mm,安装自制Allen打击架,打击导管对准打击中心,并使之垂直紧贴硬脊膜,打击头径2 mm,高度4 cm。A组用重20 g(打击势能约为80 gcm)、B组用重10 g(打击势能约为40 gcm)打击致伤脊髓后关闭切口。对照组仅行椎板切除术。术后前3日青霉素20万单位/d肌注,每日2次,定时挤压下腹排尿3次/d至自主排尿恢复。
1.3 运动功能评分
分别于术前1 h,术后麻醉清醒后6 h,损伤后24 h、48 h、7 d、14 d各组家兔随机抽取7只放于开阔空间内观察动物双后肢运动功能,采用改良Tarlov评分法进行评价:0分:完全瘫痪,针刺下肢无反应;1分:完全瘫痪,针刺下肢有反应,但肢体不能活动;2分:肢体可活动,但不能站立或站立不稳;3分:可站立,但无法行走;4分:可行走数步,但不能稳定;5分:能缓慢行走,但不灵活;6分:正常行走。
1.4 标本采集和组织学观察
3 组实验动物分别于术后6 h、24 h、48 h、7 d、14 d各时间点各取5只,静脉注射麻醉后按原手术切口切开,取出距损伤中心区(对照组取假手术区)上下宽约0.5 cm、长约1.5 cm的脊髓组织,取其1/3(长约0.5 cm)以4%多聚甲醛固定,梯度酒精脱水、二甲苯透明、石蜡包埋,4 μm连续切片,苏木精—伊红染色,进行组织学观察。剩余2/3的骨髓组织(长约1.0 cm)标记后液氮冻存备用。
1.5 MMP-2免疫组织化学染色法检测
根据实验设计按不同的时间点将取出备用的脊髓组织(长约1.0 cm)置于10%中性缓冲福尔马林(pH 7.4)固定液中固定,采用辣根过氧化物酶(HRP)标记的链霉卵白素试剂盒(博士德生物工程有限公司)染色(SP法),具体步骤如下:(1)常规石蜡包埋切片;(2)石蜡切片常规脱蜡;(3)3%过氧化氢,室温反应10 min,蒸馏水漂洗2 min×3次;(4)将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾后断电冷却,反复1~2次,0.01 mol/L PBS洗涤2 min × 3次;(5)加正常山羊血清封闭液,室温下孵育2 h;(6)滴加一抗MMP-2兔多克隆抗体(博士德生物工程有限公司,浓度1:100),37℃孵育过夜;(7)滴加生物素化羊抗兔 IgG,室温下反应20 min;(8)滴加HRP工作液,在室温下反应20 min,0.01 mol/L PBS洗涤5 min× 3次;(9)DAB显色,苏木素复染,中性树脂封片。阴性对照实验采用替代法,用PBS代替一抗、二抗及HRP工作液做上述操作。免疫组化检测MMP-2的表达结果判读:参照试剂盒说明记录每张切片的阳性细胞数。阳性细胞胞浆棕黄色染色,计数高倍视野内染色阳性细胞(每个标本选5张切片,在200倍光镜下随机选取6个视野,每个时间点共计30个视野),计算阳性率,以均数±标准差表示。
1.6 MMP-12 Real-Time PCR荧光定量检测
取材的时间点与MMP-2组相同。实施荧光定量PCR按照试剂盒说明操作:(1)组织总RNA提取。(2)cDNA 的合成:引物 MMP-12 Loaded-504序列5'-TTT TGA TGG CAG AGG TGG TG-3'和MMP-12 Loaded-757序列5'-TGC CAC GTA TGT CAT CAG CA-3'。其反应条件为:94℃预变性2 min,然后94℃变性30 s,58℃退火 45 s,72℃延伸1 min,进行29个循环。(3)实时荧光定量PCR扩增目的基因:GAPDH的引物上、下游分别是5'-ACC ACA GTC CAT GCC ATC AC-3'和5'-TCC ACC ACC CTG TTG CTG TA-3'。反应条件:94℃预变性2 min,94℃变性30 s,61℃退火45 s,72℃延伸1 min,进行29个循环。扩增反应结束后,利用图像分析系统测定各条带杂交信号强度并与内参照GAPDH条带相比,计算出各mRNA的相对表达水平。
1.7 统计学方法
采用SPSS 13.0软件,所有计量资料以均数±标准差(±s)表示,多个样本均数比较用方差分析,两两比较采用SNK-q检验,相关性分析采用Pearson积差法进行相关分析。P<0.05认为差异有统计学意义。
2 结果
2.1 组织学观察结果
伤后6 h,A组损伤节段灰质内有大片出血灶,神经细胞肿胀、破坏,大量炎性细胞浸润(图1A);伤后24 h,大量神经细胞坏死,小胶质细胞吞噬现象明显(图1B);伤后7 d,损伤中心坏死空腔形成,边缘有大量胶质细胞(图1C);伤后14 d,炎性反应更加明显。B组损伤后各时间点上述病理改变均较A组明显减轻(图2)。C组脊髓组织各形态结构完整,各层细胞排列整齐,无水肿。
2.2 兔后肢运动功能评分
3 组改良Tarlov评分在伤后各时间点相比较,差异具有统计学意义(P<0.05),A组伤后同时间点的运动功能评分均低于B组(P<0.05),C组各时间点的评分维持在正常恒定水平(表1)。
2.3 MMP-2、12表达
A、B、C 3组各时间点均有MMP-2 mRNA表达,C组免疫组化染色未见MMP-2高表达(图3),且各时间点的表达较为恒定(表2)。伤后24 h A、B组MMP-2表达达到高峰(图4),伤后7 d A、B组MMP-2仍有高表达(图5)。伤后同时间点比较,A、B组MMP-2表达明显高于C组,差异具有统计学意义(P<0.05)。A组MMP-2表达在伤后24 h、48 h、7 d 3个时间点高于B组,差异具有统计学意义(P<0.05);而两组在伤后6 h、14 d两个时间点比较,差异无统计学意义(P>0.05)。MMP-12的表达结果与MMP-2类似(表3)。
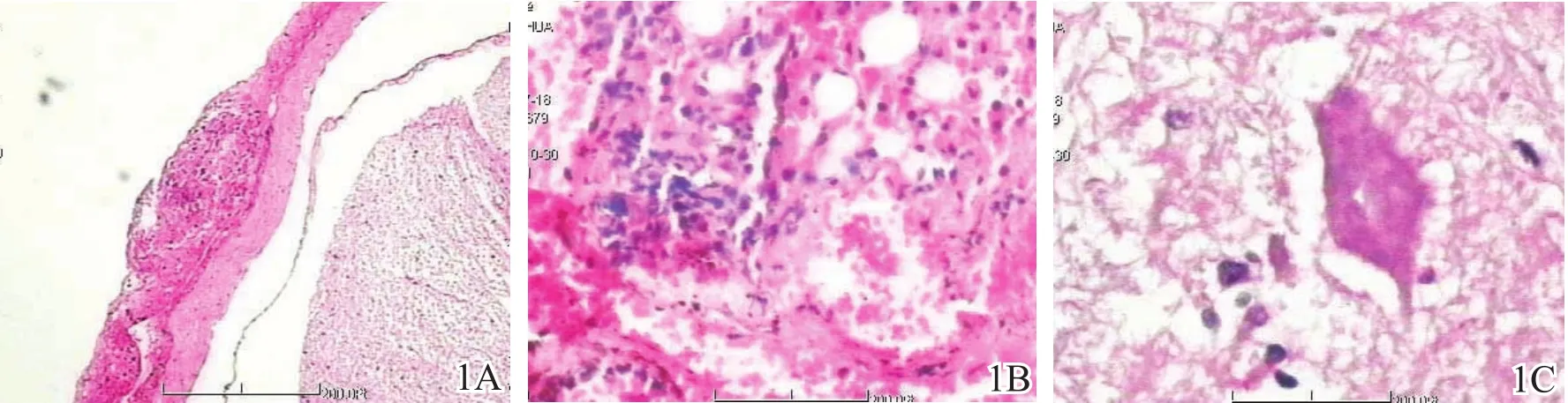
图1 全瘫组脊髓损伤后组织学观察
表1 三组改良Tarlov评分比较(n=42,±s)

表1 三组改良Tarlov评分比较(n=42,±s)
注:*与C组比较,P<0.05;#与B组比较,P<0.05
组别A组B组C组F值P值伤后1 h 6.06.06.00.0001.000伤后6 h 0.0*#2.1±0.2*5.2±0.175.8740.000伤后24 h 0.0*#1.9±0.2*5.6±0.181.2760.000伤后48 h 0.0*#2.6±0.1*5.9±0.089.2310.000伤后7 d 1.0±0.1*#3.1±0.1*6.09.6920.001伤后14 d 1.4±0.1*#3.4±0.2*6.08.5640.002
图2 不全瘫组脊髓损伤后组织学观察
表2 急性脊髓损伤后各时间点动物MMP-2阳性细胞表达率(%,n=25,±s)

表2 急性脊髓损伤后各时间点动物MMP-2阳性细胞表达率(%,n=25,±s)
注:*与C组比较,P<0.05;#与B组比较,P<0.05
组别A组B组C组F值P值伤后6 h 28.7±0.6*16.0±0.5*6.1±2.53.3100.121伤后24 h 61.0±1.2*#45.1±0.9*7.2±1.96.1450.014伤后48 h 57.5±0.7*#42.4±0.5*6.6±0.212.8850.000伤后7 d 51.5±0.6*#39.7±0.5*6.4±0.111.6080.00144.9±1.2*36.2±0.7*6.5±0.23.0630.123伤后14 d
表3 急性脊髓损伤后各时间点动物MMP-12实时荧光定量CT值(%,n=25,±s)
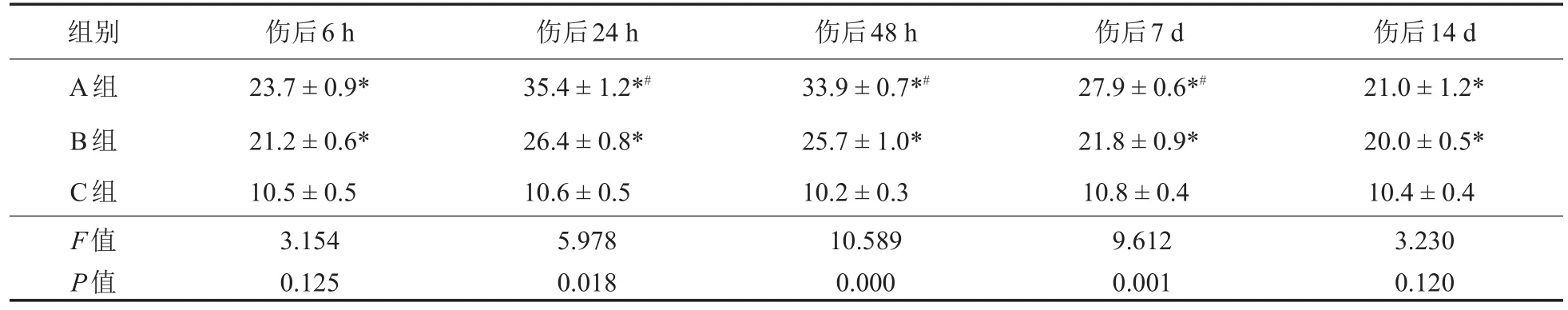
表3 急性脊髓损伤后各时间点动物MMP-12实时荧光定量CT值(%,n=25,±s)
注:*与C组比较,P<0.05;#与B组比较,P<0.05
组别A组B组C组F值P值伤后6 h 23.7±0.9*21.2±0.6*10.5±0.53.1540.125伤后24 h 35.4±1.2*#26.4±0.8*10.6±0.55.9780.018伤后48 h 33.9±0.7*#25.7±1.0*10.2±0.310.5890.000伤后7 d 27.9±0.6*#21.8±0.9*10.8±0.49.6120.001伤后14 d 21.0±1.2*20.0±0.5*10.4±0.43.2300.120
2.4 脊髓损伤程度与MMP-2阳性细胞表达率及MMP-12荧光定量CT值相关性分析
脊髓损伤程度与MMP-2阳性细胞表达率及MMP-12荧光定量CT值相关性分析采用Pearson积差相关分析(图6,7)。脊髓损伤后A、B组不同时间点MMP-2阳性细胞表达率与兔改良Tarlov评分的相关系数为r=-0.887,P=0.000;A、B组不同时间点MMP-12实时荧光定量CT值与兔改良Tarlov评分的相关系数为r=-0.841,P=0.002。说明MMP-2阳性细胞表达率和MMP-12实时荧光定量CT值与兔运动功能评分呈负相关。
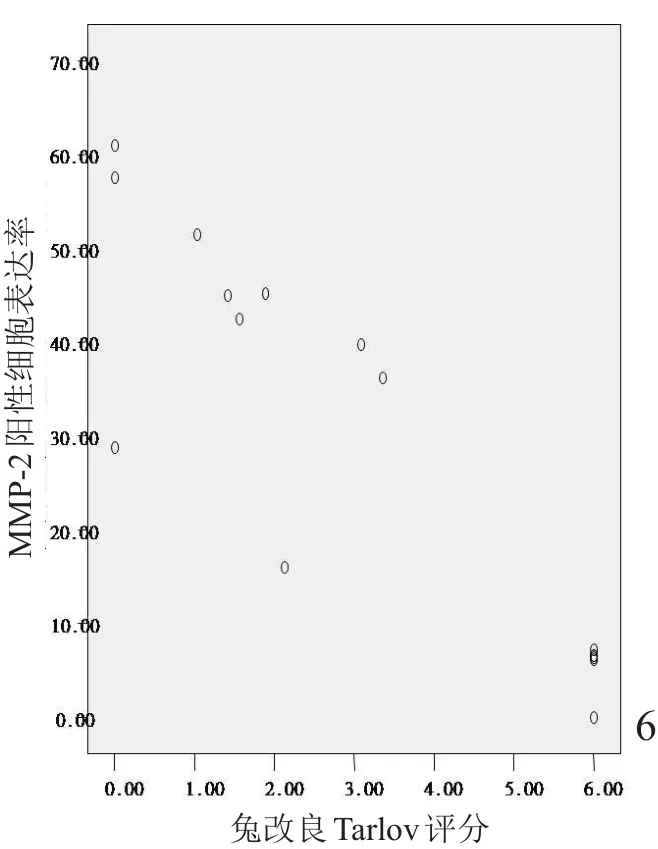
图6 MMP-2阳性细胞表达率与兔改良Tarlov评分的关系

图7 MMP-12实时荧光定量CT值与兔改良Tarlov评分的关系
3 讨论
作为高致残疾病之一,急性脊髓损伤(acute spinal cord injury,ASCI)后的神经功能修复一直是医学界极具挑战性的难题。目前针对脊髓损伤的相关研究主要集中于ASCI后脊髓内继发性病理损伤的预防和治疗。研究认为,多种因素参与了脊髓的继发性损伤:局部缺血和再灌注损伤、血—脊髓屏障破坏、自由基生成、脂质过氧化、细胞凋亡以及炎症介质、一氧化氮、内皮素、血管内皮生长因子/渗透性因子、血小板活化因子、兴奋性氨基酸等的作用。继发性脊髓损伤正是上述神经生化机制和血管机制相互关联、不断恶化的过程。故其治疗主要针对ASCI后出血、水肿、微循环障碍、局部组织自由基生化改变等一系列继发性损伤。
MMPs是一组锌依赖的蛋白水解酶,具有降解多种细胞外基质(excellular matrix,ECM)成分(如胶原、层粘素、明胶、弹性硬蛋白、粘连蛋白及蛋白多糖等)的功能,因此对需要基质重建的生理过程如生长发育、创伤愈合及修复等起到重要作用[2];此外,MMPs还与生理机能调节、信号发送、血管生成以及细胞运动等密切相关,在肿瘤转移、中枢神经系统损伤(如多发性硬化症、中风等)、AIDS及创伤等多种疾病的发展过程中有异常表达[3-5]。
Agrawal等[6]认为,MMPs对正常中枢神经系统的发育过程起到了调节作用,但当出现神经障碍时,MMPs成员则表现为异常的表达上调。近年来大量基础研究表明,MMPs参与了脊髓损伤后的多个病理过程[7-11]。ECM由细胞间的多种蛋白质和非蛋白质组成,构成细胞生活的微环境,具有支持、连接、营养和防御等生理作用,而血管基底膜与ECM是维持血—脊髓屏障完整的重要结构,MMPs可以通过降解ECM成分使血—脊髓屏障受损,通透性增加,毛细血管内的水分与血浆蛋白外渗,致细胞间隙内水分增多,进而形成脊髓水肿[10]。研究还证实,MMPs在脊髓损伤后的炎症反应、细胞凋亡等事件中扮演了重要角色[1,11]。MMP-2、12是MMPs的重要成员,在正常组织中无表达或低表达,在损伤后脊髓组织中呈高表达。Buss等[12]的相关研究显示,MMP-1、2、9、12均参与人类的继发性脊髓损伤过程,认为它们的高表达可导致蛋白质破裂、中性白细胞和巨噬细胞浸润而引发破坏性炎性事件,并通过增强血—脊髓屏障通透性来进一步加重脊髓损伤。de-Castro等[8]报道鼠脊髓损伤后MMP-2、9的高表达,MMP-9的活性在12~24 h达到高峰,致伤后5 d MMP-2仍维持在较高水平,因而推测MMP-2、9对脊髓损伤后ECM崩溃具有促进作用。Dang等[11]发现,MMP-2转录在实验动物脊髓损伤后显著上调,而抑制MMP-2/MMP-9活性可使脊髓损伤区域内细胞凋亡明显减少,提示伤后MMP-2的上调伴随着神经元和神经胶质细胞的凋亡,抑制细胞凋亡可通过降低MMP-2、9活性来实现,这一结果支持脊髓损伤后MMP-2导致细胞凋亡的推论,证实脊髓损伤治疗干预中应用MMP-2抑制剂抑制凋亡进而减轻脊髓损伤程度的可行性。本实验的前期研究发现,MMP-2、12在急性脊髓损伤后的表达不仅存在量的显著性不同,且定位、时空分布同样存在差异[13];本实验对兔ASCI后MMP-2、12的表达及与损伤程度、损伤后时间点的相关性观察结果亦显示,脊髓损伤后6 h MMP-2、12表达增加,伤后24 h达高峰,并持续高水平表达至第7天,假手术组则维持在较恒定的低水平;且MMP-2、12的表达水平与脊髓损伤的程度呈负相关,揭示了MMP-2、12在ASCI后继发性损伤发展过程中的重要作用,同时也表明,ASCI后早期应用MMPs抑制剂下调MMP-2及MMP-12的表达水平可能会进一步减轻脊髓继发性损伤的程度。
1 Veeravalli KK,Dasari VR,Tsung AJ,et al.Human umbilical cord blood stem cells upregulate matrix metalloproteinase-2 in rats after spinal cord injury[J].Neurobiol Dis,2009,36(1):200-212.
2 Yong VW,Power C,Forsyth P,et al.Metalloproteinases in biology and pathology of the nervous system[J].Nat Rev Neurosci,2001,2(7):502-511.
3 Egeblad M,Werb Z.New functions for the matrix metalloproteinases in cancer progression[J].Nat Rev Cancer,2002,2(3):161-174.
4 Webber CA,Hocking JC,Yong VW,et al.Metalloproteases and guidance of retinal axons in the developing visual system[J].J Neurosci,2002,22(18):8091-8100.
5 Hartung HP,Kieseier BC.The role of matrix metalloproteinases in autoimmune damage to the central and peripheral nervous system[J].J Neuroimmunol,2000,107(2):140-147.
6 Agrawal SM,Lau L,Yong VW.MMPs in the central nervous system:where the good guys go bad[J].Semin Cell Dev Biol,2008,19(1):42-51.
7 Duchossoy Y,Arnaud S,Feldblum S.Matrix metalloproteinases:potential therapeutic target in spinal cord injury[J].Clin Chem Lab Med,2001,39(4):362-367.
8 de-Castro RC Jr,Burns CL,McAdoo DJ,et al.Metalloproteinase increases in the injured rat spinal cord[J].Neuroreport,2000,11(16):3551-3554.
9 Wells JE,Rice TK,Nuttall RK,et al.An adverse role for matrix metalloproteinase 12 after spinal cord injury in mice[J].J Neurosci,2003,23(31):10107-10115.
10 周华,刘华,黄坚.基质金属蛋白酶-9与脊髓损伤后脊髓水肿的关系[J].中国脊柱脊髓杂志,2007,17(1):59-61.
11 Dang AB,Tay BK,Kim HT,et al.Inhibition of MMP2/MMP9 after spinal cord trauma reduces apoptosis[J].Spine,2008,33(17):E576-E579.
12 Buss A,Pech K,Kakulas BA,et al.Matrix metalloproteinases and their inhibitors in human traumatic spinal cord injury[J].BMC Neurol,2007,7:17.
13 王兴盛,练克俭,翟文亮,等.多西环素对兔急性脊髓损伤后MMP-2、12表达及神经功能的影响[J].中国骨与关节损伤杂志,2009,24(3):225-227.

