大鼠正常与退变性髓核突出导致神经根性疼痛的对比研究
张奎渤,张加芳,郑召民,刘 辉,张劲军,王建儒,王太平,刘先国
椎间盘退变及其继发的一系列疾病是导致慢性腰腿痛的重要原因[1,2]。目前,以修复/再生退变椎间盘为目的的各种生物治疗策略,如注射生长因子、基因治疗、细胞移植(髓核细胞/干细胞)等方法是国内外该领域的研究热点。然而,为了验证各种治疗手段的效果,现有的绝大部分研究均是将椎间盘生化成分的改变或影像学上的改善作为标准,缺乏与临床症状密切相关的、更具实际意义的评价方法[3,4]。在本研究中,我们分别利用大鼠正常与退变的椎间盘髓核组织,建立实验性髓核突出致神经根性疼痛的动物模型,通过动物的行为学测试与免疫组化分析,探讨椎间盘退变与疼痛之间的直接关系,并为验证各种生物治疗的效果提供一个较好的疼痛评价模型。
1 材料与方法
1.1 实验动物选择与分组
健康成年雄性Sprague-Dawley大鼠72只,体重200~250 g,由中山大学实验动物中心提供。为保持大鼠的生物节律,饲养室每天早晨8:00至20:00开灯,其余时间熄灯。行为学测试均在9:00至18:00之间进行。所有实验操作(包括饲养条件)严格按照实验动物研究纲要及所在单位动物伦理委员会的要求实施完成。
采用随机方法将实验动物分为4组:空白对照(NC)组(n=18),假手术对照(SC)组(n=19),正常髓核(N-NP)组(n=16),退变髓核(P-NP)组(n=19)。每组中各有8只用于行为学测试,8只用于免疫组化取材分析,其余用于椎间盘退变病理学染色与MRI评价。
1.2 椎间盘退变模型的建立与评价
在P-NP组,经腹腔注射戊巴比妥(50 mg/kg)麻醉后,触诊大鼠尾椎根部,依次定位Co 4/5及Co 8/9椎间隙并标记。无菌条件下,在两部位分别做一个长约0.5 cm的小切口,切开皮肤、皮下组织显露椎间盘,用21G注射器针头平行于终板刺入纤维环,以尖端夹持的血管钳控制深度在3 mm左右,刺入后停留数秒钟拔出,缝合皮肤。SC组仅切开显露不做穿刺。正式实验前反复练习椎间隙定位及穿刺等操作,并以X线透视核实,尽量避免失误。
2 周后,分别应用MRI及苏木精—伊红染色评价椎间盘退变的发生。其中MRI影像学评估采用1.5 T MAGNETOM SYMPHONY QUANTUM型磁共振成像仪配合动物专用线圈(SIEMENS,德国)。病理学检查则在取材后将标本按常规石蜡包埋,4 μm纵向切片,常规苏木精—伊红染色。
1.3 实验性髓核突出模型的建立
麻醉方法同上,大鼠取俯卧位,无菌条件下切开皮肤和皮下组织,紧贴棘突左侧分离椎旁肌,显露L5~S1水平左后方结构,手术显微镜下行L5左侧半椎板及L5~L6小关节切除,小心显露L5左侧神经根及背根神经节(dorsal root ganglion,DRG)。在大鼠尾部做切口,分别取出两个节段的椎间盘髓核组织,置于显露的神经根及DRG处,注意小心操作勿损伤神经根及脊髓。髓核为胶冻样物质,可轻柔粘附于神经表面,无需固定。然后逐层关闭切口。N-NP组移植的是正常尾椎间盘髓核,P-NP组移植的是行尾椎根部纤维环穿刺后的髓核,而SC组仅作显露与缝合。
1.4 行为学测试与免疫组化分析
行为学测试由独立于以上手术的观察者完成,于手术前1天及术后1、4、7、10、14及21天分别测量大鼠后肢的机械性刺激与热刺激阈值。机械性刺激测试前将大鼠置于观察箱中适应20 min。采用专用的von Frey纤维笔,强度共有10个等级(3.61,3.84,4.08,4.17,4.31,4.56,4.74,4.93,5.07,5.18 g)。实验者手持纤维笔分别刺激大鼠后爪中心部位,以中等强度的4.31 g起始,若无反应,则增大一级刺激强度;若出现缩足反射,则减小一级刺激强度。2次刺激之间至少间隔5 s以上。分别记录测量值后,通过Chaplan等[5]的计算方法得出50%撤足阈值(50%withdrawal threshold):
50 %withdrawal threshold=(10[Xf+κδ])/10000式中Xf=最末次测试强度的对数值;κ值根据撤足反应模式查表[5]得出;δ=10支von Frey纤维笔之间对数差值的均值。
热刺激阈值测定是通过热平板测试仪(Plantar Test 7370,Ugo Basile,意大利)检测大鼠后肢足跟部皮肤对热伤害性刺激的反应。测试前将大鼠放置于平板测试仪的有机玻璃箱内适应约5 min,测试时将可移动的热辐射光源通过透明玻璃板输出红外线热刺激并聚焦于大鼠后肢足跟部。热刺激强度以正常大鼠光照15~20 s出现撤足反应为宜。在大鼠撤足的瞬间或人为设定热刺激34 s时(为防止长时间热刺激造成组织损伤),热光源自动关闭,计时器自动停止,可准确记录大鼠热刺激撤足潜伏期(精确度达0.1 s)。以5 min的时间间隔对双侧后足各测3次,3次撤足潜伏期的均值用于最后的统计学分析。
手术后第4天及第14天,各组分别进行多聚甲醛灌注取材,取出L5左侧DRG组织,甲醛固定后行常规石蜡包埋,连续冠状切片(厚度6 μm),每例随机取4张切片行免疫组化分析。主要步骤包括:(1)切片常规脱蜡至水;(2)3%双氧水封闭15 min;(3)微波修复抗原后以1.5%兔封闭血清37℃下孵育30 min;(4)兔抗大鼠TNF-α多克隆抗体(1:100,Santa Cruz,美国)4℃ 下孵育过夜;(5)生物素化羊抗兔IgG抗体37℃孵育20 min。DAB溶液光镜下控制显色10 min,苏木素轻度复染。漂洗后脱水、透明,中性树脂封片,在Olympus IX 70显微镜下观察。计数恒定面积内(×400,取5个视野)TNF-α阳性细胞数目。
1.5 统计学方法
采用SPSS 11.0统计软件进行统计学处理,数据以均值±标准差表示,对同一实验组中的行为学测试数据采用Wilcoxon秩和检验;对同一时间点不同组之间的比较采用Mann-Whitney U-test。不同组间免疫组化染色分析结果运用单因素方差分析和SNK-q检验。P<0.05认为差异有统计学意义。
2 结果
2.1 P-NP组尾椎椎间盘退变的评估结果
与上下椎间隙及SC组相比,P-NP组行纤维环穿刺后两周,MRI显示在T2加权像上穿刺椎间盘信号强度显著降低(图1),表现为“黑盘征”,提示椎间盘退变的发生。组织学观察示穿刺椎间盘纤维环组织结构紊乱,部分切面可见穿刺针道,裂隙呈向心性排列。髓核组织面积较NC组(图2A)及SC组(图2B)明显缩小,一般为对照组髓核的一半左右;细胞数目减少,基质略有淡染(图2C),提示P-NP组纤维环穿刺后尾椎椎间盘存在明显退变过程。
2.2 行为学测试结果
所有手术组大鼠在术后1天均恢复了正常的运动功能,未见明显异常步态或瘫痪的发生。机械刺激阈值结果(图3)显示:NC组和SC组动物未出现明显的痛觉过敏现象;而N-NP组和P-NP组大鼠手术侧(同侧)后肢机械刺激阈值均明显降低,且这种痛觉过敏现象一直持续到术后第10~14天逐渐消失(图3A)。同时,通过对术后某一时间点的组间对比发现,术后第1、4、7天,移植退变髓核的P-NP组大鼠机械性阈值比N-NP组更低(P值分别为0.038,0.021和0.038,均 <0.05),表明该组的机械性痛觉过敏程度更重。手术对侧未见规律性变化(图3B)。
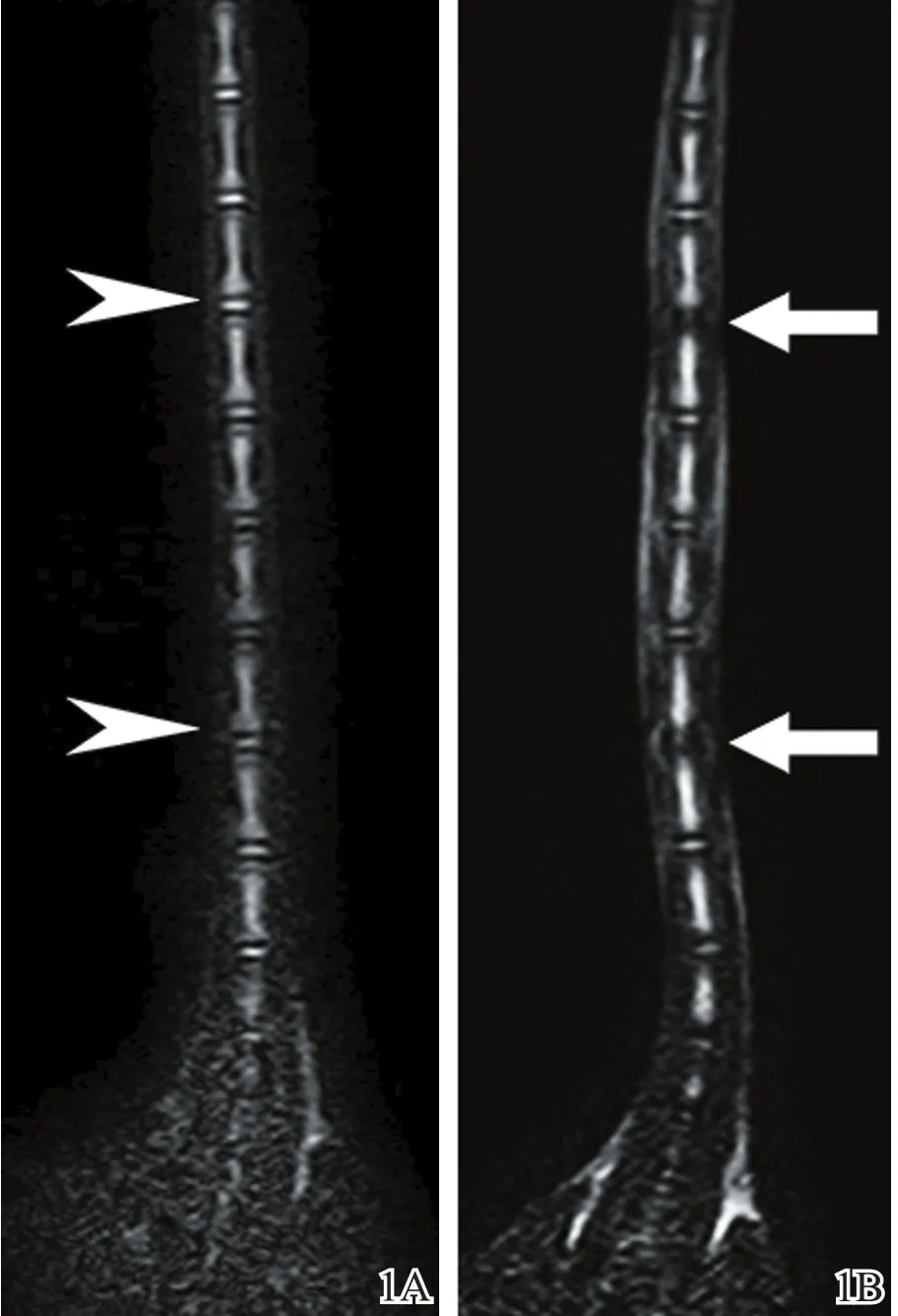
图1 大鼠尾椎MRI(T2加权像)
与机械性刺激的结果不同,术后热刺激阈值各组均未呈现规律性变化。仅手术侧下列时间点热刺激阈值与术前比较差异具有统计学意义(图4A):P-NP组:术后1天(P=0.017);N-NP组:术后第4天(P=0.025)、第10天(P=0.042)。手术对侧未见热刺激阈值的明显降低(图4B)。
2.3 免疫组化结果
NC组和SC组切片阳性染色很少(图5A,5B),而N-NP组和P-NP组于术后第4、14天均观察到DRG中TNF-α表达水平显著升高,强阳性染色主要位于神经元胞浆,分布较均匀(图5C,5D);间质细胞也有部分阳性表现。对N-NP组和P-NP组进行比较,两组在两个时间点的TNF-α阳性数目均无统计学差异(图6,第4天P=0.252,第14天P=0.146)。

图4 手术前后热刺激阈值(50%缩足阈值)的变化

图5 髓核移植术后L5左侧DRG的TNF-α免疫组化结果

图6 各组TNF-α阳性细胞数比较
3 讨论
腰椎间盘退变及其继发的系列病理改变是引起下腰痛(low back pain)的主要原因。在椎间盘退变的研究中,探讨退变与疼痛之间的关系是一个重要的发展方向。对患者而言,真正需要解决的是疼痛问题,而不仅仅是为了改善椎间盘的基质成分以及恢复正常MRI信号强度[3]。因此,有关椎间盘退变的基础研究,包括动物模型建立、各种生物疗法的疗效评估等只有与疼痛相联系时才更具实际意义。然而,人类感知疼痛的复杂性决定了难以利用动物模型进行精确模拟,特别是评价类似于腰痛类型的轴性疼痛(axial pain)则更加困难,缺乏量化的衡量方法[6]。目前,行为学测试手段已广泛应用于神经生理与疼痛研究领域[6,7],本实验就是利用实验性椎间盘髓核突出建立神经根性疼痛模型,通过测量模型大鼠后肢对机械与热刺激的反应阈值进行神经根性疼痛评估。
在本实验中,我们首先采用针刺法建立大鼠尾椎椎间盘退变模型,以获得退变的髓核组织。大鼠尾椎椎间盘显露方便、操作简单且成本低,适合样本较多的筛查实验选用。Lotz及Iatridis等[8,9]利用持续机械压迫法建立尾椎椎间盘退变模型,但器械装置复杂,实验时间较长(一般需数个月)。采用纤维环穿刺法诱致椎间盘退变模型已在兔、山羊及猴等动物体内成功建立[9-12],操作简单,可控性强,是目前应用最广泛且效果明确的一种方法[13]。结合之前的文献报道,我们在大鼠尾部做小切口暴露椎间盘后,使用限深的21G穿刺针穿刺纤维环,2周后MR和病理学观察均证实椎间盘已发生退变。
我们分别将正常以及退变的尾椎间盘髓核组织移植到大鼠左侧腰5神经根的DRG处,通过测量手术后不同时间点动物后肢对机械性刺激及热刺激的反应阈值,对比分析了该模型中神经根性疼痛的发生过程。事实上,Olmarker、Hou等[14,15]报道了利用大鼠实验性髓核突出/压迫模型评价其所致的神经病理性疼痛的实验研究,但移植物均为正常自体或异体椎间盘组织。在本实验中我们发现,N-NP组和P-NP组移植的椎间盘组织均可引起术后同侧肢体机械性刺激阈值明显下降,即发生了机械性痛觉过敏现象;该现象在术后第一天即达到峰值,以后逐渐缓慢恢复,持续至术后2周左右。值得注意的是,术后第1、4、7天,P-NP组大鼠术侧下肢机械刺激阈值比N-NP组为低,表明退变椎间盘组织所致的疼痛程度更严重。
有关腰椎间盘髓核突出引起神经根性疼痛的确切原因目前尚未完全清楚。自从1934年Mixter和Barr[16]首次应用椎间盘摘除术治疗腰椎间盘突出症以来,经典理论一直认为神经根受机械压迫是引起症状的主要原因[7]。近年来的相关研究发现[6,14,15],单纯机械性因素并不能完全解释疼痛的来源,多种化学介质产生的炎性刺激是椎间盘源性疼痛的重要因素之一。Olmarker等[17,18]对髓核分泌的化学物质(特别是TNF-α)在神经根性疼痛发病机制中的作用进行了长达十几年的基础与临床研究,结果发现,即使在没有明显机械性压迫发生的情况下,移植髓核或者局部单独应用一定浓度的 TNF-α(5 ng/μL)亦会引起神经传导速度下降、轴突及髓鞘损伤、神经元凋亡增加以及机械刺激和热刺激阈值改变等;应用TNF-α拮抗剂对这些改变有一定的缓解作用。在本研究建立的模型中,我们在显微镜下行腰5左侧半椎板及小关节切除、显露神经根起始部之后,将获得的尾椎椎间盘髓核组织小心放置于神经根处。虽然不能完全排除术后机械性压迫的因素,但由于髓核是一种胶冻样的柔软组织,粘附于神经表面;且手术切除周围骨性组织消减了机械性压迫对实验结果的影响,因此我们认为,该模型中髓核释放的化学性物质对神经根的炎性刺激在诱发疼痛症状的过程中起到了主要作用。
本研究对N-NP组与P-NP组机械性刺激阈值的比较结果表明,与正常椎间盘相比,退变椎间盘髓核移植在一段时间内使大鼠疼痛症状明显加重。根据这一结果,我们有理由推测,在椎间盘的退变进程中,至少在某一阶段,某些与疼痛有关的化学介质得到了释放或增加。Ulrich等[19]最近的研究发现,损伤大鼠尾椎纤维环后,椎间盘中与疼痛发生发展密切相关的炎性细胞因子——TNF-α、IL-1β和IL-8含量增高;Weiler等[20]对人体椎间盘标本研究的结果证实,随着椎间盘退变的加重,TNF-α的表达也随之增加;Burke等[21]对20例因椎间盘源性疼痛而行前路融合的椎间盘标本进行检测,结果显示,标本中IL-6和IL-8含量显著升高。由此可以推断,本研究中实验大鼠尾椎椎间盘纤维环穿刺引起的退变过程中伴有炎性致痛介质增高,进而引起与疼痛有关的行为学改变;如果采用特定的治疗手段(如生长因子疗法、基因治疗等)以减轻或逆转椎间盘退变进程,则有可能达到缓解疼痛症状的目的。我们建立的退变—疼痛模型有可能成为将来评价椎间盘退变生物治疗效果的理想选择之一。
通过对髓核移植术后大鼠DRG中TNF-α表达的研究发现,正常和退变髓核组织移植均可引起DRG中TNF-α显著升高,提示神经根性疼痛的存在;但与机械性刺激阈值结果的不同是,两组TNF-α的表达未见明显差异。推测可能存在两个原因:(1)除了TNF-α以外,还有其他多种炎症细胞因子在椎间盘源性疼痛机制中发挥作用;(2)免疫组化研究属不精确的定量分析,如采用ELISA等精确定量手段可能有助于细微差异的检测。
本实验利用大鼠尾椎椎间盘纤维环穿刺的方法建立了椎间盘退变模型,对比分析了正常与退变性髓核突出导致神经根性疼痛的行为学测试结果以及DRG中TNF-α的免疫组化结果,从而为揭示椎间盘退变过程中炎症因子释放在疼痛发生机制中的重要作用提供了实验依据,但仍存在一定的局限和不足,主要包括:(1)利用纤维环穿刺建立的大鼠尾椎椎间盘退变模型与人类椎间盘退变的生理进程有较大差异,尤其表现在椎间盘生物力学、形态大小等方面。(2)未对移植髓核组织中各种炎性因子的含量进行精确定量,因而无法判断是何种物质在神经根性疼痛机制中起主要作用。(3)需进一步完善椎间盘退变动物模型,使之更符合退变引起腰腿痛的临床实际。
1 Adams MA,Roughley PJ.What is intervertebral disc degeneration,and what causes it?[J].Spine,2006,31(18):2151-2161.
2 Deyo RA,Weinstein JN.Low back pain[J].N Engl J Med,2001,344(5):363-370.
3 Anderson DG,Albert TJ,Fraser JK,et al.Cellular therapy for disc degeneration[J].Spine,2005,30(17S):S14-S19.
4 Paesold G,Nerlich AG,Boos N.Biological treatment strategies for disc degeneration:potentials and shortcomings[J].Eur Spine J,2007,16(4):447-468.
5 Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw [J].J Neurosci Methods,1994,53(1):55-63.
6 Kawakami M,Matsumoto T,Hashizume H,et al.Osteogenic protein-1(osteogenic protein-1/bone morphogenetic protein-7)inhibits degeneration and pain-related behavior induced by chronically compressed nucleus pulposus in the rat[J].Spine,2005,30(17):1933-1939.
7 Olmarker K,Myers RR.Pathogenesis of sciatic pain:role of herniated nucleus pulposus and deformation of spinal nerve root and dorsal root ganglion[J].Pain,1998,78(2):99-105.
8 Lotz JC,Colliou OK,Chin JR,et al.Compression-induced degeneration of the intervertebral disc:an in vivo mouse model and finite-element study[J].Spine,1998,23(23):2493-2506.
9 Iatridis JC,Mente PL,Stokes IA,et al.Compression-induced changes in intervertebral disc properties in a rat tail model[J].Spine,1999,24(10):996-1002.
10 Masuda K,Aota Y,Muehleman C,et al.A novel rabbit model of mild,reproducible disc degeneration by an annulus needlepuncture:correlation between the degree of disc injury and radiological and histological appearances of disc degeneration[J].Spine,2005,30(1):5-14.
11 Melrose J,Smith S,Little CB,et al.Spatial and temporal localization oftransforming growth factor-beta,fibroblast growth factor-2,and osteonectin,and identification of cells expressing alpha-smooth muscle actin in the injured anulus fibrosus:implications for extracellular matrix repair[J].Spine,2002,27(16):1756-1764.
12 Kaapa E,Han X,Holm S,et al.Collagen synthesis and typesⅠ,Ⅲ,Ⅳ,andⅥ collagens in an animal model of disc degeneration[J].Spine,1995,20(1):59-67.
13 Lotz JC.Animal models of intervertebral disc degeneration:lessons learned[J].Spine,2004,29(23):2742-2750.
14 Olmarker K,Storkson R,Berge OG.Pathogenesis of sciatic pain:a study of spontaneous behavior in rats exposed to experimental disc herniation[J].Spine,2002,27(12):1312-1317.
15 Hou SX,Tang JG,Chen HS,et al.Chronic inflammation and compression of the dorsal root contribute to sciatica induced by the intervertebral disc herniation in rats[J].Pain,2003,105(1-2):255-264.
16 Mixter WJ,Barr J.Rupture of the intervertebral disc with involvement of the spinal canal[J].N Engl J Med,1934,211(6):210-215.
17 Olmarker K,Rydevik B.Selective inhibition of tumor necrosis factor-alpha prevents nucleus pulposus-induced thrombus formation,intraneural edema,and reduction of nerve conduction velocity: possible implications for future pharmacologic treatment strategies of sciatica[J].Spine,2001,26(8):863-869.18 Olmarker K.Puncture of a lumbar intervertebral disc induces changes in spontaneous pain behavior:an experimental study in rats[J].Spine,2008,33(8):850-855.
19 Ulrich JA,Liebenberg EC,Thuillier DU,et al.ISSLS prize winner:repeated disc injury causes persistent inflammation[J].Spine,2007,32(25):2812-2819.
20 Weiler C,Nerlich AG,Bachmeier BE,et al.Expression and distribution of tumor necrosis factor alpha in human lumbar intervertebral discs:a study in surgical specimen and autopsy controls[J].Spine,2005,30(1):44-54.
21 Burke JG,Watson RWG,Mccormack D,et al.Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators[J].J Bone Joint Surg Br,2002,84(2):196-201.

