后路Ⅰ期病灶清除植骨内固定治疗胸椎、胸腰段脊柱结核
李祥炎,徐 皓,姚晓东,陈建梅,唐焕章,李金泉,刘 君
脊柱结核为全身结核病的局部表现,在有效使用抗结核药物化疗的基础上配合积极的手术治疗,可以有效地控制病情,缩短治疗周期,减少伤残,提高患者生活质量[1-3]。我院自2006年1月~2009年1月共治疗胸椎及胸腰段脊柱结核37例,对其中椎体破坏较严重、有明显后凸及侧弯畸形的17例患者采用后路Ⅰ期病灶清除植骨内固定矫正畸形,效果满意,现报告如下。
1 资料与方法
1.1 一般资料
本组共17例,男9例,女8例。年龄20~76岁,平均47.2岁。其中胸椎结核10例,胸腰段结核7例,伴活动性肺结核2例。病变累及1个节段9例,2个节段6例,3个节段2例。所有病例均有不同程度的椎旁脓肿,6例术前合并不同程度的脊髓和神经根受压症状,神经功能评价按Frankel分级标准:B级1例,C级8例,D级7例,E级1例。在PACS工作站上对脊柱后凸畸形进行Cobb角测量[4],Cobb角19.3°~57.0°,平均(36.8±9.0)°。
1.2 术前准备
术前均行X线、磁共振等放射学检查,必要时行CT扫描明确椎体破坏情况,以制定相应的手术方式。术前合并活动性肺结核2例,均转我院结核科做专科治疗(治疗方案是异烟肼0.3 qd、利福平0.45 qd、吡嗪酰胺1.5 qd、链霉素0.75 im qd、乙胺丁醇0.75 qd),待肺结核控制满意后再转回我科,其余患者均在术前应用异烟肼0.3 qd、利福平0.45 qd、链霉素0.75 im qd联合抗结核治疗2周以上,同时给予营养支持治疗,对贫血患者采用多次少量输血予以纠正。定期复查血沉及血象,待血沉降至40 mm/h以下、血红蛋白升至100 g/L以上时即可接受手术治疗,如脓肿较大压迫脊髓继而出现神经症状,则考虑提前进行手术治疗。
1.3 手术方法
全身麻醉,气管插管,俯卧位,C臂X线机定位病变节段,再次调整患者体位,使手术床腰桥与病变节段相对应。以病椎为中心作切口,后正中入路显露病变脊椎及上下两个邻近椎节,透视定位后在病椎上下椎节置椎弓根钉,暂时连接一侧椎弓根钉棒,临时稳定脊柱。棘突剪及椎板咬骨钳咬除病椎棘突、椎板,充分暴露胸椎管,神经拉钩保护脊髓,咬除两侧椎弓根至椎体后缘,相应节段的肋间血管和神经予以结扎并切断,用小圆刀或尖刀于病变椎间盘的后外侧呈圆形切开后纵韧带,髓核钳取出病变椎间盘,用不同型号及角度的刮匙、椎板咬骨钳、骨刀从椎体的两侧逐步向中心咬除病变椎体,与后纵韧带相连部分最后清除。术中动作应轻柔,以免损伤脊髓。用吸管将椎旁脓肿及流注脓肿吸除,用刮匙及湿纱布将脓肿壁上病变组织清除干净。双氧水、碘伏、盐水对脓腔边冲洗边抽吸,以避免结核病菌在椎管及其他间隙内蔓延。选用合适高度的可调式中空笼状钛合金Modulics人工椎体(美国史赛克公司生产)或钛合金钛网(美国强生公司生产),将碎骨粒(术中切取的肋骨、髂骨或正常椎体骨质)紧密填塞植入人工椎体或钛网中,于椎体间置入,恢复椎体序列。在邻近的上下椎体用XIAⅡ椎弓根钉棒系统(美国史赛克公司生产)进行三柱固定,再通过器械加压以纠正脊柱后凸、短缩畸形,重建脊柱稳定性。如器械加压固定难以矫正后凸畸形,可考虑通过调整腰桥来辅助矫正,此时应注意脊髓的短缩和受压情况,切不可出现皱折及卡压。病灶清除后常规置入链霉素干粉1~2 g。检查胸、腹膜破损情况,破损者及时修补。有神经损伤的患者术中脊髓减压时均行甲基强的松龙冲击疗法,以防脊髓再灌注损伤。
1.4 术后处理
术后常规应用抗生素和支持治疗,规范抗结核治疗半年左右,并根据恢复的具体情况减药或减量调整。术后引流管留置2~3 d,至引流量低于50 ml后拔除,术后视情况卧硬板床休息1~2个月,而后佩戴腰围或支具逐步下床活动,合并截瘫者嘱患者家属根据截瘫恢复情况逐步进行康复训练。定期复查血沉和肝脏功能,如肝脏功能出现异常则予以保肝治疗,并拍片复查。
1.5 术后观察指标
采用Frankel分级对手术前后的神经功能进行评价,通过拍摄X线片观察术后脊柱后凸畸形矫正情况及随访1年时Cobb角的丢失情况。
1.6 统计学分析
所有数据运用SPSS 13.0统计软件进行处理,对术前、术后及随访1年Cobb角的比较采用重复测量的方差分析,两两比较采用SNK-q法,P<0.05认为差异具有统计学意义。
2 结果
手术时间90~200 min,平均155 min。术中出血200~1200 ml,平均560 ml,术中发生胸膜破裂1例,予以缝合,鼓肺实验破口处未见明显气泡产生,术后X线片检查胸腔无明显积气、积液。切口甲级愈合16例,其中1例于手术3周后形成窦道,换药1周未见明显好转,予以行二次病灶清除术,术后切口愈合。17例患者获随访12~36个月,平均18个月,局部疼痛和(或)下肢放射性麻木症状均缓解,神经功能Frankel分级均较术前有明显改善(其中C级1例,D级5例,E级11例),植骨处均达骨性融合。脊柱后凸Cobb角从术前的(36.8±9.0)°降至术后的(17.5±3.5)°,差异具有统计学意义(t=9.354,P=0.000);随访 1年的Cobb角为(20.0±4.0)°,与术前比较,差异具有统计学意义(t=8.165,P=0.000),而与术后相比,差异无统计学意义(t=1.184,P=0.244)。术后治疗效果评定均达到脊柱结核治愈标准[5]。典型病例见图1。
3 讨论
3.1 病灶清除
彻底清除结核病灶是脊柱结核手术治疗成功的关键。方先之[6]率先使用病灶清除术治疗脊柱结核,治愈率明显提高。彻底清除脊柱结核病灶包括清除病变区内的所有病变组织,如脓液、干酪样物质、死骨、肉芽组织、坏死椎间盘、坏死液化组织等,同时还应附带切除一些病灶外的“亚正常”骨组织。王自立等[7]通过对结核病灶切除标本的组织病理学检查发现,69%的椎体结核有硬化表现,82%的病理硬化壁中存在微小结核结节,在2.5~4.0 mm范围内出现结核结节的可能性为95%,因此作者认为椎体结核的硬化壁必须切除,且切除的范围应不小于4 mm。然而结核杆菌对椎体骨质的破坏如同虫蚀[8],其所造成的骨瘘孔或空洞非常不规则,术中可通过刮匙刮除椎体深部小而隐蔽的结核病灶与死腔,但有时很难做到彻底根除,一旦有小的病灶或死骨遗留,就将成为结核复发的根源,因此在清除结核病灶的同时切除其周围的“亚健康骨”是必要的,不仅将复发的可能性大大减低,而且为人工椎体的植入以及后凸畸形的矫正提供了有利空间。
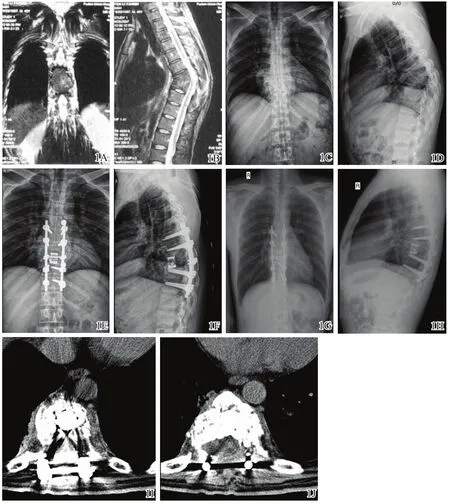
图1 患者,男性,48岁,T7~T8椎体结核
3.2 脊柱稳定性重建
脊柱结核手术不但要彻底清除病灶以解除脊髓压迫,恢复椎体血运、重建脊柱稳定性亦是外科治疗的重要目的。传统的脊柱结核手术仅对病变椎体内及其周围的脓液、干酪样坏死物、死骨进行清除,以达到解除脊髓压迫、保障抗痨药物渗透以及促进病灶愈合的目的,但病灶清除后的椎间残留空间造成脊柱的严重不稳,致使后凸畸形加重。随着内固定技术的发展,脊柱稳定性的重建日益受到重视。临床研究表明,脊柱结核术后复发与脊柱稳定性遭到破坏有关,病椎的稳定有利于结核病灶的静止和修复,有助于局部结核病灶的控制和骨性融合[9-11],故内固定技术在脊柱结核外科治疗中的作用越来越重要。但内固定物的植入是否会增加机体异物反应和伤口感染率,问题值得商榷。钛合金生物相容性好,结核分支杆菌对金属内植物的亲和力及黏附力小,产生的生物膜既小又薄[12,13];且无论是在脊柱结核的渗出期、增殖期还是坏死期,病灶彻底清除后Ⅰ期植入内固定物都是安全有效的[14]。研究发现,人工椎体的植入可以辅助撑开椎体,纠正脊柱后凸畸形,固定并维持椎体的高度和脊柱的稳定[15],而经后路椎弓根钉系统是所有脊柱固定系统中最可靠的内固定之一,可以提供即时的坚强内固定,能较好地维持已经矫正的畸形,使脊柱恢复正常序列,同时可以防止因脊柱承受过多机械压力造成植骨块滑脱吸收而导致的植骨失败。本组4例行人工椎间盘置入(专家意见:人工椎间盘置换技术是为了保留手术节段的运动功能、防止相邻节段的应力集中和退变加速而采用的新方法,本组中4例胸椎或胸腰椎结核采用此技术重建手术节段的脊柱,能否达到既重建脊柱稳定,又保留手术节段脊柱运动功能的目的尚需进一步的临床观察。将人工椎间盘技术应用于脊柱结核的手术是否合理,仍需进一步的研究和探讨),13例行人工椎体置换,17例行后路椎弓根钉内固定,术后患者3~4周后在支具等外固定临时保护下落地进行功能锻炼。术后随访12~36个月,平均18个月,原病灶区域均达植骨融合标准。
3.3 后路Ⅰ期病灶清除植骨内固定术的特点
本术式是经后背正中单一切口进行同期病灶清除植骨内固定,适用于不同分型及不同时期的胸椎、胸腰段脊柱结核。术前需通过各种影像资料对结核的分型及病灶的破坏程度进行明确判断,本组17例结核病灶对椎体的破坏明显,形成明显后凸畸形,或病灶破坏不规则呈骨瘘孔样,采用本术式可彻底清除病灶,矫正后凸畸形,维持脊柱稳定,治疗效果较满意。
本术式的主要优点包括:(1)与前后路联合手术比较,无需更换体位及进行二次手术,手术切口小,接触重要脏器少,手术时间短,出血少;(2)可针对病变的破坏程度做相应的病灶清除术,避免了大切口小清创的可能;(3)对病变节段位于胸6以上的病人,后路术式无需考虑肩胛骨的阻挡,整个胸椎节段均能进行手术;(4)无需开胸,术中不需压迫肺,术后不需放置胸腔闭式引流管,因此肺的呼吸功能不受破坏,特别适用于肺功能较差的患者;且术后护理简单,病人痛苦少,恢复快;(5)可从双侧对椎旁脓肿及流注脓肿进行清除,避免术中因需清除对侧脓肿而扩大手术切口,从而减轻了手术创伤;(6)脊髓减压彻底,尤其适合于脊髓压迫所致不全瘫痪的病人;(7)既起到矫正畸形的作用,又通过三柱固定重建了脊柱的稳定性;(8)最大程度地降低对椎体血运的破坏,促进前中柱植骨的早期融合。
本术式也存在一些不足之处:(1)破坏脊柱的后柱,使术后早期脊柱的稳定性无法得到维持,需借助支具加以保护;(2)胸椎管相对狭窄,且术中所有操作皆在脊髓周围进行,术中操作不慎将损伤脊髓;(3)前纵韧带前缘有重要脏器,术中动作要求轻柔,否则将带来严重并发症;(4)对于较远的流注脓肿,脓腔内的病灶清除较困难;(5)对术者手术技术要求较高,手术的推广相对较困难。
1 Zaveri GR,Mehta SS.Surgical treatment of lumbar tuberculousspondylodiscitis by transforaminal lumbar interbody fusion(TLIF)and posterior instrumentation[J].J Spinal Disord Tech,2009,22(4):257-262.
2 Mukhtar AM,Farghaly MM,Ahmed SH.Surgical treatment of thoracic and lumbar tuberculosis by anterior interbody fusion and posterior instrumentation[J].Med Princ Pract,2003,12(2):92-96.
3 Zhao H,Weng X,Shen J,et al.Application of internal fixation in the treatment for tuberculosis of the spine[J].Chin Med Sci J,1994,9(3):179-182.
4 何家维,严志汉,虞志康,等.PACS工作站上Cobb角测量的可靠性研究[J].中国脊柱脊髓杂志,2006,16(10):732-734.
5 郝定均,温世明,何思敏,等.前路一期病灶清除植骨内固定治疗胸腰椎结核的疗效观察[J].中国脊柱脊髓杂志,2003,13(11):652-655.
6 方先之.临床骨科学•结核[M].北京:人民卫生出版社,1974:2-37.
7 王自立.脊柱结核的病灶清除与融合固定问题[J].中国脊柱脊髓杂志,2006,16(12):888-889.
8 唐焕章,徐皓,符臣学,等.病椎切除并人工椎体重建治疗胸腰椎疾患[J].实用医学杂志,2007,23(4):545-547.
9 Yilmaz C,Selek H Y,Gurkan I,et al.Anterior instrumentation for the treatment of spinal tuberculosis[J].J Bone Joint Surg Am,1999,81(9):1261-1267.
10 马远征,胡明,才晓军,等.脊柱结核外科治疗的探讨[J].中华骨科杂志,2005,25(2):68-73.
11 苏保辉,王自立,施建党.脊柱结核再手术的原因及处理方法探讨[J].实用医学杂志,2008,24(8):1373-1375.
12 Oga M,Arizono T,Takasita M,et al.Evaluation of the risk of instrumentation as a foreign body in spinal tuberculosis.Clinical and biologic study[J].Spine,1993,18(13):1890-1894.
13 Ha KY,Chung YG,Ryoo SJ.Adherence and biofilm formation of Staphylococcus epidermidis and Mycobacterium tuberculosis on various spinal implants[J].Spine,2005,30(1):38-43.
14 Jin D,Qu D,Chen J,et al.One-stage anterior interbody autografting and instrumentation in primary surgical management of thoracolumbar spinal tuberculosis[J].Eur Spine J,2004,13(2):114-121.
15 王永清,夏仁云,孙明学,等.人工椎体和椎间盘在胸腰椎结核中的疗效[J].中国矫形外科杂志,2008,16(19):1454-1457.

