CaSn(OH)6的结构及其在锌镍电池中的应用
杨占红,王升威,廖建平,胡俊,易师
(中南大学 化学化工学院,湖南 长沙,410083)
碱性可充锌基电池因其具有高能量密度、无环境污染等特点,而引起人们的广泛关注,但电极材料的形变、枝晶等问题严重制约了锌电极的开发利用[1]。为了解决这些问题,人们尝试了许多解决方法,如:向电解液中加入KF,K3BO3,K3PO4等物质以降低放电产物的溶解度[2-3];往电极添加 PbO,In2O3,In(OH)3,Bi2O3或TiO2等物质,通过改变电流的分配来减缓枝晶和形变[4-6];选用优良的隔膜阻止枝晶的穿透和锌酸盐的传递[7]等等。其中,以向电极中添加Ca(OH)2效果较显著[8-9]。其依据是:在充放电过程中,Ca(OH)2与反应形成溶解度更小的锌酸钙(Ca(OH)2·2Zn(OH)2·2H2O),抑制了的迁移,从而增强了电极的稳定性,并提高电极的循环寿命。预先合成具有电化学活性的Ca(OH)2·2Zn(OH)2·2H2O化合物比直接由ZnO和Ca(OH)2进行相互混合形成的混合物具有更好的性能[10-11]。但是,由于锌酸钙具有比容量低、导电性差、合成工艺较复杂等缺点,锌酸钙并不适用于大规模的锌电极工业化生产。目前,在锌电极中直接添加Ca(OH)2成为工业化研究的热点。然而,由于Ca(OH)2具有较强的碱性,会对黏合剂的使用造成一定的影响,造成锌负极浆料流动性差,不方便拉浆等。CaSn(OH)6是一种pH值为中性的化学物质,主要作为制备 CaSnO3的前驱体,人们对CaSn(OH)6的制备与表征研究较少[12-13],对于CaSn(OH)6在锌镍电池方面的应用研究还未见文献报道。为此,本文作者采用共沉淀法合成 CaSn(OH)6,并对其在锌镍电池中的应用进行研究。
1 实验
1.1 样品的制备
参照文献[14],将物质的量比为1∶1的CaCl2溶液和 SnCl4溶液充分搅拌均匀,在连续搅拌的条件下,将过量的NaOH溶液缓慢滴加到混合溶液中。继续搅拌5 h,静置15 h,减压抽滤,所得沉淀物经蒸馏水洗涤至中性后于80 ℃真空干燥器中干燥6 h,得白色粉末。化学反应方程式为:
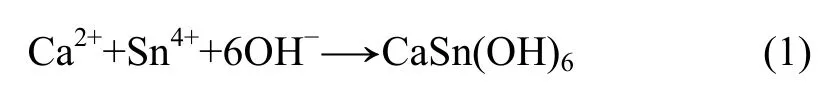
1.2 样品的X线衍射和SEM分析
X线衍射分析采用日本 Digaku D/max 2550VB+18 kW转靶X线衍射仪,选用Cu靶Kα辐射,加速电压为40 kV,电流为30 mA,扫描速度为5(°)/min。采用日本电子公司生产的JSM-6360LV型扫描电子显微镜对CaSn(OH)6样品的表面形态进行观察。
1.3 锌负极片的制作
将质量分数为15%的CaSn(OH)6与70% ZnO、3%石墨以及 10%锌粉混合均匀,再加入黏合剂(0.5%HPMC干粉和1.5% PTFE乳液)和适量水调制成浆,涂覆在铜网集流体上,经烘干、压片后制成锌电极。
为了对比实验结果,采用85% ZnO、3% 石墨、10% 锌粉、0.5% HPMC干粉、1.5% PTFE乳液的配方按上述方法制备不添加CaSn(OH)6的锌电极。
1.4 循环伏安测试
循环伏安实验采用Princeton Applied Research公司生产的PARSTAT 2273电化学测试系统进行测试。工作电极是分别以纯氧化锌和氧化锌与CaSn(OH)6的混合物为活性物质的粉末微电极,具体做法参考文献[15],以 Hg/HgO电极为参比电极,大面积镍片为辅助电极。隔膜采用聚乙烯接枝膜,电解液为 6 mol/L KOH 溶液。扫描范围为-1.5~-1.2 V,扫描速率为50 mV/s。
1.5 锌镍模拟电池恒电流充放电实验
将制得的锌负极片用聚乙烯接枝膜包裹2层,并放置于2片正极之间组成模拟电池极组,放入1个自制有机玻璃盒中,加入一定量的6 mol/L KOH电解液,组装成锌镍模拟电池。正极为大面积烧结式镍正极,其容量远大于锌负极容量。采用BS-9300R二次电池性能检测装置进行模拟电池的恒电流充放电测试。先以0.1C(C为倍率,指电池在规定时间内放出额定容量时的电流)的电流对电池进行化成,然后进行充放电循环,充放电循环制度为:以0.3C的电流充电3.5 h,然后以0.3C放电,充电限制电压为2.5 V,放电终止电压为1.4 V,测试环境温度为25 ℃。为保证负极充满,充电倍率电流按负极活性物质的理论容量计算。
2 结果与讨论
2.1 CaSn(OH)6材料循环前后的X线衍射检测
新制得的 CaSn(OH)6的 X线衍射分析结果如图1(a)所示。从图1(a)可以看出:通过共沉淀法制备出的样品与JCPDS卡片上73-2383号非常相符,这说明该方法所制备的CaSn(OH)6样品具有非常高的纯度。图中衍射峰的宽化说明样品的颗粒粒径较小,结晶度不高。
图 1(b)所示为充放电循环后的负极材料(添加CaSn(OH)6的电极)的X线衍射结果。由图1(b)可见,循环后负极材料的化学组分发生了改变,CaSn(OH)6的衍射峰消失,而出现了一些其他物质的衍射峰,经分析,是锌酸钙(Ca(OH)2·2Zn(OH)2·2H2O)和金属锡的特征峰。
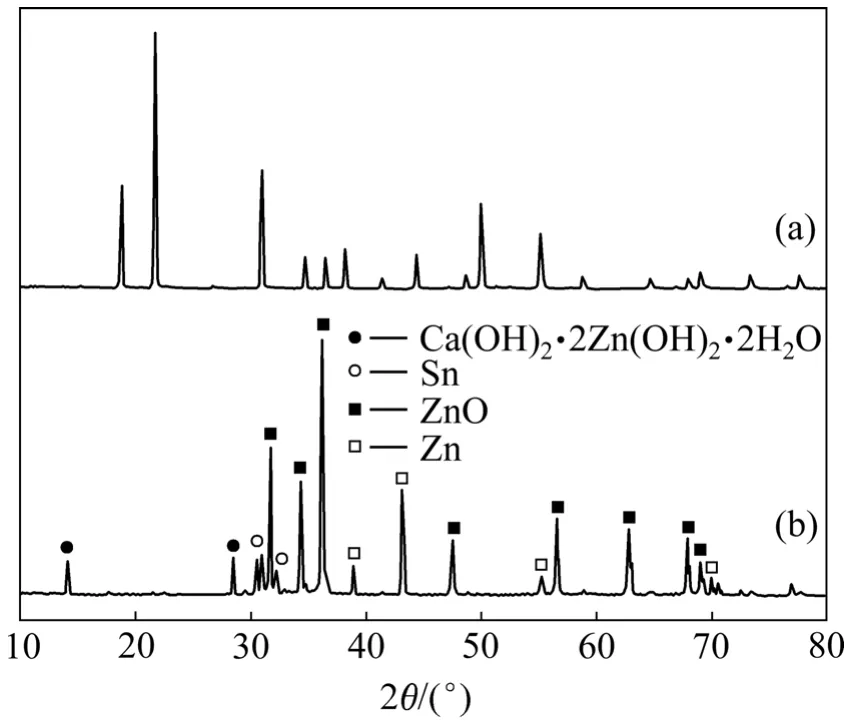
图1 CaSn(OH)6样品和循环后的负极活性物质的XRD谱Fig.1 XRD patterns of CaSn(OH)6 sample and active material after cycling
2.2 CaSn(OH)6材料的表观形貌
图 2所示为共沉淀法制备的 CaSn(OH)6样品的SEM照片。从图2可以看出:该样品的颗粒粒径较小,粒度分布较均匀,平均粒径约为1 μm左右。较小的粒径有利于在电极材料中的分散,所以,采用该方法制备的CaSn(OH)6样品比较适合作为电极添加剂。

图2 CaSn(OH)6的SEM照片Fig.2 SEM image of CaSn(OH)6
2.3 CaSn(OH)6材料的循环伏安特性
图3 所示为氧化锌与CaSn(OH)6混合物和纯氧化锌的粉末微电极的第6次循环伏安曲线。从图3可以看出:曲线1只在-1.50 V处有1个还原峰,此为氧化锌的特征还原峰,而曲线2在-1.50 V和-1.39 V处各有1个还原峰。结合对循环后负极材料的XRD检测结果可知,该电极中的锌酸钙(Ca(OH)2·2Zn(OH)2·2H2O)是在充放电循环过程中产生的。其原因是CaSn(OH)6中含有的Sn元素在充电过程中被还原成金属单质,而 Ca元素则被游离出来生成 Ca(OH)2,Ca(OH)2接着在强碱性条件下与电极中的氧化锌反应,生成了锌酸钙。其化学反应方程式如下:
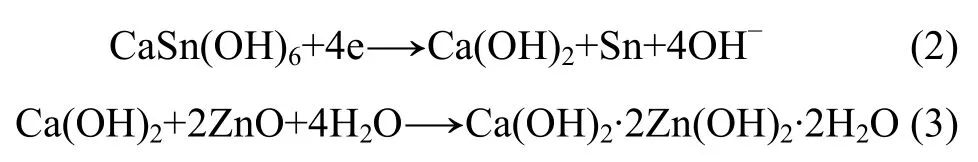
2.4 锌镍模拟电池的恒电流放电曲线
图4所示为含2种锌电极的锌镍电池恒电流循环的第 8次放电曲线。从图 4可以看出:未添加CaSn(OH)6的电极能放出较多的电量,其原因是氧化锌在负极材料中含量较高,具有较高的理论比容量。但是,添加CaSn(OH)6的电极具有较高的放电平台,这是由于CaSn(OH)6在循环过程中生成了具有良好导电性能的金属锡,金属锡在充放电过程中将不再被氧化,而一直以单质金属形式存在,能在锌电极中形成导电网络,从而大大减弱了锌电极在放电过程中的极化现象。
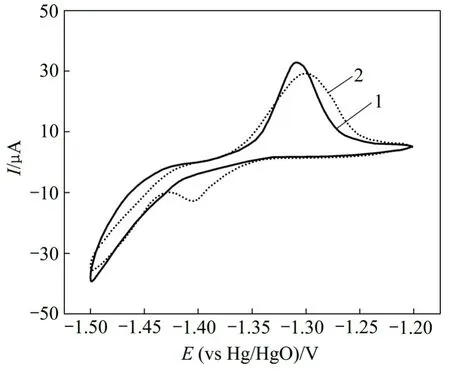
图3 2种粉末微电极的循环伏安曲线Fig.3 Cyclic voltammograms of two powder microelectrodes
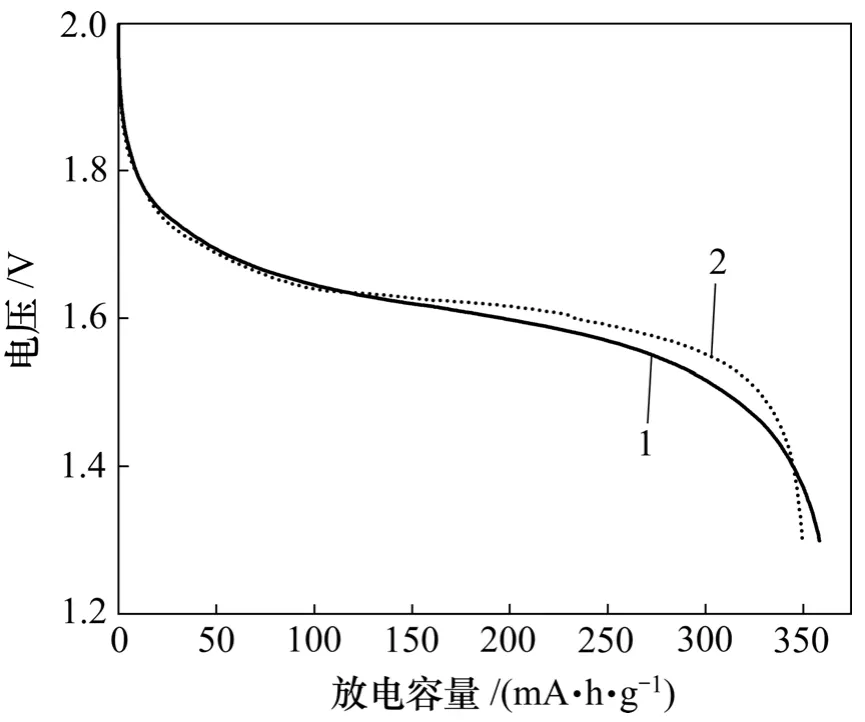
图4 锌镍电池的第8次恒电流放电曲线Fig.4 Discharge curves of simulated Ni/Zn batteries at eighth cycle
2.5 锌镍模拟电池恒电流充放电循环性能
图5所示为锌镍模拟电池的恒电流放电容量与循环次数的关系。从图5可以看出:纯氧化锌电极的容量衰减很快,在30次充放电循环后,放电容量已衰减到起始容量的 45.3%。这是由于纯氧化锌在强碱性溶液中具有较大的溶解性,而氧化锌在电解液中溶解后,会不可逆地扩散到电解液中,造成锌电极活性物质的损失和锌电极放电容量的衰减。而添加CaSn(OH)6的电极的放电容量衰减较为缓慢。其原因是 CaSn(OH)6在循环过程中能够产生 Ca(OH)2、锌酸钙和金属锡等有益物质,在Ca(OH)2和锌酸钙的作用下,锌电极放电产物在电解液中的溶解度会大大减小,在一定程度上减少了锌电极活性物质的损失,缓解了负极的形变、枝晶等问题,而锌镍电池的循环性能也得到提高。经过 50次循环,电池放电容量仍保持为起始容量的72.6%。而化成过程中生成的金属锡在充电过程中将不再会被氧化,从而在锌电极中形成导电网络,由于金属锡具有较大的析氢过电位,能有效抑制锌电极的析氢反应,所以,金属锡对锌镍电池容量的保持也具有一定的促进作用。

图5 放电容量与循环次数的关系Fig.5 Relationship between discharge capacity and cycle number
3 结论
(1) 采用共沉淀法合成出的 CaSn(OH)6样品粒度分布均匀,粒径较小,并且纯度较高,比较适合作为电极添加剂。
(2) CaSn(OH)6在充电过程中能游离出金属锡和Ca(OH)2,并能在充放电循环过程中进一步生成锌酸钙。
(3) 添加 CaSn(OH)6样品的锌镍电池具有较高的放电平台和更好的循环性能。锌酸钙的生成可以降低锌电极活性物质在电解液中的溶解度,从而在一定程度上减少了锌负极的形变和枝晶等,提高了锌电极的循环性能。
[1] 金达莱, 岳林海, 徐铸德. 锌负极材料锌酸钙的晶体形貌和物化性质研究[J]. 无机化学学报, 2005, 21(2): 265-269.JIN Da-lai, YUE Lin-hai, XU Zhu-de. Morphology and physical properties of calcium zincate[J]. Chinese Journal of Inorganic Chemistry, 2005, 21(2): 265-269.
[2] Zhu J L, Zhou Y H, Gao C Q. Influence of surfactants on electrochemical behavior of zinc electrodes in alkaline solution[J]. Journal of Power Sources, 1998, 72(2): 231-235.
[3] Chen J S, Mclarnon E R, Cairns E J. Investigations of low-zinc-solubility electrodes and electrolytes in zinc/silver oxide cells[J]. Journal of Power Sources, 1992, 39(3): 333-348.
[4] McBreen J, Gannon E. The electrochemistry of metal oxide additions in pasted zinc electrode[J]. Electrochimica Acta, 1981,26(10): 1439-1446.
[5] Shivkumar R, Kalaignan G P, Vasudevan T. Studies with porous zinc electrodes with additives for secondary alkaline batteries[J].Journal of Power Sources, 1998, 75(1): 90-100.
[6] Lan C J, Lee C Y, Chin T S. Tetra-alkyl ammonium hydroxides as inhibitors of Zn dendrite in Zn-based secondary batteries[J].Electrochimica Acta, 2007, 52(17): 5407-5416.
[7] Zhu J L, Zhou Y H. Effects of ionomer films on secondary alkaline zinc electrodes[J]. Journal of Power Sources, 1998,72(2): 266-270.
[8] Mclarnon F R, Cairns E J. The secondary alkaline zinc electrode[J]. Journal of the Electrochemical Society, 1991,138(22): 645-664.
[9] ZHU X M, YANG H X, AI X P, et al. Structural and electrochemical characterization of mechanochemically synthesized calcium zincate as rechargeable anodic materials[J].Journal of Applied Electrochemistry, 2003, 33(7): 607-612.
[10] 张春, 王建明, 张昭, 等. 钙添加剂对可充锌电极性能的影响[J]. 中国有色金属学报, 2001, 11(5): 780-784.ZHANG Chun, WANG Jian-ming, ZHANG Zhao, et al. Effects of calcium additive on performance of pasted zinc electrode[J].The Chinese Journal of Nonferrous Metals, 2001, 11(5):780-784.
[11] 杨占红, 王升威, 曾利辉, 等. 化学合成法制备锌镍电池负极材料锌酸钙[J]. 中南大学学报: 自然科学版, 2008, 39(5): 1-5.YANG Zhan-hong, WANG Sheng-wei, ZENG Li-hui, et al.Chemosynthesis of calcium zincate as negative electrode material for Ni/Zn battery[J]. Journal of Central South University: Science and Technology, 2008, 39(5): 1-5.
[12] Mandal K D, Sastry M S, Parkash O. Preparation and characterization of calcium stannate[J]. Journal of Materials Science Letters, 1995, 14(17): 1412-1413.
[13] Pfaff G. Chemical synthesis of calcium stannates from peroxo precursors[J]. Materials Science and Engineering B, 1995,33(2/3): 156-161.
[14] HE Ze-qiang, LI Xin-hai, LIU En-hui, et al. Preparation of calcium stannate by modified wet chemical method[J]. Journal of Central South University of Technology, 2003, 10(3):195-197.
[15] Cha C S, Li C M, Yang H Y, et al. Powder microelectrodes[J].Journal of Electroanalytical Chemistry, 1994, 368(1/2): 47-54.

