一株DBP高效降解菌的筛选及其降解特性
金德才,梁任星,王洋洋,代沁芸,张瑞永,吴学玲
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
PAEs类化合物是人工合成的难降解有机物,被广泛用作农药、驱虫剂、化妆品、润滑剂以及去污剂的生产原料,相对分子质量较高的 PAEs也被广泛用作塑料增强剂和改性剂,其用量仅比塑料中的多聚物用量低。由于 PAEs在塑料制品的生产、使用等过程中很容易释放出来,该类化合物已成为一种全球性的环境有机污染物,在土壤、水体、大气、生物甚至人体中都已发现PAEs的分布[1]。大量研究表明:酞酸酯为一种具有致畸、致癌、致突变“三致效应”的环境干扰剂[2-3]。美国环保局(EPA)、欧盟委员会和中国环境监测总站均把此类化合物列为优先污染物黑名单[4]。在自然环境中,邻苯二甲酸酯类化合物的降解主要有2种途径:生物降解和非生物降解。非生物降解主要为水解和光解。研究表明,邻苯二甲酸酯的水解和光解非常缓慢,微生物降解是其矿化的主要途径[5]。为提高邻苯二甲酸酯类有机污染物的生物降解效率,筛选高效专性或兼性的降解菌非常必要。DBP作为一种重要的 PAEs化合物,因其在工业上普遍应用且在环境中大量存在而成为重要的研究对象。在此,本文作者分离到一株能够以DBP为唯一碳源生长的细菌。降解实验表明:此菌是一株高效降解菌,在持久性有机污染物处理中具有重要的意义。
1 材料和方法
1.1 主要试剂和器材
主要试剂为:邻苯二甲酸二甲酯(DMP);邻苯二甲酸二乙酯(DEP);邻苯二甲酸二丁酯(DBP);邻苯二甲酸二辛酯(DOP);邻苯二甲酸二异辛酯(DIOP)(购自中国医药集团上海化学试剂公司,含量≥99.5%);甲醇(分析纯)和乙酸乙酯(分析纯)(由天津市大茂化学试剂厂生产);色谱级甲醇(购自美国sigma公司)。
主要器材为:725N型紫外可见分光光度计(上海精密科学仪器有限公司生产);Elite高效液相色谱仪(大连伊利特公司生产)。
1.2 样品来源及菌株筛选
采样地为山西省平定县有机场污水底泥。
从样品中称10 mg污泥置于含200 mg/L 邻苯二甲酸酯(DMP,DEP,DBP和DOP各为50 mg/L)的100 mL无机盐培养液中,采用梯度压力法驯化,在30 ℃振荡培养7 d,逐步转接至含240,280,320,360和400 mg/L邻苯二甲酸酯的无机盐培养液后,用接种针蘸取少量菌液,在 PAEs固体平板上划线,选择菌落较大、形态和颜色各异的菌落转接到新的固体培养基上划线。重复5次后,挑取单菌落重新接到富集培养基中培养。
无机盐培养基组成(g/L)为:K2HPO45.8,KH2PO44.5,(NH4)2SO42.0,MgCl20.16,CaCl20.02,Na2MoO4·2H2O 0.002 4,FeCl30.001 8,MnCl2·2H2O 0.001 5;pH调至7.0,于121 ℃湿热灭菌20 min。在每1 L固体培养基中加入20 g琼脂。
富集培养基组成(g/L)为:牛肉膏 5.0,蛋白胨10.0,NaCl 5.0;水1 L,pH=7.0。培养基于121 ℃灭菌30 min。在每1 L固体培养基中加入20 g琼脂。
l.3 细菌生理生化特性测定
生理生化鉴定参考文献[6-7]进行。
1.4 细菌底物广谱性测试
在无机盐培养基中分别加入溶于氯仿后抽滤灭菌的萘(200 mg/L)、二苯胺(200 mg/L)、邻苯二酚(200 mg/L)、甲苯(200 mg/L);将邻苯二甲酸(200 mg/L)、水杨酸(200 mg/L)以及 DMP(200 mg/L),DBP(200 mg/L),DEP(200 mg/L),DIOP(200 mg/L)和原儿茶酸(200 mg/L)直接加入无机盐培养基中采用常规湿热灭菌。
1.5 细菌的16S rDNA 的扩增和系统发育树的构建
在50 μL 反应体系中,含有:10×PCR buffer 5 μL;10 mmol/L dNTP 1 μL;25 mmol/L MgCl24 μL;Taq 酶0.5 μL;5 μmol/L 引 物(正 向 引 物 FC27为5′-AGAGTTTGATCCTGGCTCAG-3′; 反 向 引 物RC1492 为 5′-TACGGCTACCTTGTTACGACTT-3′)各1 μL;DNA模板4 μL;其余成分为ddH2O。PCR扩增程序参考文献[8]进行。取全部反应液进行琼脂糖凝胶电泳。用E.Z.N.A.TM Gel Extraction Kit(OMEGA)进行胶回收,PCR纯化产物的测序工作由上海生工公司完成。用 Clustalx1.8软件进行全序列比对,并用MEGA3.1构建系统发育树[9]。
1.6 DBP的生物降解试验
取菌株于 100 mL活化富集培养基中振荡培养12~24 h,离心(转速为10 000 r/min) 5 min,收集菌体,用pH=7.0,浓度为0.02 mol/L的Na2HPO4-NaH2PO4缓冲液洗涤3次,用0.02 mol/ L 磷酸缓冲液将菌体配成pH=7.0,波长为600 nm时的光密度OD600=0.2的菌悬液,吸取1 mL菌悬液于含1 g/ L DBP的50 mL无机盐培养液中,根据不同条件进行培养。
1.7 分析方法
1.7.1 样品处理
于试样瓶中加入20 mL乙酸乙酯,振荡萃取10 min,收集有机相,水相再用20 mL乙酸乙酯萃取2次,合并有机相,旋转蒸发仪,待蒸发后用甲醇定容至10 mL,用高效液相色谱仪测定DBP的残留量。
1.7.2 液相色谱条件
色谱柱为SinoChrom ODS-BP (4.6 mm×200 mm×5 μm),柱温 35 ℃,V(流动相甲醇)∶V(水)= 9∶1,流速为0.5 mL/min。检测器波长为228 nm,进样量为20 μL。
1.7.3 生物量测定
为测定菌株 JDC-11的生物量,采用 725N 型紫外可见分光光度计在600 nm时测量培养基的光密度OD600。
2 结果与分析
2.1 菌株JDC-11的分离与部分生理生化测定
土壤样品经过10次以上转接培养后,摇瓶中的混合培养物能够在 400 mg/L邻苯二甲酸酯的无机盐培养液中很好地生长,说明降解菌株在此过程中被富集。摇瓶中的混合培养物通过在含有邻苯二甲酸酯的平板上进行划线分离,经过复筛、纯化后筛选得到一株能以 DBP为唯一碳源生长的菌株,命名为 JDC-11。JDC-11菌株在LB平板上于30 ℃恒温培养1 d后,菌落呈白色、不规则、微凸、湿润、不透明,不产生色素,无芽孢。在显微镜下观察,细胞初期至后期一直为球状,直径为0.71~1.18 μm。JDC-11菌株的电镜照片如图1所示,其部分生理生化特征见表1。
2.2 底物广谱性实验
接种培养7 d后观察,重复3次,结果如表2所示。可见:JDC-11可以很好地利用简单的邻苯二甲酸酯类化合物,邻苯二甲酸酯类化合物的生物降解随着烷基链含碳数的增加和分枝侧链的增加而降低,这与文献[10]中的结果一致。JDC-11还可以利用邻苯二甲酸酯类化合物的中间代谢产物邻苯二甲酸、原儿茶酸等和芳烃类化合物中间代谢产物邻苯二酚,预示着JDC-11在实际污染物处理中具有重要的价值。

图1 菌株JDC-11的扫描电镜照片Fig.1 SEM image of strain JDC-11

表1 JDC-11菌株的部分生理生化特征Table 1 Biophysical and biochemical characteristics of strain JDC-11

表2 PAEs降解菌株JDC-11的底物广谱性Table 2 Diversity of degradable substrates by strain JDC-11
2.3 菌株JDC-11的16S rDNA分析
采用PCR技术,扩增出16S rDNA基因,测序的序列长度为1 418 bp,在GenBank中的序列登录号为FJ378037。 以Nocardia abscessusstrain ATCC BAA-279为外群,构建系统发育树如图2所示。JDC-11与Rhodococcussp. D2-6(AM403174)的亲缘关系最近,相似度为99%,基本可以判定JDC-11属于红球菌属。
2.4 培养条件对菌株生长和DBP降解的影响
2.4.1 初始pH值对菌株JDC-11生长及DBP降解率的影响
在温度为30 ℃、摇瓶转速为175 r/min时,考察pH值分别为5.0,6.0,7.0,8.0,9.0,10.0和11.0时DBP作为单一基质情况下的生物降解的情况,24 h测定的实验结果如图3所示。

图2 JDC-11菌株的16S rDNA 基因序列系统发育树Fig.2 Phylogenetic tree derived from 16S rDNA gene sequence of JDC-11 and sequences of relating species
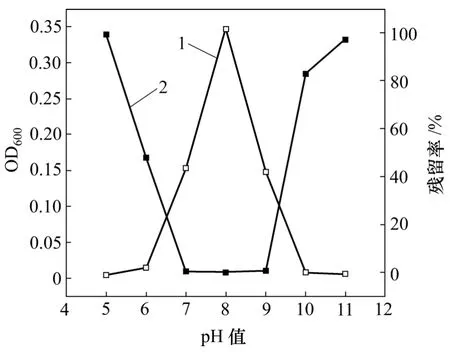
图3 初始pH值对菌株JDC-11生长及DBP降解的影响Fig.3 Effects of pH value on biomass and DBP biodegradation
研究结果表明:在 pH 值为 5.0~11.0时,菌株JDC-11 OD600随初始pH值升高先增加,在初始pH值为8.0时OD600最大,但随着pH值的继续升高,OD600却随之减少;当初始pH值超过10.0时,OD600显著减少,菌株几乎不能生长。DBP的残留率也随着初始pH值的升高而降低,在初始pH值为8.0时检测不到DBP,已完全降解,并且与菌株的生长量有很好的相关性,在pH值为7.0~9.0时均可以保持较高的降解率。由此可见,该菌株较适合在偏碱性的条件下生长。初始pH值为8.0是细胞生长和DBP降解的最佳pH值,在此条件下细菌的降解酶系可以保持在一个高活力的状态,在初始 pH过高或过低的情况下,无论是细菌生长量还是DBP的残留率都明显地受到影响。
2.4.2 温度对菌株JDC-11生长及DBP降解率的影响
在pH值为8.0、摇瓶转速为175 r/min时,考察在20,25,30,35,40和45 ℃时,DBP作为单一基质情况下的生物降解的情况,24 h后测定的试验结果如图4所示。
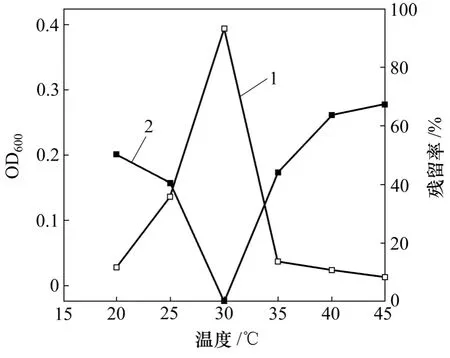
图4 初始温度对菌株JDC-11生长及DBP降解的影响Fig.4 Effect of temperature on biomass and DBP biodegradation
结果表明:在 20~45 ℃时,OD600随初始温度升高先增加,在温度为30 ℃时,OD600最大,检测不到DBP;但随着温度的继续升高,OD600随之减少,当初始温度超过35 ℃时,OD600显著减少,菌株几乎不能生长。由此可见,该菌株较适合在 30 ℃左右条件下生长。而在温度过低或过高都会抑制JDC-11的生长,影响DBP的降解。
2.4.3 转速对菌株JDC-11生长及DBP降解率的影响
在温度为30 ℃、pH值为8.0的条件下,考察转速为0,75,125,175和225 r/min时,DBP作为单一基质情况下的生物降解的情况,试验结果如图 5所示。
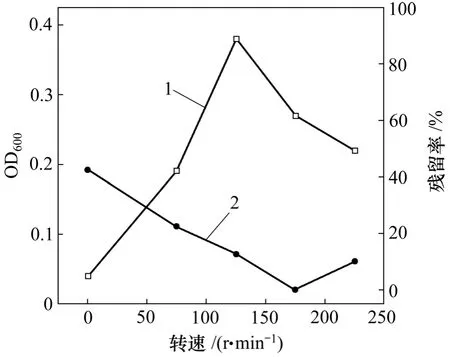
图5 转速对菌株JDC-11生长和DBP降解的影响Fig.5 Effect of agitation rate on biomass and DBP biodegradation
由图5可知:在静止条件下,菌株JDC-11仍然显示出对DBP较强的降解能力,残留率仅为42.6%;当转速为175 r/min时,检测不到残留DBP。因此,转速为175 r/min是菌株JDC-11生长的最佳转速条件。
2.4.4 培养时间对菌株JDC-11生长及DBP降解率的影响
在温度为 30 ℃、pH值为 8.0、摇瓶转速为 175 r/min的条件下,考察间隔4 h,DBP作为单一基质情况下的生物降解的情况,试验结果如图6所示。

图6 培养时间对菌株JDC-11生长及DBP降解的影响Fig.6 Effect of incubation time on biomass and DBP biodegradation
从图6可以看出:JDC-11基本不存在前滞期,能够很快进入快速利用DBP的状态,24 h后几乎检测不到DBP。
2.4.5 葡萄糖对菌株JDC-11降解DBP的影响
葡萄糖是一种容易降解的有机物,考察在有葡萄糖存在的条件下的生物降解,可以大体上作为环境中有天然有机物存在条件下生物降解情况的一种代表。
在温度为 30 ℃、pH值为 8.0、摇瓶转速为 175 r/min条件下,葡萄糖质量浓度为0,200,400,600,800,1 000和1 200 mg/L时的生物降解情况如图7所示。
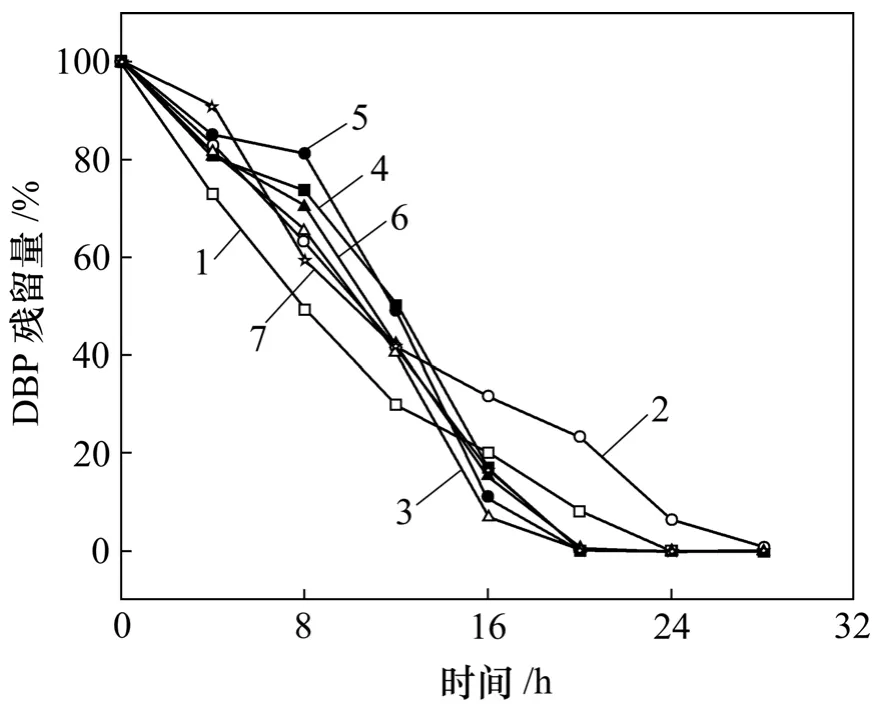
图7 葡萄糖质量浓度对DBP降解的影响Fig.7 Effect of glucose concentration on DBP biodegradation
从图7可以看出:当环境中存在一定质量浓度的葡萄糖时,对DBP的生物降解的影响很大。这些影响主要表现在以下2个方面:(1) 在前12 h,所有质量浓度的葡萄糖对DBP的降解都起到了抑制作用,在未加葡萄糖的体系中,12 h残留率为30%,在加葡萄糖的体系中,12 h残留率为40%~50%;(2) 12 h后,除了加200 mg/L葡萄糖的体系对DBP的降解起抑制作用外,其他质量浓度的葡萄糖体系都对DBP的降解起促进作用。
由此可见,葡萄糖对DBP降解的影响不仅与葡萄糖质量浓度有关,而且与培养时间有关。总体上说,低质量浓度葡萄糖抑制了DBP的降解,高质量浓度的葡萄糖会使DBP降解周期缩短。
3 讨论
Rhodococcussp.是一类广泛分布于自然环境中的好氧、不运动、高GC含量的革兰氏阳性菌。该类微生物能够降解多种有机污染物,因而在各类环境污染物的生物修复中发挥着重要的作用。就 PAEs这类环境污染物而言,国内外学者对Rhodococcussp.在降解该类化合物中的作用及代谢途径都进行了相关的研究。如:Jackson等[11]报道Rhodococc-ussp. 能够降解对苯二甲酸二乙酯(DETP);Kurane等[12]的研究表明,在活性污泥中,R.erytropolisS1能在3~5 d内完全降解DEHP。近几年来,Rhodococcussp.在降解PAEs类化合物以及在生物修复中的作用也有不少报道[13-16]。此外,李魁晓等[17]从红树林中分离到Rhodococcus rubber.1K,降解试验表明:该菌能以 DBP为唯一碳源和能源生长,可在48 h内将50 mg/L DBP及其中间产物完全降解。Li等[18]从垃圾填埋场的土壤中分离到一株降解DBP的细菌Rhodococcus rubberCQ0302,并开展了该菌的降解动力学及在生物修复方面的研究。综上所述,Rhodococcussp.在PAEs及其他环境污染物的降解中起着重要的作用。本文作者从污染土壤样品中分离到一株能够利用 DBP作为唯一碳源和能源生长的细菌JDC-11,经过对其形态特征、生理生化以及16S rDNA序列分析,发现JDC-11与Rhodococcussp.D2-6 (AM403174)的亲缘关系最近,相似度为99%,该菌株初步鉴定为Rhodococcussp。降解试验表明,菌株JDC-11降解DBP的最佳条件是:温度为30 ℃,pH值为8.0。这与文献[18]报道的Rhodococcus ruberCQ0302的最佳降解条件基本一致。在此最佳降解条件下,初始质量浓度为1 000 mg/L的DBP,经过24 h培养,降解率可达100%。初始质量浓度为100 mg/L的DBP在不同红球菌菌株的作用下要1~3 d才能完全降解[15]。李魁晓等[17]分离的Rhodococcus ruber1K也要在48 h内将50 mg/L的DBP及其中间产物完全降解。本研究分离的JDC-11是一株降解DBP的高效菌,在处理含有邻苯二甲酸酯类化合物污染的生物修复方面具有独特的应用潜力。
以往的研究表明:碳源、氮源、磷以及有机盐等对微生物的生长起着关键的作用。因为它们能够作为电子受体,从而提高微生物的呼吸速率[19]。在Li等[18]的研究中,为了确定外源加入的营养物质对降解速率的影响,把硝酸钾和蛋白胨加入到污染的土壤中并比较它们的降解速率。结果表明:通过加入外源的营养物质可以提高DBP的降解速率。本研究以葡萄糖为外源营养物质,考察葡萄糖质量浓度不同时的生物降解情况。结果表明:葡萄糖对DBP降解的影响不仅与葡萄糖浓度有关,而且与培养时间也有关。总体上说,低质量浓度葡萄糖抑制了DBP的降解,高质量浓度的葡萄糖会使DBP降解周期缩短。总之,微生物在降解过程中受很多因素的影响,在应用于环境污染物的生物修复时需综合考虑多方面的因素。
4 结论
(1) 从污染土壤样品分离到一株能够利用DBP作为唯一碳源和能源生长的细菌 JDC-11,初步鉴定为Rhodococcussp。
(2) 菌株JDC-11降解 DBP的最适条件是:温度为30 ℃,pH=8.0,转速为175 r/min。在此条件下,菌株能达到最大 OD600和最高降解率,初始质量浓度为1 000 mg/L的DBP经过24 h的培养,降解率可达100%,充分证明JDC-11是一株高效降解菌。
(3) 葡萄糖对DBP的生物降解有延长前滞期和加速降解的影响,从到达生物降解终点所需时间看,高质量浓度的葡萄糖对于DBP的生物降解起促进作用,低质量浓度的葡萄糖则会延缓生物降解速度,对DBP的生物降解有抑制作用。
[1] 夏凤毅, 郑平, 周琪, 等. 酞酸酯曝气生物降解规律的研究[J].四川大学学报: 工程科学版, 2002, 34(1): 72-76.XIA Feng-yi, ZHENG Ping, ZHOU Qi, et al. Aerobic degradation of phthalic acid esters[J]. Journal of Sichuan University: Engineering Science Edition, 2002, 34(1): 72-76.
[2] Kapanen A, Stephen J R, Briiggemann J, et al. Diethyl phthalate in compost: Ecotoxicological effects and response of the microbial community[J]. Chemosphere, 2007, 67(11):2201-2209.
[3] Voss C, Zerban H, Bannasch P, et al. Lifelong exposure to di-(2-ethylhexyl)-phthalate induces tumors in liver and testes of Sprague-Dawley rats[J]. Toxicology, 2005, 206(3): 359-371.
[4] Wang J L, Liu P, Qian Y. Microbial degradation of di-n-butyl phthalate[J]. Chemosphere, 1995, 31(9): 4051-4056.
[5] Staples C A, Peterson D R, Thomas F. et al.The environmental fate of phthalate esters: A literature review[J]. Chemosphere,1997, 35(4): 667-749.
[6] 布坎南 R E, 吉本斯 N E. 简明伯杰氏细菌鉴定手册[M]. 8版. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译. 北京: 科学出版社, 1984.Buchanan R E, Gibbons N E. Bergey’s manual of determinative bacteriology[M]. 8th ed. Translation team of Bergey’s Manual ofDeterminative Bacteriology in Institute of Microbiology,Chinese Academy of Sciences, trans. Beijing: Science Press,1984.
[7] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.DONG Xiu-zhu, CAI Miao-ying. Familiar bacilli system identify enchiridion[M]. Beijing: Science Press, 2001.
[8] 杨宇, 万民熙, 彭宏, 等. 一株黄铜矿专属浸出细菌的分离与鉴定[J]. 中南大学学报: 自然科学版, 2007, 38(4): 639-644.YANG Yu, WAN Min-xi, PENG Hong,et al. Isolation and characterization of bacterium for chalcopyrite bioleaching[J].Journal of Central South University: Science and Technology,2007, 38(4): 639-644.
[9] 邹俐宏, 钱林, 张燕飞, 等. 源自硫化矿区的Acidiphilium属菌的分离及其浸矿性能[J]. 中国有色金属学报, 2008, 18(2):336-341.ZOU Li-hong, QIAN Lin, ZHANG Yan-fei,et al. Isolation and identification ofAcidiphiliumstrain DY from complex sulfide mines and its bioleaching characterization[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(2): 336-341.
[10] Chang B V, Yang C M, Cheng C H, et al. Biodegradation of phthalate esters by two bacteria strains[J]. Chemosphere, 2004,55(4): 533-538.
[11] Jackson M A, Labeda D P, Becker L A. Isolation for bacteria and fungi for the hydrolysis of phthalate and terephthalate esters[J]. Ind Microbiol, 1996, 16(5): 301-304.
[12] Kurane R. Microbial degradation and treatment of polycyclic aromatic hydrocarbons and plasticizers[J]. Annals of the New York Academy of Sciences, 1997, 829: 118-134.
[13] Nalli S, Cooper D G, Nicell J A. Biodegradation of plasticizers byRhodococcus rhodochrous[J]. Biodegradation, 2002, 13(5):343-352.
[14] Nalli S, Cooper D G, Nicell J A. Metabolites from the biodegradation of di-ester plasticizers byRhodococcus rhodochrous[J]. Science of the Total Environment, 2006, 366(1):286-294.
[15] Chao W L, Lin C M, Shiung I I, et al. Degradation of dibutyl-phthalate by soil bacteria[J]. Chemosphere, 2006, 63(8):1377-1383.
[16] Chao W L, Cheng C Y. Effect of introduced phthalate-degrading bacteria on the diversity of indigenous bacterial communities during di-(2-ethylhexyl) phthalate (DEHP) degradation in a soil microcosm[J]. Chemosphere, 2007, 67(3): 482-488.
[17] 李魁晓, 顾继东. 红树林细菌Rhodococcus rubber1 K降解邻苯二甲酸二丁酯的研究[J]. 应用生态学报, 2005, 16(8):1566-1568.LI Kui-xiao, GU Ji-dong. Biodegradation of di-n-butyl phthalate by mangrove microorganismRhodococcus rubber1 K[J].Chinese Journal of Applied Ecology, 2005, 16(8): 1566-1568.
[18] Li J, Chen J A, Zhao Q, et al.Bioremediation of environmental endocrine disruptor di-n-butyl phthalate ester byRhodococcus rubber[J]. Chemosphere, 2006, 65(9): 1627-1633.
[19] Fuller M E,Manning J F. Microbiological changes during bioremediation of explosives-contaminated soils in laboratory and pilot-scale bioslurry reactors[J]. Bioresource Technology,2004, 91(2): 123-133.

