印刷电路板含铜配离子复杂废水脱铜研究
柴立元,尤翔宇,舒余德,杨杰,王云燕
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
随着电子工业的发展,印刷电路板的需求量大大增加,电路板生产中使用的电镀添加剂种类和数量越来越多,成分也越来越复杂。由于在这些添加剂中有与重金属离子配位作用较强的成分,如 EDTA、酒石酸、焦磷酸盐、柠檬酸和氨等[1],因此,印刷电路板行业一般产生含铜配离子的复杂废水。用碱液处理含有铜氨配合物的酞菁蓝生产废水,处理后的铜还有15 mg/L[2],因此,含铜配离子复杂废水在采用传统中和水解沉淀法处理时,重金属离子不能完全形成氢氧化物沉淀,处理后的净化水难以达到国家废水排放标准[3]。如何经济有效地控制印刷电路板废水的污染是电子行业的一项重要课题。本文作者在研究 Cu2+-EDTA-S2--H2O系废水脱铜的热力学基础上,提出强碱性硫化处理印刷电路板含铜配离子复杂废水的新工艺,并考察其有关工艺影响因素,以便为印刷电路板复杂废水的处理提供可行技术和理论基础。
1 Cu2+-EDTA-S2--H2O系的热力学行为
1.1 Cu2+-H2O系平衡Cu2+浓度与pH值的关系
含铜水溶液中,Cu2+主要以 CuOH+,Cu(OH)2(液),和4种配离子形式存在。在温度为 298.15 K时,有关配位反应和逐级累积稳定常数β1~β4分别为[4-6]:

因此,在水溶液体系中,总铜含量可表示为:
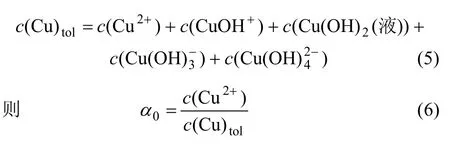
其中:0α表示Cu2+在溶液中的离子分率;c为浓度。将式(1)~(6)联立,得:
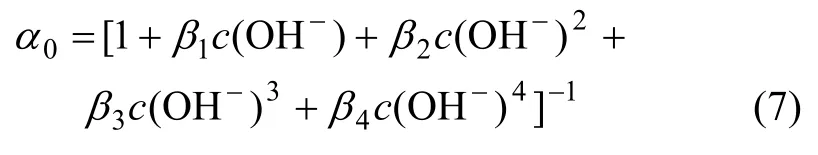
将式(7)代入式(6)可得溶液中游离的Cu2+浓度为:

1.2 Cu(OH)2溶度积对Cu2+浓度的影响
Cu(OH)2在水溶液中会发生溶解平衡,即:
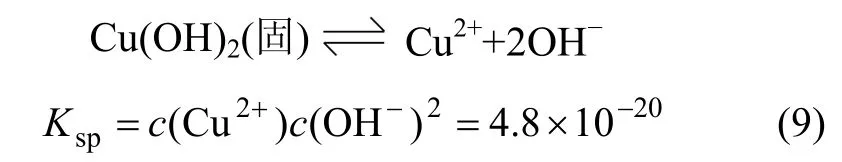
对式(9)两边同时取对数,得:
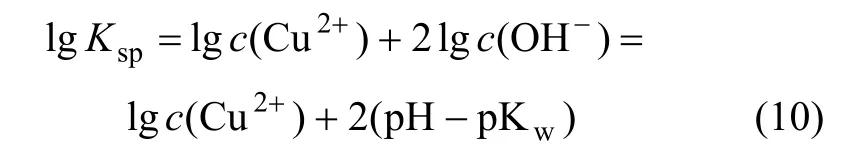
即:
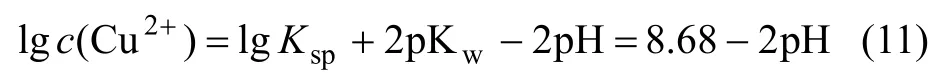
式中:Ksp为Cu(OH)2的溶度积。
1.3 Cu2+-EDTA-H2O系平衡Cu2+浓度与pH值的关系
在Cu-EDTA-H2O溶液中,Cu主要与EDTA(以下用Y代表EDTA配体)形成CuY2-配离子,在一定条件下还会形成CuHY-和Cu(OH)Y3-。Cu与EDTA的相关配位反应及稳定常数[7-9]分别为:
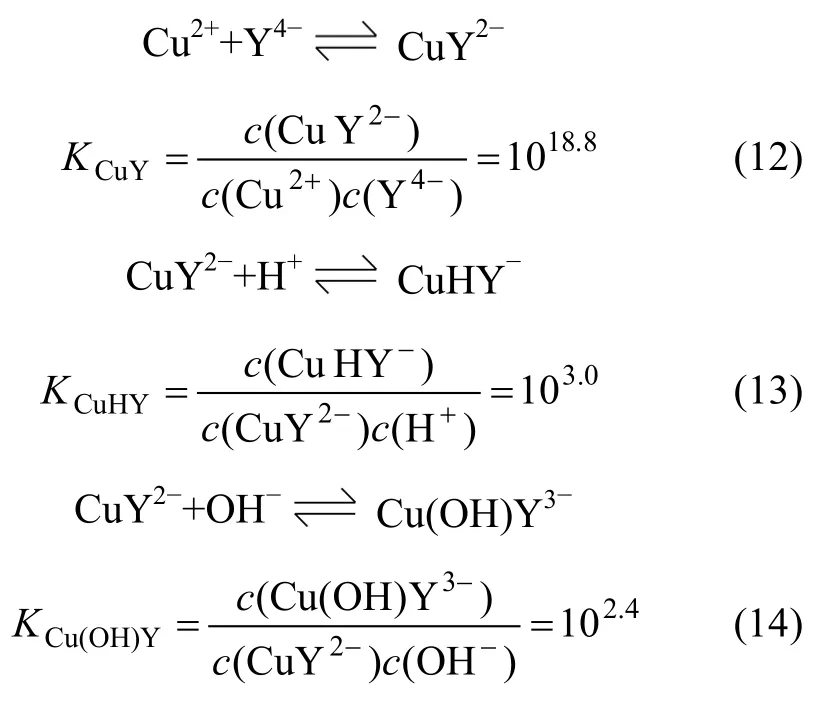
因此,在Cu-EDTA溶液中,总铜含量可表示为:
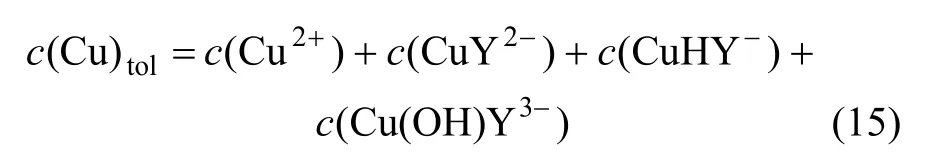
将式(12)~(14)代入式(15),得:
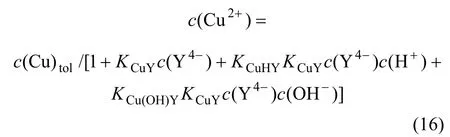
式中:K为稳定常数。
在溶液中,EDTA会发生加合质子的副反应,即EDTA的酸效应,EDTA的酸效应系数为:

其中,β1,β2,β3,β4,β5和β6为 EDTA 的逐级累积常数[8],由式(18)可得不同pH值所对应的αY(H)。由式(17)可得:
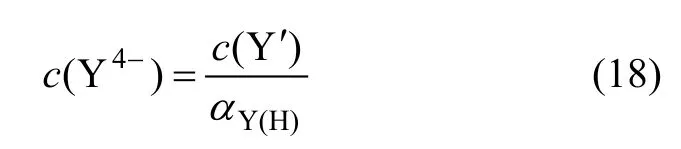
Y′为没有与铜形成配合物的各种形态的EDTA含量的总和,在溶液中 Cu2+主要与 Y4-形成 CuY2-配离子,由 EDTA的存在形式分布图[6]可知,在 pH<8.5时,溶液中 Y4-的离子分率小于 1%,此时,溶液中CuY2-配离子的含量很少,可以忽略不计,即c(Y′)=c(Y)tol;在pH>8.5时,溶液中Y4-的离子分率大于1%,且随着pH值的增大,Y4-的离子分率迅速增大,Cu2+全部或部分与Y4-形成CuY2-配离子。根据不同pH值时 Y4-的浓度可以计算出相应的c(CuY2-),c(Y′)=c(Y)tol-c(CuY2-)。
将所求得的c(Y4-)代入式(16),可得溶液中游离的Cu2+浓度。
当pH<8.5时,
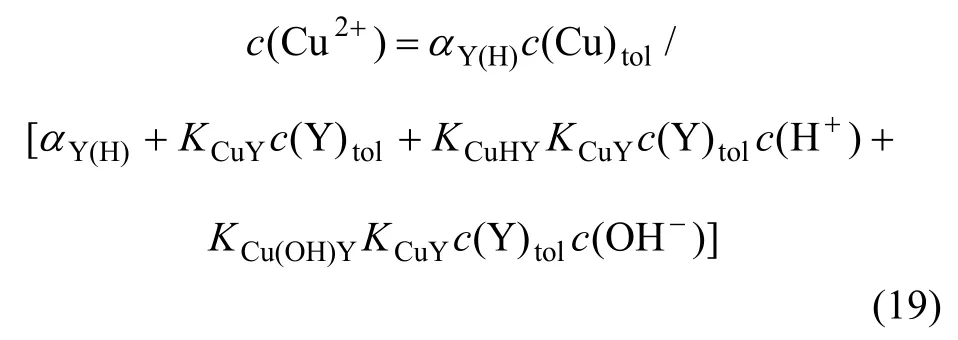
当pH>8.5时,
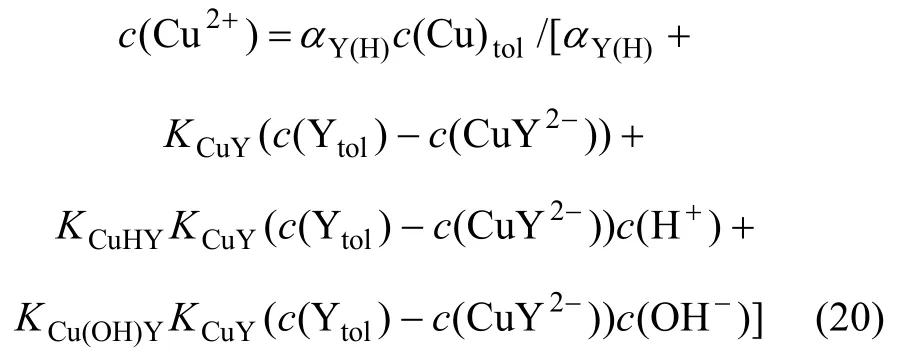
1.4 Cu2+-S2--H2O系平衡Cu2+浓度与pH值的关系
在含硫水溶液中,含有的组分为H+,OH-,H2S,HS-和S2-。此体系的总浓度方程为:

H2S在水溶液中的逐级电离反应及稳定常数K1和K2[9-11]分别为:
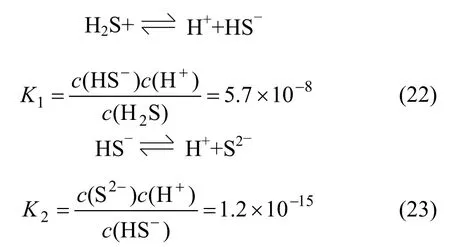
联立(21)~(23),解得:

在有硫离子存在的情况下,会形成CuS沉淀[12],其溶解平衡为:
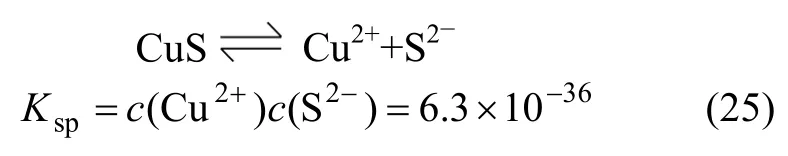
在c(S)tol=0.8×10-3mol/L时,联立式(24)和式(25),可得此时溶液中游离的铜离子浓度为:

根据式(8)绘出 Cu2+-H2O系铜羟合配离子平衡时的lgc(Cu2+)与pH值关系(见图1中曲线1);根据式(11)绘出Cu2+-H2O系的Cu(OH)2(固)溶解平衡时lgc(Cu2+)与pH值关系(见图1中曲线2);根据式(19)和(20)绘出无Cu(OH)2固体时 Cu2+-EDTA-H2O 系lgc(Cu2+)与pH值关系(见图1中曲线3);根据式(26)绘出Cu2+-S2--H2O系lgc(Cu2+)与pH值关系(见图1中曲线4)。从图1可以看出:在pH值为7~14时,Cu2+-S2--H2O系中游离的Cu2+浓度远远小于Cu2+-EDTA-H2O系中Cu2+浓度,表明在实验给定的总铜浓度下用硫化沉淀法可以脱除Cu2+-EDTA-H2O系中的铜。比较图1中曲线1和2可以看出:在实验给定的总铜浓度条件下,没有 EDTA时,7.0<pH<12.5时会出现Cu(OH)2沉淀;但当EDTA存在时,由曲线2和3看出,Cu(OH)2沉淀会转化为EDTA配合离子,表明用中和水解法不能将Cu2+-EDTA-H2O系溶液中的铜脱除。
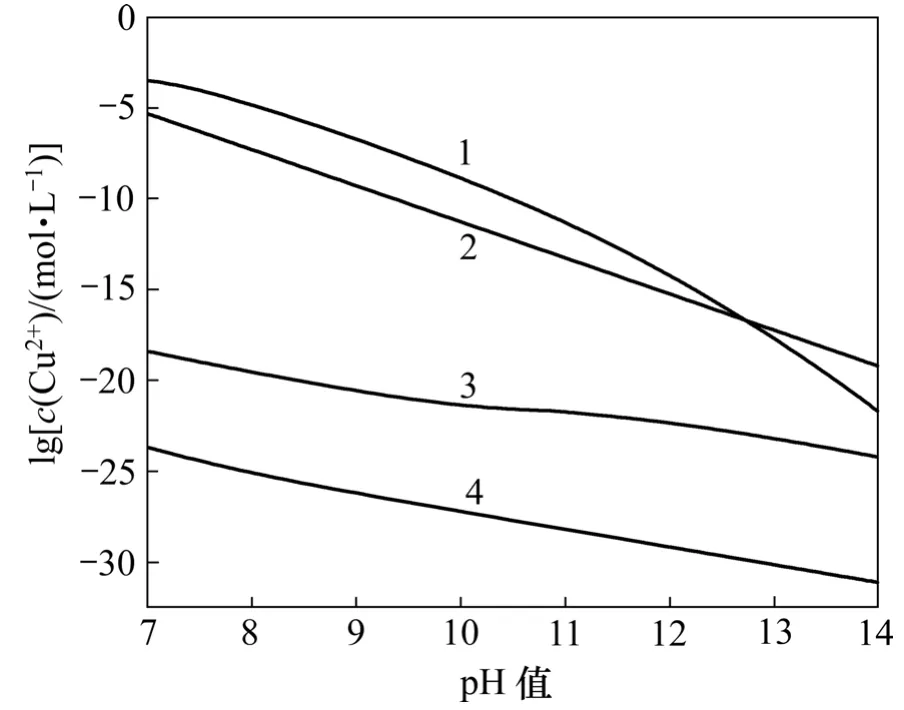
图1 Cu2+-EDTA-S2--H2O系lgc(Cu2+) 与pH值关系Fig.1 Relationship between lgc(Cu2+) and pH value in Cu2+-EDTA-S2--H2O system
2 实验方法
2.1 废水性质
所用废水采用实验室配制模拟废水,按照CuSO4与 EDTA·二钠物质的量比n(CuSO4)∶n(EDTA·二钠)为1∶2配制而成。其中,Cu2+的质量浓度为50 mg/L,EDTA浓度为1.6×10-3mol/L,pH值调整到10.5~11.0。
2.2 实验过程
取200 mL配制好的模拟废水置于500 mL烧杯中,在 300 r/min的搅拌速度下用 10%石灰乳液和10 mol/L NaOH溶液调节废水pH值到一定值,稳定一段时间(水解时间)后加入不同体积的 1 g/L的硫化钠溶液,反应一定时间后,加入不同量的 1%聚丙烯酰胺(PAM)絮凝沉淀,取上清液分析溶液中残余铜离子浓度。
2.3 分析方法
采用WFX-120型原子吸收分光光度计[13]测定原水及净化水中铜的含量,采用岛津UV-1800型紫外分光光度仪在波长200~400 nm范围内对处理前后的水样进行扫描,观察紫外光谱的变化情况。
3 结果与讨论
3.1 水解时间对Cu2+脱除率的影响
将溶液pH值调节到12.5,控制不同的时间,水解时间对Cu2+的脱除率的影响如图2所示。可见:当水解时间由10 min增加到30 min时,Cu2+的脱除率由99.22%增加到 99.56%,Cu2+的残余浓度脱除到0.2 mg/L以下;继续延长时间,脱除率变化不大。因此,选择30 min为最佳水解时间。
3.2 硫化沉淀时间对Cu2+脱除率的影响
从硫化钠全部投到废水中开始计时到反应结束终止,硫化沉淀时间对Cu2+脱除率的影响如图3所示。从图3可以看出:随着时间的延长,Cu2+的脱除率呈上升趋势;当50 min时效果最好,Cu2+的残余浓度为0.176 mg/L,脱除率达到99.56%。

图2 水解时间对Cu2+残余量的影响Fig.2 Effect of hydrolyzed time on residual concentration of Cu2+

图3 Cu2+残余量与硫化沉淀时间的关系Fig.3 Effect of sulfide precipitation time on residual concentration of Cu2+
3.3 pH值对Cu2+脱除率的影响
pH值是影响处理效果的一个重要因素,它直接影响到溶液中离子的存在状态,pH值对 Cu2+脱除率的影响如图4所示。可见:在pH<12.0时,Cu2+的残余质量浓度较高,脱除率低于 20%;在 pH≥12.5时,残余Cu2+质量浓度脱除到0.2 mg/L以下。其原因与S在水中的存在形式有关[10],由式(21)可以看出:当pH<12.5时,硫在溶液中主要以HS-和H2S存在,游离S2-的含量小,约为10-9~10-13mol/L,故活化离子浓度小,这导致了脱铜反应困难;当pH≥12.5时,硫在溶液中以S2-形式存在,S2-分率达99%以上[10],有利于Cu2+以CuS的形式沉淀下来。
3.4 硫化钠加入量对Cu2+脱除率的影响
Na2S的添加量是脱铜的关键,因此,其合适用量是必须要考虑的因素。硫化钠加入量对Cu2+脱除率的影响如图5所示。从图5可以看出,当n(Na2S)∶n(Cu)=1∶1时即能达到很好的处理效果,继续增加Na2S加入量,Cu2+的脱除率并没有显著变化,而且过量的硫会导致出水变黄,引起第2次污染。

图4 pH值对Cu2+残余量的影响Fig.4 Effect of pH on residual concentration of Cu2+
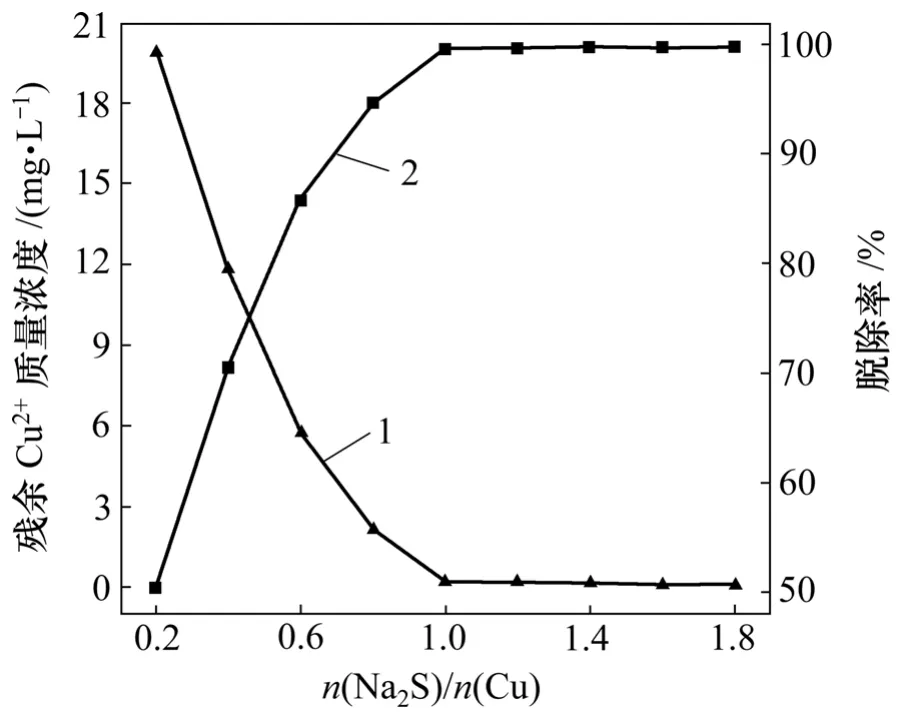
图5 硫化钠加入量对Cu2+残余量的影响Fig.5 Effect of dosage of sodium sulfide on residual concentration of Cu2+
3.5 反应温度对Cu2+脱除率的影响
工业生产中废水温度会随季节和地区的不同而变化,因此,在实验中必须考虑温度对重金属离子脱除的影响。温度对Cu2+残余量的影响见图6。从图6中可以看出:整个反应过程在20~70 ℃范围内,Cu2+的脱除率略有上升,但升幅很小,这说明温度对Cu2+的脱除率影响不大,废水在室温下都能达到很好的处理效果。
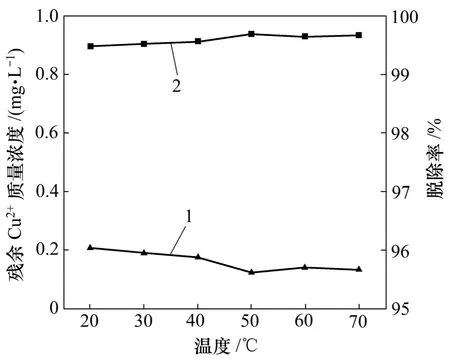
图6 温度对Cu2+的残余量的影响Fig.6 Effect of temperature on residual concentration of Cu2+
3.6 PAM质量浓度对Cu2+脱除率的影响
PAM 质量浓度对 Cu2+的脱除率的影响如图 7所示。可见:增加PAM质量浓度,Cu2+残余质量浓度减少,脱除率增加;当PAM质量浓度大于6 mg/L时,再增加 PAM 质量浓度不会对最终处理效果产生更加明显的影响。PAM对脱铜的影响是因为PAM使细小的CuS沉淀更容易絮凝,有利于沉降分离。
3.7 PAM质量浓度对颗粒沉降速度的影响
为了使处理后的水能够迅速的固液分离,选用PAM 作为絮凝剂,PAM 质量浓度对沉淀效果的影响如图8所示。可见:不添加PAM让生成的颗粒靠自身质量沉淀的速度只有0.32 mm/s,添加PAM可以使颗粒在短时间内迅速长大快速沉淀到杯底,沉淀呈絮状。随着 PAM 质量浓度的增加,颗粒沉降速度逐渐增加,颗粒长大也加快;当PAM质量浓度为6 mg/L时,颗粒的沉降速度达到 1.39 mm/s,再继续加入PAM,颗粒沉降继续略微增加,但增幅很小。从经济运行和成本考虑,选取6 mg/L为最佳PAM质量浓度。
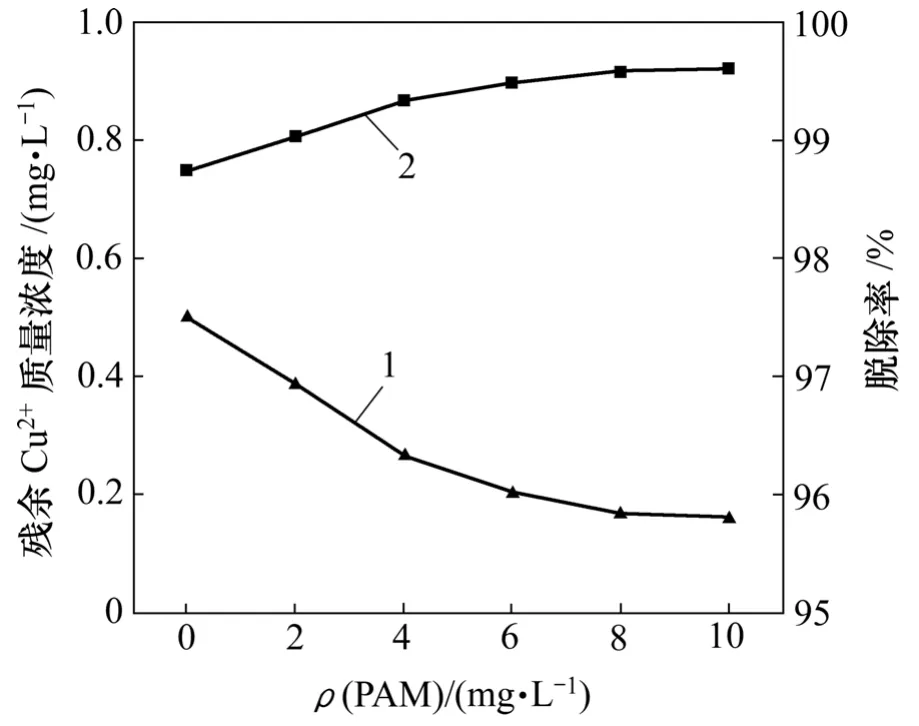
图7 PAM质量浓度对Cu2+残余量的影响Fig.7 Effect of PAM dosage on residual concentration of Cu2+
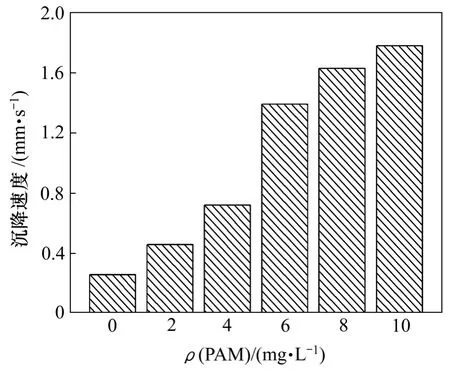
图8 PAM质量浓度对颗粒沉降速度的影响Fig.8 Effect of PAM dosage on precipitation velocity
3.8 最佳条件实验
根据实验确定的最佳条件进行验证实验,处理前Cu2+质量浓度为 50 mg/L,处理后 3个平行样品Cu2+质量浓度分别为0.195 7,0.123 7,0.150 2 mg/L,均低于0.200 0 mg/L。
实验测得的模拟废水处理前后的紫外吸收光谱如图9所示。可见:模拟废水在210~240 nm处有强吸收带,这主要是铜配合离子中的有机络合配体的共轭体系 π→π*跃迁产生的,处理后,吸收峰明显减弱,吸光度降低,表明配合离子被破坏,配位键断裂,络合铜离子绝大部分被去除。

图9 废水处理前后的紫外光谱Fig.9 UV spectral patterns of wastewater before and after treatment
4 结论
(1) Cu2+-EDTA-S2--H2O系各独立热力学行为研究表明传统的中和沉淀法难以脱除 Cu2+-EDTA-S2--H2O系中的铜,采用强碱性硫化沉淀法可以破坏铜与乙二胺四乙酸形成的配位键,从而使铜以硫化沉淀的形式脱除。
(2) 强碱性硫化沉淀法处理印刷电路板废水的最佳实验条件如下:用Ca(OH)2调节pH值到12.5,水解反应时间为 30 min,n(Na2S)∶n(Cu)=1∶1,硫化沉淀时间为50 min,PAM质量浓度为6 mg/L,溶液中残余Cu2+质量浓度低于0.200 0 mg/L,低于《电镀污染物排放标准》(GB 21900—2008)的限值。
[1] 胡惠康, 赵国华. 高浓度络合态铜离子废水的预处理研究[J].工业水处理, 2002(4): 37-40.HU Hui-kang, ZHAO Guo-hua. Researches on the pretreatment of wastewater with highly concentrated copper in complex state[J]. Industrial Water Treatment, 2002(4): 37-40.
[2] 仝武刚, 徐灏龙. 高浓度络合铜废水处理技术简介[J]. 广州环境科学, 2006(1): 10-12.TONG Wu-gang, XU Hao-long. Techniques for the treatment of waste water containing high concentrations of coppercomplexes[J]. Guangzhou Environmental Sciences, 2006(1):10-12.
[3] 汤培平, 王宝璐, 李竟菲, 等. 柔性印制线路板厂废水处理技术工程实践[J]. 工业水处理, 2008, 28(5): 90-92.TANG Pei-ping, WANG Bao-lu, LI Jing-fei, et al. Engineering practice of the treatment of wastewater from flexible printed circuit board factories[J]. Industrial Water Treatment, 2008,28(5): 90-92.
[4] 柴立元, 常皓, 王云燕, 等. Cd2+-H2O系羟合配离子配位平衡[J]. 中国有色金属学报, 2007, 17(3): 487-491.CHAI Li-yuan, CHANG Hao, WANG Yun-yan et al.Equilibrium hydroxyl complex ions in Cd2+-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(3): 487-491.
[5] 陶辉锦, 谢佑卿, 彭红建, 等. 金属元素Cu的热力学性质[J].中国有色金属学报, 2006, 16(7): 1207-1213.TAO Hui-jin, XIE You-ping, PENG Hong-jian et al.Thermodynamic properties of pure elemental Cu[J]. The Chinese Journal of Nonferrous Metals[J], 2006, 16(7): 1207-1213.
[6] Kotrly S, Sucha L. Handbook of chemical equilibria in analytical chemistry[M]. Chichester: Ellis Horwood, 1985: 115.
[7] 张祥麟, 康衡. 配位化学[M]. 长沙: 中南工业大学出版社,1986.ZHANG Xiang-lin, KANG Heng. Coordination chemistry[M].Changsha: Central South University of Technology Press, 1986.
[8] 方景礼. 电镀添加剂理论与应用[M]. 北京: 国防工业出版社,2006.FANG Jing-li. Theory and application of electroplating additives[M]. Beijing: National Defence Industry Press, 2006.
[9] 李梦龙. 化学数据速查手册[M]. 北京: 化学工业出版社,2004.LI Meng-long. Concise handbook of chemical data[M]. Beijing:Chemical Industry Press, 2004.
[10] 陈绍炎. 水化学[M]. 北京: 水利电力出版社, 1989.CHEN Shao-yan. Aquatic chemistry[M]. Beijing: Irrigation and Electrics Press, 1989.
[11] 姚允斌, 解涛, 高英敏. 物理化学手册[M]. 上海: 上海科学技术出版社, 1985.YAO Yun-bin, XIE Tao, GAO Ying-min. Handbook of physical chemistry[M]. Shanghai: Shanghai Science and Technology Press, 1985.
[12] 郑雅杰, 邹伟红, 易丹青, 等. 酒石酸钾钠和EDTA·2Na盐化学镀铜体系[J]. 中南大学学报: 自然科学版, 2005, 36(6):971-976.ZHENG Ya-jie, ZOU Wei-hong, YI Dan-qing et al. Electroless copper plating system of potassium tartrate and EDTA·2Na[J].Journal of Central South University: Science and Technology,2005, 36(6): 971-976.
[13] 《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.Editorial Board of Monitoring and Analysis Method of Water and Waste Water. Monitoring and analysis method of water and waste water[M]. 4th ed. Beijing: China Environmental Science Press, 2002.

