良性前列腺增生线粒体DNA控制区突变
张 涛 ,董子明,熊建荣,刘学进
(1.河南省平顶山煤业集团总医院泌尿外科,河南平顶山 467000;2.郑州大学基础医学院病理生理教研室,河南郑州 450052)
人类线粒体DNA(mitochondrialDNA,mtDNA)是由16569个碱基对组成的双链闭环结构,编码与氧化磷酸化相关的2种rRNA、22 种 tRNA 和 13 种蛋白多肽基因[1]。nt16024~nt16569、nt1~nt575的非编码区共有1120碱基对,称为控制区(control region,D-loop),其中含有重链复制起点和启动子等重要基因,调控mtDNA的复制和转录[2]。近年的研究发现,在肿瘤细胞和衰老的组织细胞中,存在mtDNA的突变。因此,mtDNA尤其是D-loop的突变正逐渐成为肿瘤和老年病研究者关注的热点[3]。本文旨在探讨良性前列腺增生(BPH)细胞mtDNA控制区的突变及其意义。
1 对象与方法
1.1 研究对象
随机选择我院2004年5月~2005年2月行开放手术切除和电切除的BPH患者22例,年龄54~86岁,平均70岁;6例合并高血压病、冠心病,2例合并糖尿病,2例合并肺结核。 切除的前列腺重 25~225 g,平均(63.0±40.2) g,均经病理检查证实为BPH。每个患者无菌条件下留取0.1 g BPH标本1份于液氮中保存备检。同时每个患者抽取静脉血3 ml,分离出淋巴细胞于液氮中保存备检。对照组为本地正常成年人10例,年龄 23~35岁,平均 28岁,前列腺重均<20 g,病理检查证实为正常前列腺。每人取0.1 g前列腺组织1份于液氮中保存备检。
1.2 材料
引物:MT-DNA扩增引物,参照GenBank J01415序列设计 2 对引物,MTP1:5'-CAT TAG CAC CCA AAG CTA AG-3'(15981~16000);MTP2:5'-TAG GCT TTA TGA CCC TGA AG-3'(16530~16511),扩增长度 550 bp;MTP3:5'-GCT AAA GTG AAC TGT ATC CG-3'(16477~16496);MTP4:5'-TGG GGT GAT GTG AGC CCG TC-3'(622~641),扩增长度734 bp;克隆鉴定引物,T7:5'-TAA TAC GAC TCA CTA TAG GGA GA-3';SP6:5'-CAT ACG ATT TAG GTG ACA CTA TAG-3',由生工公司合成,PAGE纯化。
1.3 方法
1.3.1 标本DNA提取 组织块取10~15 mg,外周血柠檬酸盐抗凝,淋巴细胞分离液分离出白细胞,然后用Qiagen公司QIAamp DNA Micro kit提取MT-DNA,按照说明书操作。
1.3.2 MT-DNA PCR扩增 扩增反应体积为 30 μl,10× 缓冲液 3 μl,5 mmol/L 4× dNTP 2 μl、引物 MTP1、MTP2(或 MTP3和 MTP4)各 0.5 μl,Promega 公司高保真 Taq 酶 2 U,上步提取的 MT-DNA 5 μl,去离子水补足 30 μl。 94℃预变性 180 s,94℃变性 40 s,55℃复性 40 s,72℃延伸 50 s,扩增 30 个循环。
1.3.3 电泳分析 取扩增产物10 μl,用1.5%的琼脂糖凝胶电泳,EB染色,256 nm紫外灯下观察结果,在550 bp和734 bp处出现条带为MT-DNA基因扩增产物,照相。
1.3.4 MT-DNA与pGEM-T的重组 用胶回收试剂盒(德国Qiagen公司)回收M-DNA 550 bp和734 bp基因片段;回收的目的基因与pGEM-T连接,4℃过夜,转化入JM109,蓝白筛选得到阳性克隆(pGEM-T-MT1和pGEM-T-MT2)。
1.3.5 重组子的PCR鉴定 选取平板上生长的白色菌落为阳性菌落,转种于 AMP+的 LB平板,37℃培养18~24 h,取少量菌苔溶于去离子水 50 μl中,100℃水浴 10 min,10000 r/min离心5 min,取上清5 μl用克隆鉴定引物T7和SP6进行PCR扩增。
1.3.6 DNA序列分析 对鉴定正确含有pGEM-T-MT1和pGEM-T-MT2的宿主菌培养扩增,提取重组质粒pGEM-T-MT1和pGEM-T-MT2,对插入序列进行DNA测序,测得数据用DNASIS、OMIGA软件进行比对分析。
1.4 统计学处理
组间比较用方差分析,突变碱基数与年龄和前列腺重量的关系用直线回归t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 PCR扩增MT1和MT2电泳结果
预计MT1 PCR扩增片段为550 bp,MT2 PCR扩增片段为734 bp,经琼脂糖凝胶电泳分析,MT1扩增片段位于500 bp与750 bp之间,且接近500 bp MT2扩增片段位于500 bp与750 bp之间,且接近750 bp,与预期结果一致。见图1、2。
2.2 重组克隆pGEM-T-MT1、pGEM-T-MT2的筛选与鉴定结果
由于pGEM-T多克隆位点两侧分别存在T7和SP6启动子序列,因此可以用T7和SP6为引物对载体pGEM-T的多克隆位点是否插入外源基因序列进行PCR筛选鉴定。因此,扩增产物为550+170 bp和734+170 bp的即鉴定为正确重组的 pGEM-T-MT1和 pGEM-T-MT2。 见图 3、4。
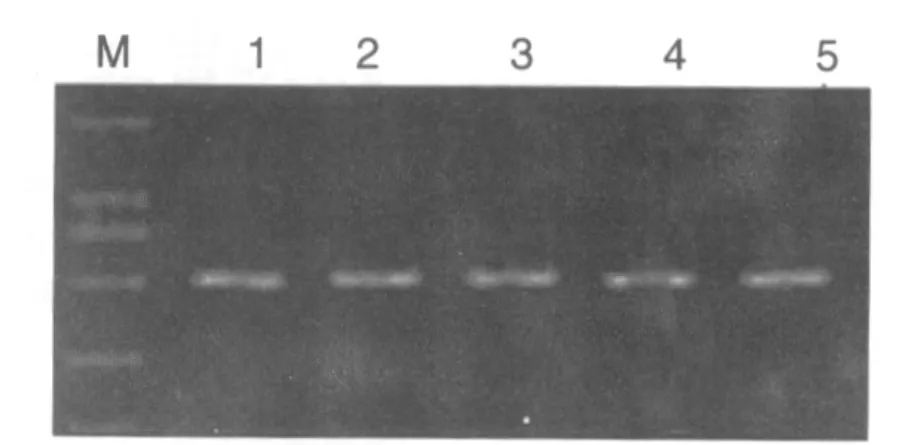
图1 PCR扩增MT1电泳结果Fig.1 Result of PCR amplification MT1 electrophoresis
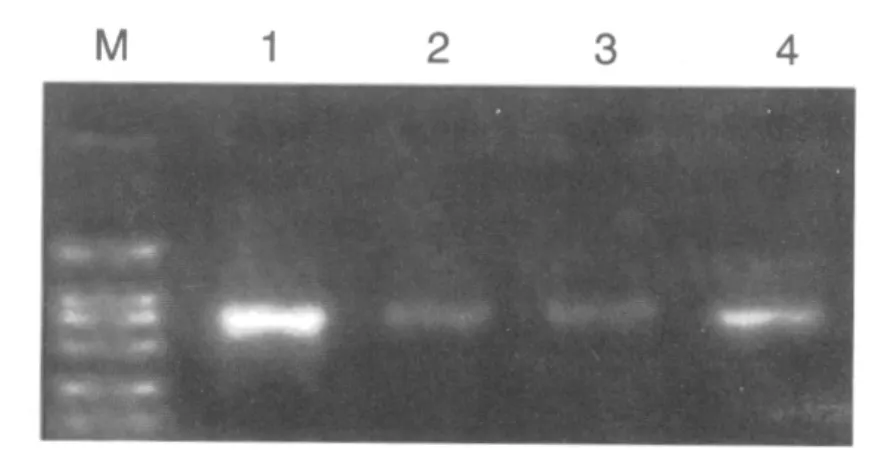
图2 PCR扩增MT2电泳结果Fig.2 Result of PCR amplification MT2 electrophoresis
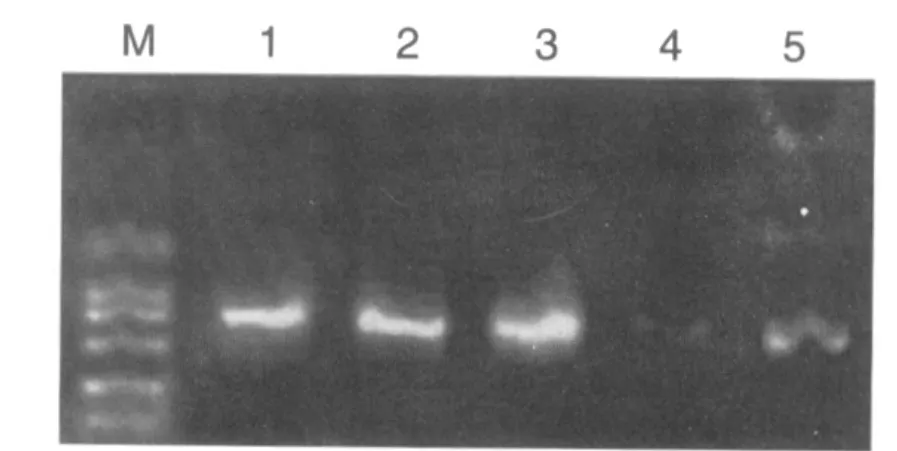
图3 重组克隆pGEM-T-MT1鉴定结果Fig.3 Result of recombination clone pGEM-T-MT1
2.3 Mt-DNA序列分析结果
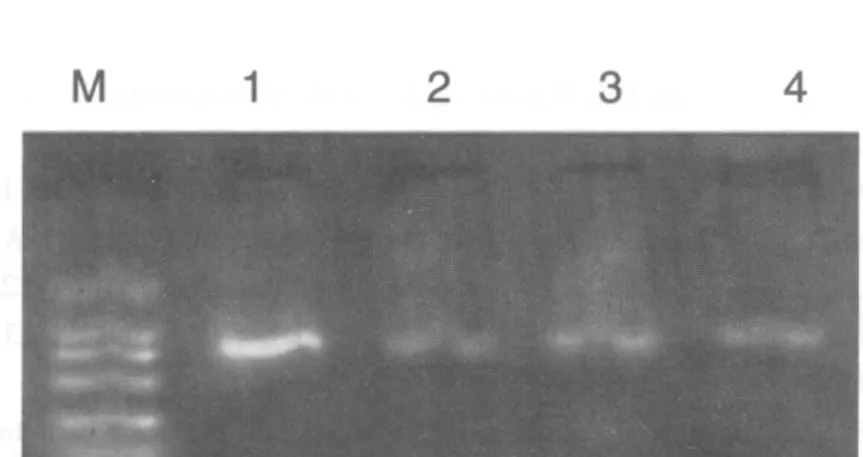
图4 重组克隆pGEM-T-MT2鉴定结果Fig.4 Result of recombination clone pGEM-T-MT2
与剑桥标准序列比较,22例BPH患者,个体的BPH细胞mtDNA 控制区变异的碱基对有 3~16 个[平均(7.36±3.70)个],分布于52个位点上,这些变异分为两种类型,第一种仅存在于BPH细胞的变异,即突变的碱基对有0~9个[平均(3.14±2.90)个]分布于27个位点上;第二种BPH细胞与淋巴细胞同样变异的碱基对有 1~8 个[平均(4.23±1.69)个]分布于 27 个位点上。见表1。

表1 BPH线粒体DNA突变Tab.1 BPH mt DNA mutation
在22份BPH组织中,检测到18份有mtDNA控制区突变,因此,BPH细胞mtDNA控制区的突变率是81%(18/22),突变频率为2.4%(27/1120)。这些突变74%集中在第一高变区(HVⅠ)和第二高变区(HVⅡ),其中有11个位于微卫星不稳定区。突变方式多为点突变,包括转换和颠换,2个位点是缺失。突变碱基数与患者年龄和增生前列腺重量均无相关关系(P>0.05)。由于人类mtDNA具有高度多态性,本研究选择10份正常前列腺作为对照。10份正常前列腺细胞mtDNA控制区有 3~7 个[平均(4.60±1.49)个]碱基对变异,分布于 12 个位点上。见表2。

表2 10例正常前列腺mtDNA变异情况Tab.2 Polymophisms of 10 cases normal prostate mtDNA
正常前列腺细胞mtDNA控制区和BPH第二种类型变异的碱基对数和位点相近,两组比较,差异无统计学意义(P>0.05),表明第二种类型变异是正常多态性,多态性类型与北京地区的报道相近[4]。
3 讨论
线粒体是细胞的能量代谢场所,在进行氧化磷酸化时产生大量的氧自由基,对缺乏组蛋白的保护、直接暴露于线粒体中的线粒体DNA有损伤作用,而线粒体DNA的损伤修复系统又不完善,因此表现出非常高的突变率,文献报道线粒体DNA的突变率比核DNA高几十倍,尤其在控制区,突变率更高[5]。近来研究发现,多种恶性肿瘤、癌前增生性病变和衰老组织中存在mtDNA的突变,Fliss等[6]报道了一些肿瘤mtDNA控制区的突变率:膀胱癌28.6%、肺癌38.5%、卵巢癌32%和头颈部肿瘤23%。值得注意的是,Junjian等[7]发现在前列腺癌和癌前病变上皮内瘤(PIN)中mtDNA控制区突变率高达87.5%,突变频率达3%。
笔者发现BPH细胞mtDNA控制区的突变率为81%,突变频率为2.4%。大部分集中在HVⅠ和HVⅡ,突变类型多为点突变,包括转换和颠换,2个位点是缺失,比较Junjian等[7]的研究结果后显示BPH细胞mtDNA控制区的突变率和突变频率均与前列腺癌相近。Junjian等[7]还发现,前列腺癌mtDNA控制区突变与患者的年龄和肿瘤的分级均没有明显关系,本研究也显示BPH细胞mtDNA控制区突变与患者的年龄和前列腺增生的重量没有相关性;而且也不波及外周血淋巴细胞。BPH细胞mtDNA控制区突变与肿瘤一样都是以点突变为主,但与肿瘤的突变位点却不一致。肿瘤细胞mtDNA在H链复制起点区域存在较多C→T突变,这种突变将降低该区的GC含量,导致mtDNA复制失控[8]。本研究结果显示,BPH细胞mtDNA控制区这种突变很少,这可能解释为什么BPH与恶性肿瘤的生物学行为不同;关于mtDNA突变的意义,有学者认为只是随机的改变,对疾病并无影响;但在肿瘤细胞,有学者研究认为mtDNA突变的基因片段能够游走并且整合到核基因组而诱发癌变[9-10];而在衰老组织中,mtDNA突变的热点是编码区,该区往往存在长片段缺失。由于mtDNA编码的都是与氧化磷酸化有关的RNA和蛋白多肽,当缺失比率达到一定阈值后导致线粒体能量代谢和其他功能的异常而诱发细胞凋亡,进一步引起组织器官功能减退[11-12]。BPH和肿瘤一样细胞凋亡是减少的,由此看来,BPH的发病不是一个简单的衰老过程,在mtDNA突变方面与肿瘤有某些相似之处。
综上所述,本研究发现BPH细胞mtDNA控制区存在较高的突变率和突变频率,这些突变既不随前列腺增大和增龄而积累,也不波及外周血淋巴细胞,其意义有待进一步研究。
[1]Anderson S,Bankier AT,Barrell BG,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981,290(5):457-465.
[2]Hao H.Functional and structural features of a tandem duplication of the human mtDNA promoter region[J].Am J Hum Genet,1997,60(6):1363-1372.
[3]Penta JS,Johnson FM,Wachsman JT,et al.Mitochondrial DNA in human malignancy[J].Mutation Res,2001,488(2):119-133.
[4]Young WY,Zhao L,Qian Y,et al.Extremely low penetrance of hearing loss in four Chinese families with the mitochondrial 12S rRNA A1555G mutation[J].Biochem Biophys Res Commun,2005,328(4):1244-1251.
[5]Johns DR.Mitochondrial DNA and disease[J].N Engl J Med,1995,333(10):638.
[6]Fliss MS,Usadel H,Caballero OL,et al.Facile detection of mitochondrial DNA mutations in tumor and bodily fluids[J].Science,2000,287(5):2017-2019.
[7]Junjian ZC,Neriman G,Graham FG,et al.Extensive somatic mitochondrial mutations in primary prostate cancer using LCM[J].Cancer Res,2002,62(22):6470-6474.
[8]Vijay AV,Chaistopher MC,Karen LA,et al.Non-isotopic in situ hybridization method for mitochondria in oncocytes[J].Histochem Cytochem,1994,42(2):273-276.
[9]Zullos A.Mitochondrial D-loop sequences are integrated in the rat nuclear genome[J].Mol Biol,1991,211(2):1223-1227.
[10]Dombroshi BA.Isolation of an active human transposable element[J].Science,1991,278(3):1805-1809.
[11]Papiha SS,Rathod H,Briceno I,et al.Age related somatic mitochondrial DNA deletions in bone[J].Clin Pathol,1998,51(2):117-120.
[12]Ozawa T.Mitochondrial DNA mutation and age[J].Ann NY Acad Sci,1998,854(6):128-154.

