安体舒通对 2型糖尿病大鼠肾脏的保护作用及对肾组织 mcp-1表达的影响
安徽医科大学附属省立医院内分泌科(合肥 230001)张 丽 李素梅 叶山东 翟 斐 章 容
糖尿病肾病(Diabetic nephropathies,DN)是糖尿病最常见和最严重的慢性并发症之一,细胞因子在DN发病中的作用越来越受到人们关注。国外不少研究表明,醛固酮拮抗剂安体舒通能够减轻肾脏的炎症反应,减轻肾小球硬化,延缓 DN的进展,但其具体机制不清。本实验就安体舒通对 2型糖尿病大鼠肾脏的保护作用进行观察,并着重从影响细胞因子 mcp-1表达的角度探讨其可能机制。
材料与方法
1 材 料
1.1 实验动物 健康 SD大鼠 30只,雄性,2月龄,体重 150±20g,由安徽省实验动物中心提供。
1.2 药物和试剂 链脲佐菌素(美国 Sigma公司),安体舒通(杭州民生药业集团有限公司),视黄醇结合蛋白酶联免疫试剂盒(上海德波生物技术有限公司),白蛋白放射免疫试剂盒(中国医学科学院协和医学科技有限公司),尿 MCP-1 ELISA试剂盒(Bio Source International Inc,美国 ),Trizol和 PCR试剂盒(Fermentas,立陶宛)。引物合成于上海生物工程技术服务有限公司,序列如下:MCP-1的上游引物为 5′-CACCTGCTGCTACTCATTCACT-3′,下游 引物 为5′-GTTCTCTGTCATACTGGTCACT TC-3′,目 的片段 为 349bp; GAPDH的 上 游 引 物 为 5′-TCCCTCAAGATTGTCAGCAA-3′,下游引物为 5′-AGATCCACAAACGGATACAT T-3′,目 的 片 段 为308bp。
1.3 主要仪器设备 英国 DREW公司 DS-5型糖化血红蛋白检测仪,安徽合肥众成机电公司 DFM-96型 10管放射免疫γ计数仪,江苏南京国营华东电子管厂 DG-3022A型酶联免疫检测仪,美国 Nano-Drop公司 ND1000紫外 /分光光度仪,德国 biometra PCR仪。
2 方 法
2.1 2型糖尿病大鼠模型的制备及分组
2.1.1 饮食诱导胰岛素抵抗:普通雄性 SD大鼠30只,体重 150~ 170g。 随机分成两组:对照组 (n=10),喂以常规饲料;模型组(n=20),喂以高糖高脂饲料 (常规饲料加 20% 蔗糖、10% 猪油、2.5% 胆固醇)。饲养 5个月,测空腹血糖(FBG)及血浆胰岛素水平 (FINS),并计算胰岛素敏感性指数:ISI=-In(1/FBG×FINS)。血标本在 1% 戊巴比妥麻醉下(30mg/kg)从心脏采取。血糖测定采用美国 One TouchⅡ血糖仪和试纸条,胰岛素测定采用成都市华西糖尿病科技开发研究所的免疫活性胰岛素放射免疫试剂盒。
2.1.2 小剂量链脲佐菌素(STZ)注射诱导糖尿病:高糖高脂饮食 5个月后,模型组动物腹腔多次性(最多 3次)注射 STZ 25 mg/kg(溶解于新鲜配制的 0.1 mol/L枸橼酸缓冲液中,pH值为 4.2)。对照组动物仅注射等量枸橼酸缓冲液。注射后 1周测非空腹血糖及胰岛素值,并作胰岛素抑制试验,以 60 min、90 min和 120 min 3点血糖及胰岛素平均值作为稳态血糖(Steady state plasma glucose,SSPG)、稳态血胰岛素(Steady state plasma insulin,SSPI)值,以衡量胰岛素敏感性的程度。
2.1.3 动物分组及给药方法:以非空腹血糖≥11.0mmo1/L,伴胰岛素敏感性降低两条件作为 2型糖尿病模型成功标准。将模型组模型成功动物(n=18)再随机分成糖尿病组(n=9)和治疗组(n=9)。治疗组动物给安体舒通(20mg/kg),每日清晨灌胃,共 8周。其余两组动物灌以生理盐水作对照。
2.2 检测指标及方法
2.2.1 生化指标的检测:尿白蛋白(Albumin,ALB)检测采用竞争放射免疫分析法(天津协和医学公司);尿视黄醇结合蛋白(Retinol-binding protein,RBP)检测采用 ELISA(上海德波生物技术有限公司);尿 MCP-1检测用双抗体夹心 ELISA法 (美国Bio Source公司);糖化血红蛋白 Ale(Glycosylated hemoglobin,HbAle)采用微柱层析法检测。血钾采用国产迅达 XD687电解质分析仪。
2.2.2 组织病理学观察:第 8周留处死大鼠取肾脏组织,左肾用于计算肾脏肥大指数。取右肾部分肾组织置于液氮中保存用于做逆转录 PCR,其余用来观察肾脏病理改变。计算肾小球基底膜足突融合率。
2.2.3 肾组织中 mcp-1的 RT-PCR检测:严格按照说明书进行逆转录 PCR的操作。以 MCP-1条带与 GAPDH条带光密度比值表示 MCP-1 mRNA的相对表达量;采用 CT值法对基因表达产物进行相对定量。
结 果
1 各组大鼠血糖及 HbAlc水平比较 见表 1。第8周,D、S组血糖均显著高于 C组 (P<0.01),D、S两组间无显著性差异(P> 0.05)。第 8周,D、S组 HbAlc均显著高于 C组(P<0.01),D组和 R组两组间无显著性差异(P> 0.05)。
表1 各组大鼠血糖及 HbAlc水平比较(±s)
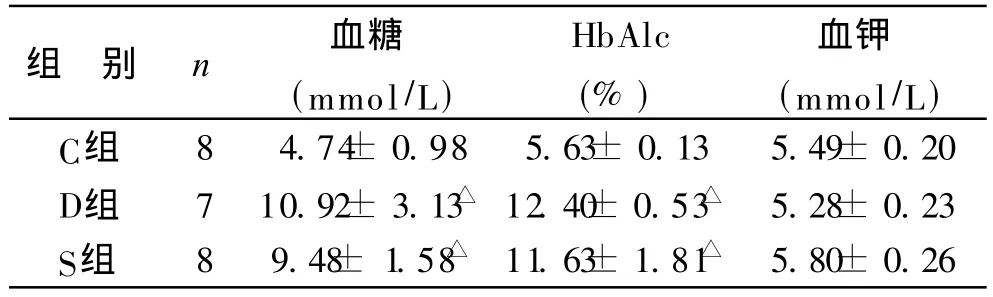
表1 各组大鼠血糖及 HbAlc水平比较(±s)
注:与正常对照组相比,△P<0.01
组 别 n 血糖(mmol/L)HbAlc(%)血钾(mmol/L)C组 8 4.74± 0.98 5.63± 0.13 5.49± 0.20 D组 7 10.92± 3.13△ 12.40± 0.53△ 5.28± 0.23 S组 8 9.48± 1.58△ 11.63± 1.81△ 5.80± 0.26
2 各组尿生化结果及肾脏肥大指数比较 见表2。 第 8周时,与 C组相比,D组和 S组大鼠尿 ALB、RBP、MCP-1排泄率均显著升高(P<0.01);与 D组相比,经安体舒通治疗后,S组上述各项指标均明显下降(P<0.01)。肾脏肥大指数:D组和 S组较 C组明显增加(P<0.01);与 D组比较,S组肾脏肥大指数明显降低(P <0.01)。
3 电镜结果 见附图。 C组结构清晰,基底膜均匀一致,无足突细胞融合。D组肾小球毛细血管基底膜厚薄不均,总体呈明显增厚,结构模糊不清,足突增粗、破坏、融合、消失,足突融合率高达 80%,系膜基质增多、肿胀,系膜区扩大,系膜细胞肿胀。 S组基底膜均匀一致,无明显增厚,有少量足突细胞融合,足突融合率为20%。
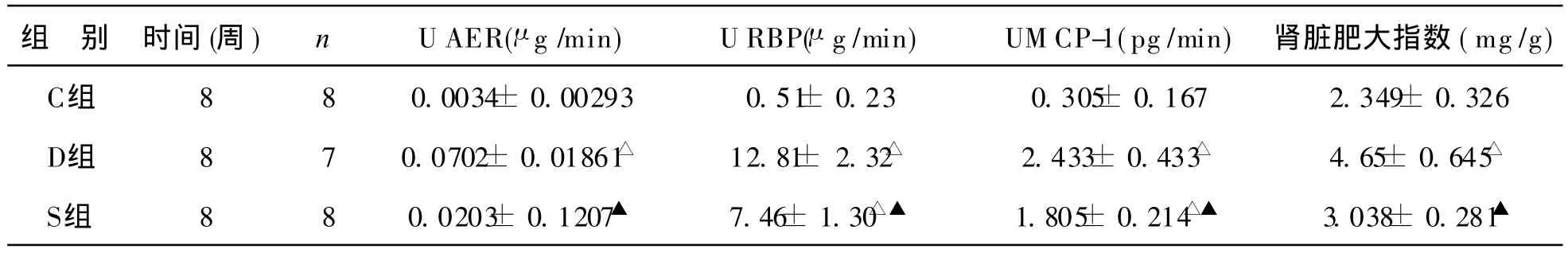
表2 各组尿生化结果及肾脏肥大指数比较

附图 3组大鼠肾脏电镜观察结果 (铀铅染色×15 000)
4 肾组织 mcp-1 m RNA的表达 见表 3。D组肾组织 mcp-1 mRNA的表达显著高于 C组(P<0.01),S组亦明显高于 C组(P<0.05);与 D组比较,S组肾组织 mcp-1 mRNA的表达明显降低(P<0.05)。
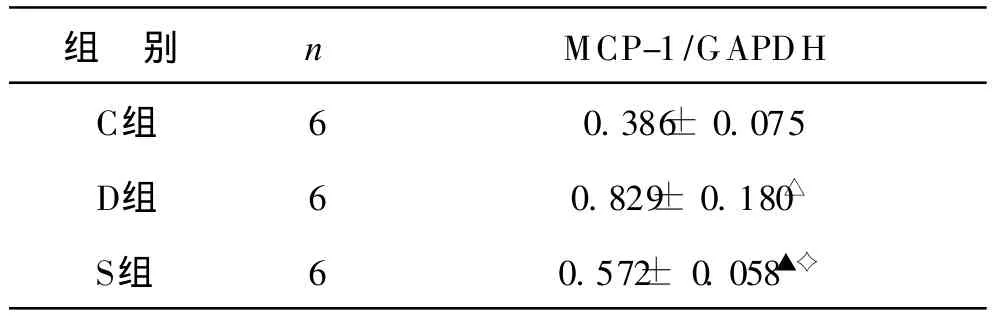
表3 各组大鼠 MCP-1基因表达半定量结果
5 相关性分析 UMCP-1排泄率与 UAER(r=0.800,P<0.01)、URBP排泄率(r=0.911,P<0.01)、肾脏肥大指数(r=0.771,P<0.01)呈正相关。
讨 论
醛固酮是盐皮质激素,主要在肾集合小管通过保钠排钾调节电解质平衡和细胞外液容量。近年来临床研究和动物实验显示醛固酮在糖尿病肾病的发生发展中起着重要作用,抑制醛固酮系统对糖尿病肾损害有明显治疗作用[1~3]。在我们的实验中观察到,与糖尿病组相比,安体舒通治疗组明显降低 24h尿蛋白及尿视黄醇结合蛋白的排泄,抑制肾小球肥大。电镜观察病理结果显示病理形态的肾小球细胞外基质明显减少。上述结果提示对糖尿病肾损害存在一定程度的保护作用。这些结果与先前的研究报道[4],在肥胖大鼠和 db/db小鼠的 2型糖尿病模型中用醛固酮受体阻滞剂(MR)对其进行干预治疗所致的减少蛋白尿,胶原沉积以及肾小球肥大方面的作用是一致的。实验中还观察到,与糖尿病组相比安体舒通组大鼠血糖无明显变化,提示其具有独立于降糖作用以外的肾脏保护作用。
炎性机制在糖尿病肾病的发病中起着重要作用。在早期糖尿病肾病患者,尿 mcp-1以及急性期炎症标志物表达增加[5]。近年来研究认为 MCP-1通过单核巨噬细胞介导肾小管间质炎症、肾小管萎缩和间质纤维化,加重 DN的进展[6]。单核细胞趋化蛋白-1(MCP-1)是 CC趋化因子家族中的一员,它的主要功能是趋化和激活单核细胞至炎症部位。在 DN中,单核 /巨噬细胞可以通过释放蛋白水解酶和氧活性物质导致肾小球结构损伤,并可释放改变肾小球功能的细胞因子而致肾小球结构重塑。
中医中药对糖尿病肾病有一定治疗作用[7~11],本组实验再次证实:安体舒通治疗组 mcp-1mRNA的表达明显低于糖尿病组。尿 MCP-1排泄率与尿白蛋白和视黄醇结合蛋白排泄率以及肾脏肥大指数呈正相关。提示:炎症因子 MCP-1参与糖尿病肾损害的发生,安体舒通能够抑制 mcp-1的表达,通过减轻炎症反应保护肾脏。
安体舒通保护糖尿病大鼠肾损害,减少尿和肾组织 mcp-1的表达,其机制可能与安体舒通抑制醛固酮所致的活化 NF-к B,上调 mcp-1的表达有关。 Sun等[12]报道在血管组织醛固酮所致的 mcp-1表达增加是通过 NF-к B介导的。醛固酮诱导的 NF-к B转录活性的增高,安体舒通可以抑制其所致的转录活性。以 NF-к B抑制剂治疗亦可以消除 mcp-1的过度表达。 Han等[13]通过对 2型糖尿病大鼠模型分别予以醛固酮治疗和醛固酮治疗后安体舒通治疗,结果证明醛固酮增加mcp-1的合成,与肾小球系膜细胞和血浆凝血致活酶成分中 NF-к B的活化有关。安体舒通治疗可以减少醛固酮活化 NF-к B介导的 mcp-1的合成增加,通过减少肾脏的炎症过程减轻肾小球硬化。
另外,安体舒通作为一种醛固酮拮抗剂有潜在的导致高钾血症的可能。在本组实验中,各组间血钾水平没有明显的差别,可能与我们的干预治疗时间不够长有关。
综上所述,安体舒通主要通过抑制醛固酮所致NF-к B活化,下调糖尿病大鼠肾小球中 mcp-1的表达。减少尿白蛋白排泄及其炎症反应,减少胶原沉积,抑制肾脏纤维化,显示出独立于降糖作用以外的肾脏保护作用。因此,在保护 ST Z诱导的 2型糖尿病大鼠肾损害方面,安体舒通治疗是一种较有效的方法。
[1]Eddy AA.Plasminogen activator inhibitor-1 and the kidney.Am J Physiol Renal Physiol,2002,283:209-220.
[2]Vassalli JD,Sappino AP,Belin D.The plasminogen activator/plasmin system.J Clin Invest,1991,88:1067-1072.
[3]Nicholas SB,Aguiniga E,Ren Y,et al.Plasminogen activator inhibitor-1 deficiency retards diabetic nephropathy.Kidney Int,2005,67:1297-1307.
[4]GuoC,Martinez-Vasquez D,Mendez GP,et al.Mineralocorticoid receptorantagonistreduces renal injury in rodent models oftypes 1 and 2 diabetes mellitus.Endocrinology,2006,147:5363-5373.
[5]Dalla-Vestra M,M ussap M,Gallina P,et al.Acutephase markers of inflammation and glomerular structure in patients with type 2 diabetes.J Am Soc Nephrol,2005,16(Suppl1):78-82.
[6]Kivici S,Erturk E,Budak F,et al.Serum monocyte chemoattractant protein-1 and monocyte adhesion molecules in type 1 diabetic patients with nephropathy.Arch Med Res,2006,37(8):998-1003.
[7]党玉兰.益肾蠲毒汤治疗Ⅳ期糖尿病肾病 52例.陕西中医,2006,27(8):916-917.
[8]谢永侠,张福兰,苏荣芝.二元糖肾煎治疗 2型糖尿病肾病 30例.陕西中医,2006,27(8):921-923.
[9]焦 玲,侯爱萍.参芪地黄汤配合西药治疗糖尿病肾病 35例.陕西中医 ,2006,27(8):923-924.
[10]曾菁蓉.桃红参芪饮配合西药治疗早期糖尿病肾病 48例.陕西中医 ,2009,30(4):408-409.
[11]孙岚云.补肾活血通络法配合西药治疗Ⅲ期糖尿病肾病25例.陕西中医,2009,30(8):972-973.
[12]Sun Y,ZhangJ,Lu L,et al.Aldosterone-induced inflammation in the rat heart:role of oxidative stress.Am J Pathol,2002,161(5):1773-1781.
[13]Han SY,Kim CH,Kim HS,et al.Spironolactone prevents diabetic nephropathy through an antiinflammatory mechanism in type 2 diabetic rats.J Am Soc Nephrol,2006,17(5):1362-1372.

