依曲替酸上调Fas、FasL诱导皮肤鳞癌细胞凋亡的实验研究
林秀英 韩振东 王佳勇 崔尧 张忠太
(齐齐哈尔医学院附属第三医院皮肤科,黑龙江 齐齐哈尔 161000)
近年来,接受肾移植的患者也越来越多。据统计,30%~58%的肾移植患者在移植后可并发皮肤鳞状细胞癌(以下简称鳞癌),其极具侵袭性,严重影响肾移植患者的身体健康[1]。临床研究[2]表明,依曲替酸可有效抑制肾移植患者并发的皮肤鳞癌的生长。体外实验发现,依曲替酸能够诱导皮肤鳞癌细胞系SCL-1细胞凋亡[3],但其抗癌机制尚未完全阐明。本研究应用依曲替酸处理皮肤鳞癌细胞系SCC13细胞,观察依曲替酸诱导细胞凋亡的情况,并探讨其可能的分子转导机制,为临床治疗提供实验依据。
1 资料与方法
1.1 主要材料和试剂 依曲替酸购自重庆华邦药业公司。细胞培养液、胎牛血清购自美国Hyclone公司。二甲基亚砜(DMSO)为美国Sigma公司产品。Cell Death Detection ELISAPLUS试剂盒购自德国Roche公司。Annexin-V-FITC检测试剂盒购自北京天根生化科技有限公司。Trizol RNA提取试剂为Invitrogen公司产品。cDNA第1链合成试剂盒、Real-MasterMix新型荧光定量PCR试剂盒(SYBR Green)购自北京天根生化科技有限公司。引物由北京赛百盛公司合成。Fas中和抗体ZB4购自美国Upstate公司。SCC13细胞系由德国柏林自由大学惠赠。依曲替酸用DMSO配置成 1×10-1mol◦L-1的贮存液-20℃避光保存,实验时用培养液稀释。
1.2 方法
1.2.1 细胞培养 SCC13细胞生长于含10%胎牛血清、100 U◦mL-1青霉素、100 U◦mL-1链霉素的DMEM培养液中,置于5%CO2、37℃孵箱中传代培养。
1.2.2 Cell Death Detection ELISA检测细胞凋亡于对数生长期向SCC13细胞中加入浓度分别为5×10-7、1×10-6、5 ×10-6、1 ×10-5、5×10-5mol◦L-1依曲替酸各3个复孔,对照组加等体积的DMSO,分别培养1、3、5 d后按试剂盒说明书检测凋亡。
1.2.3 Annxin-V和PI结合实验检测早期凋亡 1×10-5mol◦L-1的依曲替酸作用于SCC13细胞72 h后,收集细胞,Annxin-V和PI染色后,流式细胞仪检测凋亡细胞。实验步骤按试剂盒说明书操作。
1.2.4 实时荧光定量 RT-PCR检测 Fas、FasL mRNA表达 采用Primer 5.0软件设计Fas、FasL及内参基因 β-actin引物。Fas引物上游:5′-AAGTGACTGACATCAACTCC-3′、下游 :5′-CCACTTCTAAGCCATGTCC-3′, 扩增产物270bp;FasL 引物上游:5′-ACATGAGGAACTCTAAGTATCCC-3′、下游:5′-CAAAATTGACCAGAGAGAGC-3′,扩增产物 174 bp;β-actin 引物上游:5′-TCATCACCATTGGCAATGAGC-3′、下游:5′-CAGCACTGTGT TGGCGTACA GGT-3′,扩增产物158 bp。收集经 1×10-5mol◦L-1依曲替酸作用 0、6、12、24、36、48 h 的 SCC13细胞,按T rizol试剂说明书提取细胞总RNA,定量测定后按cDNA第1链合成试剂盒说明书进行RT反应,逆转录反应条件:70℃5min,25℃10min,42℃50min,95℃5min;在 RG3000定量PCR仪上,按照RealMasterMix新型荧光定量PCR试剂盒说明书进行PCR反应:95℃起始变性2min,94℃变性20 s,56℃退火30 s,68℃延伸30 s。用双标准曲线法对Fas、FasL基因进行相对定量测定。
1.2.5 阻断实验 1μg◦mL-1Fas中和抗体ZB4预处理 SCC13细胞10min后,加入1×10-5mol◦L-1依曲替酸,作用24 h,用Annxin-V和PI结合实验检测细胞凋亡,同时以单独应用ZB4、依曲替酸和对照组SCC13细胞做比较,实验重复3次。
1.2.6 统计学处理 数据用SPSS12.0统计包进行方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 依曲替酸对细胞的凋亡诱导作用 随着依曲替酸作用浓度的增加,SCC13细胞凋亡程度逐渐升高;在相同的作用浓度下,随着药物作用时间的延长,细胞凋亡程度亦逐渐升高,呈现明显的浓度及时间依赖性,P<0.05。(图1)。
2.2 Annexin-V和PI双标记法检测凋亡率 对照组早期凋亡率仅为6.18%(图1A),依曲替酸处理SCC1372 h后,细胞的早期凋亡现象明显,Cell Quest软件分析其72 h细胞早期凋亡率为26.27%(图1B)。
2.3 Fas、FasL mRNA表达变化 分析实时定量PCR结果,以0 h组为基准,预设其 Fas、FasL mRNA表达水平均为 1.0,经依曲替酸作用 12、24、36、48 h的SCC13细胞Fas、FasL mRNA表达水平均显著上升,与0 h组比较差异有统计学意义(P<0.05)。而依曲替酸作用SCC13细胞6 h后的Fas,FasL mRNA表达水平与0 h组比较无显著差异(表1)。

图1 Annexin-V和PI双标记法检测依曲替酸诱导SCC13细胞凋亡

表1 依曲替酸作用SCC13细胞不同时间点后FAS,FASL mRNA相对定量结果
2.4 阻断实验结果 单独应用Fas中和抗体ZB4对细胞的凋亡无明显影响作用。单独应用依曲替酸的早期凋亡率为(16.76±1.04)%,与ZB4共同处理SCC13后,早期凋亡率下降为(7.12±0.85)%,表明ZB4可有效阻断依曲替酸诱导的凋亡(P<0.05,图 2)。
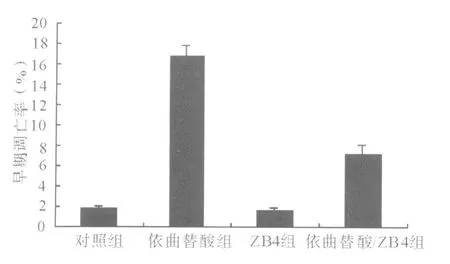
图2 ZB4对依曲替酸诱导SCC13细胞凋亡的阻断作用
3 讨 论
依曲替酸是第2代维甲酸类药物。维甲酸类药物具有广泛的生物活性,能抑制多种肿瘤细胞增殖及诱导肿瘤细胞分化,是目前唯一可有效预防皮肤肿瘤的化合物[4]。一些临床试验和病例报告证实依曲替酸能有效地预防实体器官移植患者并发的皮肤非黑色素肿瘤的生长,尤其是减少肾移植患者鳞癌和日光性角化病的发生[2]。也有报道[5-6]依曲替酸能治疗原发性多发的皮肤疣状癌及银屑病患者因应用光化学疗法后并发的皮肤多发鳞癌。
凋亡是机体清除肿瘤细胞的一种重要方式,许多抗癌药物是通过诱导凋亡而发挥治疗作用的。本研究ELISA实验结果表明,依曲替酸能诱导皮肤鳞癌细胞SCC13凋亡,并与药物有明显的浓度及时间依赖性。Annxin-V和PI结合实验进一步证实这种凋亡的诱导作用。
目前认为主要有2条通路参与细胞凋亡的发生,即外源性死亡受体通路和内源性线粒体通路[7]。Fas/FasL通路是重要的外源性途径。Fas与FasL相结合,通过Fas相关死亡结构域(FADD)启动凋亡的发生。Fas/FasL介导的信号转导途径的异常可促进皮肤肿瘤的发生和发展。应用药物调控肿瘤细胞凋亡,诱导Fas分子的表达以逆转肿瘤细胞对凋亡的抵抗作用是皮肤鳞癌治疗药物的作用机制之一。本研究发现,依曲替酸作用SCC13细胞12 h后,肿瘤细胞体内Fas与FasL的mRNA表达水平显著升高,并与作用时间有明显的依赖性,这与ELISA实验结果是一致的,提示Fas参与了依曲替酸诱导的皮肤鳞癌细胞凋亡。Fas诱导的凋亡是通过Fas与FasL的结合启动的。ZB4作为中和性抗体可通过影响Fas与FasL的结合而阻断凋亡的发生。本研究中的阻断实验结果表明,单独应用ZB4不能阻断凋亡,当与依曲替酸共同作用后肿瘤细胞的凋亡率显著下降,因此进一步证明Fas与FasL的结合参与了依曲替酸诱导的凋亡。
1 Renata VC,Mirian NS,Luiz SA,et al.Acitretin and skin cancer in kidney transplanted patients.Clinical and histological evaluation and immunohistochemical analy sis of lymphocytes,natural killer cells and Langerhans cells in sun exposed and sun protected skin[J].Clin T ransplant,2005,19(1):115-121.
2 Kovach BT,Murphy G,Otley CC,et al.Oral retinoids for chemoprevention of skin cancers in organ transplant recipients:results of a survey[J].T ransplant Proc,2006,38(5):1366-1368.
3 Lin XY,He CD,Xiao T,et al.Acitretin induces apoptosis through CD95 signaling pathway in human cutaneous squamous cell carcinoma cell line SCL-1[J].J Cell Mol Med,2009,13(9):2888-2898.
4 Wright TI,Spencer JM.Chemoprevention of nonmelanoma skin cancer[J].J Am Acad Dermatol,2006,54(6):933-946.
5 Kuan YZ,Hsu HC,Kuo T T,et al.Multiple verrucous carcinomas treated with acitretin[J].J Am Acad Dermatol,2007,56(2):29-32.
6 Lebwohl M,Tannis C,Carrasco D.Acitretin suppression of squamous cell carcinoma case report and literature review[J].J Dermatol Treat,2003,14(2):3-6.
7 Brown JM,Attardi LD.The role of apoptosis in cancer development and treatment response[J].Nature Review Cancer,2005,5(3):231-237.

