基质金属蛋白酶-9和肿瘤坏死因子α在大鼠光气吸入性肺损伤中的表达及意义
张琳 申捷 黄文彬 何岱昆
(复旦大学附属金山医院化学伤害医疗救治中心,上海 200540)
光气是无色,具有烂干草味的窒息性气体,是重要的化工原料,广泛用于橡胶、塑料、染料、农药、医药等领域。在第一次世界大战期间,光气曾被用作军事毒剂。因此,联合国裁军委员会将光气定为“双用途毒剂”[1]。由于光气用途广泛,人们对其接触机会多,常因防护不当或意外泄露而致人员中毒,导致急性肺损伤(acute lung injury,ALI),甚至发展成急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),危及生命。但目前光气对人体的中毒机制尚不清楚[2],中毒后特效疗法,故研究光气中毒机制具有重要意义。
基质金属蛋白酶-9(MMP-9)又称明胶酶B[3],是基质金属蛋白酶家族中的一种,可由多种炎性细胞产生,包括中性粒细胞、肺泡巨噬细胞以及结缔组织细胞。本实验建立大鼠光气吸入性肺损伤的模型,采用分子生物学方法探讨MMP-9在光气吸入性肺损伤中的表达和意义及其与肿瘤坏死因子α(TNF-α)的关系 。
1 资料与方法
1.1 实验动物及分组 取SPF级SD大鼠50只,雌雄各半,体质量180~220 g,由第二军医大学实验动物中心提供。随机分为空气对照组(10只)和光气染毒后 2、4、6、8 h 组(每组各10只),分别记为O、A、B、C、D组。光气染毒组置于动态染毒柜中,导入浓度为 8.33 mg◦L-1的光气(光气纯度为100%,由固体三光气溶于环己烷在N,N-二甲基甲酰胺作用下产生,染毒方法根据文献[4]略做改动)染毒5min;对照组动物置于染毒柜内,除导入同样流量的空气之外,其余条件与染毒组完全相同。
1.2 病理组织学检测 实验动物经腹腔注射20%乌拉坦(1mL◦kg-1)麻醉,心脏穿刺放血处死。开胸取右中上肺,4%甲醛固定,石蜡包埋,4μm切片,HE染色,光镜下观察肺组织病理学变化。
1.3 肺损伤的评价 ①肺湿/干质量(W/D)比值取右下肺,轻轻擦干表面,立即称质量记为肺湿质量。然后置于80℃烤箱内,48 h后称质量记为肺干质量,计算湿/干质量比值。②支气管肺泡灌洗液(BALF)蛋白浓度 处死大鼠后立即行气管插管,结扎右侧主支气管,以37℃0.9%氯化钠液对左肺行支气管肺泡灌洗,连续灌洗3次。收集灌洗液5mL于4℃800×g离心10min,回收上清液置于-20℃冰箱待检测蛋白含量。Lowry法测定蛋白含量。③支气管肺泡灌洗液(BALF)细胞数目用血球计数板计细胞总数后,将灌洗液4℃3000 r◦min-1离心10min,上清液置于-20℃保存待生化测定,沉渣用于做细胞涂片,Wright-Giemsa染色,进行细胞分类(至少计数200个细胞),计算总细胞数目。
1.4 酶联免疫吸附试验(ELISA法)法测定BALF中TNF-α和MMP-9含量 操作步骤严格按照各试剂盒说明书进行,酶标溶解度波长以450 nm读取吸光值,按标准曲线计算对应的吸光值。TNF-α和MMP-9放射免疫盒均由由美国R&D systems公司生产。
1.5 实时荧光定量逆转录聚合酶链反应(RTPCR)检测MMP-9 mRNA水平 取左肺置于-70℃冰箱保存。用T rizol试剂(美国Invitrogen公司)从肺组织中提取总RNA。引物由上海赛百盛公司合成。MMP-9引物序列:上游引物 5′T TCAAGGACGGACGGTCGGTAT T3′,下游引物5′CTCTGAGCCTAGACCCAACTTA3′,产 物 为228 bp cDNA片断。β-Actin引物序列:上游引物5′CACGATGGAGGGGCCGGACTCATC3′,下游 引物 5′TAAAGACCTCTATGCCAACACAGT 3′
具体步骤:(1)DNA酶处理完全去除残留DNA。(2)反转录生成cDNA。(3)以cDNA为模板做PCR扩增。反应程序:95℃5min,95℃30 s,48℃30 s,72℃30 s(60循环)。然后进行Real time PCR反应。
为了建立PCR产物的熔解曲线,扩增反应结束后继续从72℃缓慢加热到99℃(每5 S升高1℃)实时定量PCR时各样品加样量均为2μL,然而由于受RNA浓度定量误差和RNA逆转录效率误差等的影响,每个样品取2μL体积的cDNA含量并不完全相同,为校正此差异,我们使用管家基因β-actin作为内参,以样品待测基因得值除以此样品内参得值,最终得到的比值为样品的待测基因相对含量。
1.6 统计学方法 用SPSS11.0进行统计学分析。实验数据均以均数±标准差的形式表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 观察 实验中观察到染毒组大鼠双足挠鼻,呼吸急促,心率加快,取肺可观察到双肺膨胀,体积增大,质量增加,色泽暗红,表面有明显出血点,气管插管时可见粉红色泡沫液体溢出,光镜下观察到肺组织结构显著改变,肺间质和肺泡腔内有大量的红细胞漏出和炎性细胞浸润,肺间质水肿增厚。对照组大鼠肺组织表面无出血点,光镜下肺组织结构完好,肺泡腔内无细胞渗出,肺间质清晰。病理观察见图1~2。
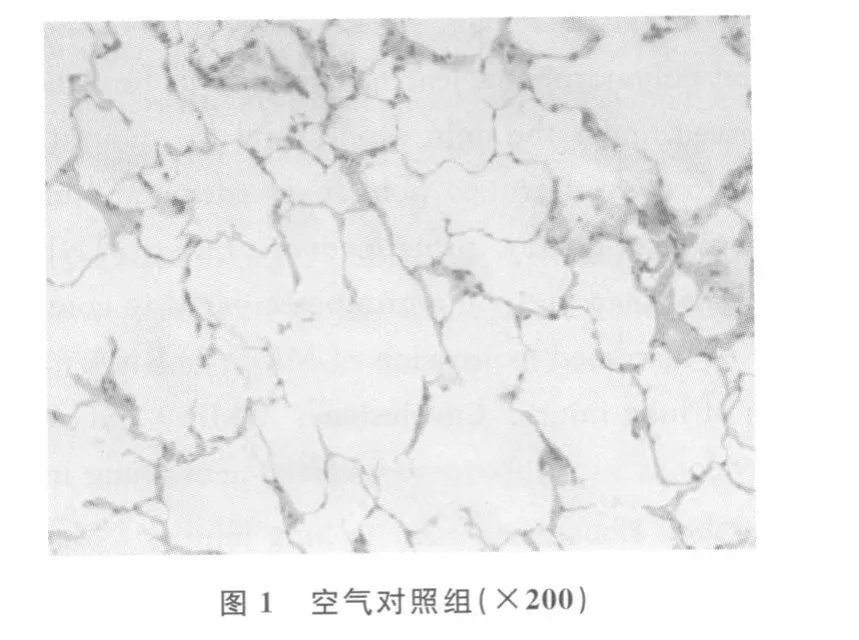

2.2 肺湿/干质量比和BALF中蛋白含量及中性粒细胞数目 动物染毒后肺湿/干质量比和支气管肺泡灌洗液中的蛋白含量逐渐增大,表明肺水肿逐渐加重,各组与对照组有明显差异(P<0.05),见表1。
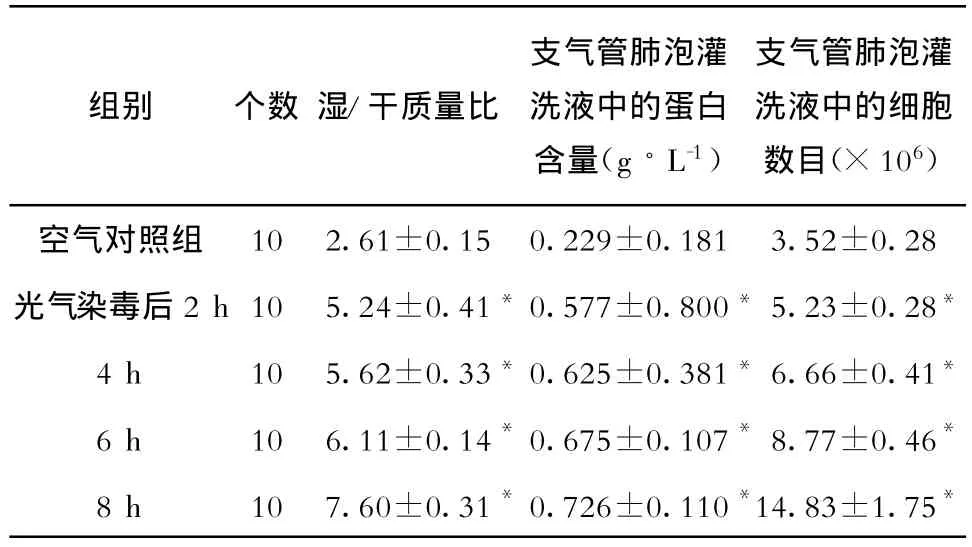
表1 光气染毒后肺湿/干质量比和支气管肺泡灌洗液中蛋白含量的变化
2.3 BALF中 TNF-α和MMP-9含量 见表2。

表2 BALF中 TNF-α和MMP-9含量
2.4 RT-PCR结果分析 结果显示,对照组大鼠肺组织中也有MMP-9 mRNA的微量表达,以对照组大鼠肺组织中MMP-9 mRNA的表达含量设为1,染毒组大鼠较对照组MMP-9 mRNA的表达含量显著增高(P<0.01),染毒组大鼠MMP-9 mRNA的表达含量随时间延长进一步增多,差异有统计学意义(P<0.01)。光气染毒后8h组MMP-9mRNA的表达量较其他各组显著增高(P<0.01)。见图3~4。

图3 MMP-9 mRNA相对表达量

图4 M MP-9 mRNA相对表达量比较
3 讨 论
本实验发现大鼠吸入光气2 h后即出现典型ALI表现,主要表现为光气致伤大鼠整个肺充血,表面可见斑片状或者点状的出血灶;光镜下显示肺间质水肿,弥漫性出血,肺泡内可见大量红细胞渗出和中性粒细胞、血浆蛋白浸润;肺湿/干质量、肺泡灌洗液中性粒细胞数、蛋白含量以及肺血管的通透性均较对照组明显增高(P<0.05)。实验表明,在光气所致的急性肺损伤中不仅血管内皮细胞存在一定程度的损伤,而且肺泡上皮也受损,致使大量的蛋白和中性粒细胞等血管内容物渗漏到肺泡腔内,致肺泡灌洗液中蛋白含量和中性粒细胞数显著升高,肺湿/干质量比增加,表明肺水增加,这些变化均符合ALI的生物标志(肺水增加、肺毛细血管通透性增加、肺泡灌洗液中的中性粒细胞数和蛋白浓度增加等改变)。实验结果证明,随光气染毒后时间的延长,肺组织损伤加重,这证实光气中毒可引起的迟发性肺水肿。
光气经人体吸入后经一定潜伏期(最长24 h)可导致肺水肿甚至急性呼吸窘迫综合征(ARDS),其主要病变是中毒性肺水肿,中毒机制假说颇多,包括诸如酰化作用、直接作用、盐酸作用、神经反射作用、肺血流动力学改变等,各有实验依据。但任何一种假说都不能完满地解释肺水肿发生与发展过程。
MMP是一组在结构上具有极大同源,能降解细胞外基(ECM)蛋白的内切酶的总称,MMP-9是其中一种,可以通过以下作用参与肺损伤过程:①MMP-9直接作用于肺泡毛细血管基膜,使其通透性增加。MMP-9还可以水解血管内皮细胞的钙黏附素(cadherin)和闭合蛋白(occludin)这两种细胞之间的连接结构直接导致微血管通透性增加[5]。②MMP-9通过调节细胞因子的水平,从而参与ALI的发生、发展。MMP-9可将相对分子质量为26 kDa的TNF-α前体裂解成具有活性形式的、成熟的相对分子质量为17 kDa的TNF-α[6]。③MMP-9通过增加弹性蛋白酶的活性而间接促使ECM及基膜的损伤。④降解肺泡毛细血管基底膜的主要成分Ⅳ型胶原,加重肺水肿。
MMPs是一组锌离子依赖性内肽酶,通过介导细胞外基质降解,参与正常发育、组织重建、修复、细胞迁移、血管生成、炎性反应、肿瘤侵袭和转移等过程。在正常情况下,MMPs表达量很少,但活化的中性粒细胞可释放大量的MMP-9。肺泡毛细血管基底膜的损害是以细胞外基质的变化为基础。MMP-9的过度激活和表达,导致大量细胞外基质(extracellularmatrix,ECM)成分降解,基底膜破坏,通透性增加,炎性细胞浸润,引起ARDS。Chetty等[7]也证实MMP-9参与了高氧诱导的新生小鼠急性肺损伤,并随损伤的加重MMP-9的表达明显增强。MMP-9还可能通过降解肺组织中的弹性纤维造成肺组织弹性支持作用减低,结构破坏;同时,MMP-9降解的细胞外基质片段对炎性细胞还有趋化作用,可放大肺组织局部的炎性反应,进一步加重了肺实质的毁损。Fligiel等[8]对28例ALI/ARDS患者支气管肺泡灌洗液进行分析,结果显示MMP-9,MMP-8,MMP-2均增高。张向峰等[9]建立小鼠高氧环境下急性肺损伤模型,RT-PCR方法证明MMP-9 mRNA在高氧引起的肺损伤中表达增多。Kim等[10]发现在博来霉素引起的肺损伤中发现肺组织和BALF中MMP-9和MMP-2均升高,MMP-9升高更明显,早期主要起肺损伤作用,晚期肺组织中MMP-9和MMP-2也升高,起肺组织损伤修复作用,导致肺纤维化。刘新等[11]研究发现,异丙酚可产生与抑制MMP-9活性相关的肺保护作用。本实验通过建立大鼠光气吸入性肺损伤动物模型,证明与空气对照组相比,光气损伤组BALF中MMP-9及TNF-α的含量明显增加,MMP-9在光气染毒组中表达较对照组明显增多(P<0.01),并随时间延长,MMP-9mRNA的表达显著增加,证明MMP-9与光气吸入性肺损伤程度存在相关性。
MMP-9在光气吸入性肺损伤中的确切机制目前尚未见报道,本实验证明MMP-9被激活后导致大量炎性细胞因子过度表达和中性粒细胞活化致伤是引起ALI发生发展的共同轴心环节。通过本实验,我们认为光气吸入性肺损伤的可能机制为:(1)光气吸入导致中性粒细胞、巨噬细胞等炎性细胞在肺部扣押,引发全身炎性反应综合征(SIRS)。(2)激活的炎性细胞和释放的炎性介质使MMP-9的表达含量上调,降解肺泡毛细血管基底膜,使其通透性增加,肺间质结构显著紊乱,肺水肿形成。(3)钠-钾ATP酶活力受到抑制,肺组织清除氧自由基的能力明显下降[12]。氧化物质大量生成能直接切断MMP-9的cys-Zn2+间的配心暴露而激活,从而发挥其损伤作用。
MMP-9可以通过多种途径参与光气吸入性肺损伤,并与众多细胞炎性因子如TNF-α之间存在正反馈,促进炎症进展。在发生ALI后,早期应用MMP-9抑制剂,如地塞米松,乌司他丁抑制MMP-9活性可能会减轻肺损伤的程度[13]。在光气引起的肺损伤中,目前尚需相关动物实验和临床研究证明。通过研究细胞因子与MMP-9之间的信号传导通路可进一步了解MMP-9在光气吸入性肺损伤中的作用,同时在临床研究中对光气中毒患者MMP-9进行评价,并观察MMP-9与其相关性,以期进一步探讨光气吸入性肺损伤的发病机制。
1 Sciuto AM,Strickland PT.Disruption of gas ex change in mice after exposure to the chemical threat agent phosgene[J].Military Medicine,2002,166(9):809-819.
2 何岱昆,申捷.光气吸入性肺损伤的研究进展[J].职业卫生应急与救援 ,2007,25(2):78-81.
3 Tan RJ,Fattman CL,Niehouse LM,et al.Matrix metalloproteinases promote inflammation and fibrosis in asbestos-induced lung injury in mice[J].Am J Respir Cell M ol Biol,2006,35(3):289-97.
4 陈宏莉,海春旭 ,梁欣,等.大鼠光气染毒后不同时间点肺水肿及炎症反应的差异性研究[J].癌变 畸变 突变,2006,2(6):93-95.
5 Alexander JS,Elrod JW.Extracellular matrix junctional integ rity and matrix metallopmteinase interactions in endothelial permeability regulation[J].J Anat,2002,200(6):561-574.
6 Mohan MJ,Seaton T,Mitchell J,et al.The tumo r necrosis factor-alpha converting enzyme(TACE):a unique with highly defined substrate selectivity[J].Bioehemistry,2002,41(30):9462-9469.
7 Chetty A,Cao GJ,Severgnini M et al.Role of matrix metalloprotease-9 in hyperoxic injury in developing lung[J].Am J Physiol Lung Cell Mol Phy siol,2008,295(4):584-592.
8 Fligiel SE,Standiford T,Fligiel HM,et al.Matrix metalloproteinases and matrix metalloproteinase inhibitors in acute lung injury[J].Hum Pathol,2006,37(4):422-430.
9 张向峰,高明哲,Hussein DF.基质金属蛋白酶2,9在高氧所致急性肺损伤实验中的表达[J].中华急诊医学杂志,2005,14(1):12-15.
10 Kim JY,Choeng HC,Ahn C,et al.Early and late changes of MMP-2 and M MP-9 in bleomycin induced pulmonary fibrosis[J].Yonsei Med,2009,50(1):68-77.
11 刘新,刘欣.异丙酚对内毒素诱导肺损伤MMP-2和 MMP-9的影响[J].中国临床医学,2006,13(4):658-659.
12 Qin XJ,Li YN,Liang X,et al.T he dy sfunction of ATPases due to impaired mitochondrial respiration in phosgene-induced pulmonary edema[J].Biochem Biophy s Res Commun,2008,367(1):150-155.
13 何岱昆,申捷,张琳,等.乌司他丁与地塞米松对大鼠光气吸人性肺损伤的保护作用比较[J].中国急救医学,2009,29(9):816-820.

