氟伐他汀对抗磷脂综合征患者血清诱导的人血管内皮细胞MMP-9的影响
赵小艳,郝 斌 ,杨 涛,曹文东,皮兴涛,续慧民
下肢深静脉血栓形成(deep vein thrombosis,DVT)是由手术、创伤、肿瘤等多种因素导致的血栓性疾病,其中20%不明原因深静脉血栓形成患者合并抗磷脂综合征(antiphospholipid syndrome,APS)[1]。APS是由于血清抗磷脂抗体(anti-phospholipidantibody,APL)滴度升高所导致的自身免疫性疾病,其特征为反复的动静脉血栓形成、习惯性流产、血小板减少等[2]。目前APL活化内皮致血栓形成的确切机制尚不明确,可能与NF-κ B/Rel系统有关[3]。NF-κ B是多亚单位转录因子,可以与核内某些基因的调控序列结合使其活化,引起细胞组织因子、黏附分子、基质金属蛋白酶、趋化因子等表达明显增加,内皮细胞向促凝及促炎症的表型转变。炎症标志物基质金属蛋白酶(matrix metaloproteinase-9,MMP-9)又称明胶酶 B,通过炎症反应促进血栓形成[4]。MM P-9浓度在APS患者血清中显著升高[5],那么 APS患者是否通过 APL诱导MMP-9表达增高促进血栓形成是本研究的一个目的。
氟伐他汀,一种羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,除降脂外还有改善内皮功能、抗炎、减少血栓形成等保护心血管作用[6]。氟伐地汀可独立于降脂作用降低高胆固醇血症患者血清MMP-9表达水平[7]。那么其是否可以通过降低APL诱导的M MP-9表达抑制血栓形成,这为临床DVT合并APS的治疗提供了新思路。
1 资料与方法
1.1 细胞 人脐静脉内皮细胞株HUVEC-12购自上海门谍塔生物科技发展有限公司。
1.2 主要试剂 TRIZOL试剂为美国Invitrogen公司产品,RPMI1640培养基为美国Gibco公司产品,TransScript First-Strand cDNA Synthesis SuperMix、transtaq酶为日本 TaKaRa公司产品,PCR引物由Primer Premier5.0软件设计,北京奥科生物技术有限责任公司合成,Western blot试剂盒为美国KPL公司产品,MM P-9ELISA试剂盒、兔抗人NF-κ Bp65多克隆抗体为武汉博士德生物有限公司产品,氟伐他汀为北京诺华公司产品,胎牛血清为杭州四季青生物工程有限公司产品。
1.3 方法
1.3.1 细胞培养 HUVEC细胞在含10%胎牛血清的RPMI-1640培养液、37℃、5%CO2饱和湿度条件下传代培养。
1.3.2 病例收集及血清制备 收集2009年1月—2009年7月山西医科大学第二医院血管乳腺外科下肢DV T合并APS住院患者(均ACL>40 U和/或抗β2GPI>70 U 10例),同期体检健康者10例。清晨空腹采血20 mL,留取血清保存于-70℃。
1.3.3 细胞分组 A组:空白对照组,未加任何干预因素培养基。B组:正常血清对照组,50%培养基+50%健康对照血清。C组:APS患者血清组,50%培养基+50%APS患者血清。D1组:50%APS患者血清+2.5 mol/L氟伐他汀组。D2组:50%APS患者血清+5 mol/L氟伐他汀组。D3组:50%APS患者血清+10 mol/L氟伐他汀组。E1组:50%APS患者血清+2.5 mol/L氟伐他汀+0.2 mmol/L甲羟戊酸组。E2组:50%APS患者血清+5 mol/L氟伐他汀+0.2 mmol/L甲羟戊酸组。E3组:50%APS患者血清+10 mol/L氟伐他汀+0.2 mmol/L甲羟戊酸组。
1.3.4 培养液中MMP-9浓度的检测 双抗体夹心酶联免疫吸附试验(ELISA)测定MMP-9浓度。
1.3.5 RT-PCR检测MMP-9mRNA表达 Trizol试剂法提取各组细胞总RNA,采用RevertAid FirstStrand cDNA Synthesis kitK1622反转录为cDNA。
1.3.6 Western-blot检测NF-κ B p65蛋白表达 通过凝胶分析系统进行分析,将NF-κ B p65及β-actin的蛋白条带灰度的比值作为 NF-κ B p65的相对表达量。
2 结 果
2.1 ELISA检测细胞培养液中MMP-9浓度 A组和B组MMP-9浓度无统计学意义(P>0.05)。C组 MMP-9明显升高(P<0.05),D1、D2、D3组MMP-9浓度较C组下降(P<0.05)。E组与C组相比无统计学意义。详见图1。

图1 各组细胞培养液M MP-9浓度比较
2.2 RT-PCR检测各组细胞M MP-9mRNA表达 各组细胞均可以检测到MMP-9mRNA表达,于187bp处可见一条亮带,半定量结果显示:C组细胞MMP-9mRNA相对表达量高于A、B组(P<0.05),D1 、D2、D3组细胞 MMP-9mRNA 相对表达量呈浓度依赖性下降(P<0.05),E组细胞 MMP-9 mRNA相对表达量与C组无统计学意义(P>0.05)。详见表1。
表1 各组MMP-9mRNA表达水平比较(±s)

表1 各组MMP-9mRNA表达水平比较(±s)
组别 n MM P-9mRNA相对表达量A组 3 0.172±0.013 B组 3 0.166±0.012 C组 3 0.628±0.0241)D1组 3 0.469±0.0161)2)D2组 3 0.348±0.0161)2)D3组 3 0.278±0.0261)2)3)E1组 3 0.621±0.0332)E2组 3 0.614±0.0312)E3组 3 0.614±0.0342)与A组比较,1)P<0.05;与C组比较,2)P<0.05;与D1、D2组比较,3)P<0.05
2.3 Western-blot法检测各组细胞NF-κ Bp65含量 A组、B组细胞NF-κ B p 6 5含量无统计学意义。C组细胞NF-κ Bp65表达明显升高,D1、D2、D3组细胞 NF-κ Bp65表达较C组下降,并具有浓度依赖性(P<0.05),E组细胞与C组相比无统计学意义(P>0.05)。详见表2。
表2 各组NF-κ Bp65总蛋白表达水平比较(±s)
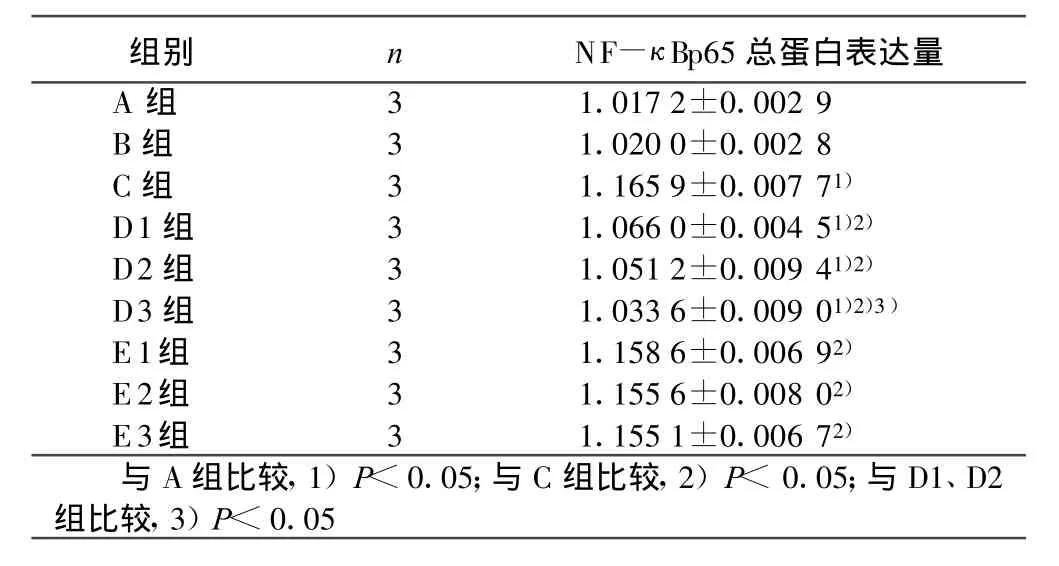
表2 各组NF-κ Bp65总蛋白表达水平比较(±s)
组别 n NF-κ Bp65总蛋白表达量A组 3 1.017 2±0.002 9 B组 3 1.020 0±0.002 8 C组 3 1.165 9±0.007 71)D1组 3 1.066 0±0.004 51)2)D2组 3 1.051 2±0.009 41)2)D3组 3 1.033 6±0.009 01)2)3)E1组 3 1.158 6±0.006 92)E2组 3 1.155 6±0.008 02)E3组 3 1.155 1±0.006 72)与A组比较,1)P<0.05;与C组比较,2)P<0.05;与D1、D2组比较,3)P<0.05
3 讨 论
DVT合并APS的特征为难治而反复发生的血栓形成。APL在APS的病理过程中担任着重要角色。APL通过与β2-糖蛋白-磷脂复合物结合活化内皮细胞诱导炎症分子、细胞因子等表达,从而导致血管内血栓形成,这些作用可能与NF-κ B/Rel系统激活有关。NF-κ B是多亚单位转录因子,与核内某些基因的调控序列结合使其活化,引起细胞组织因子、黏附分子、基质金属蛋白酶等表达明显增加,内皮细胞向促凝及促炎症的表型转变。
MMPs是一个具有锌结构域的内皮蛋白酶家族,不仅在正常组织的细胞外基质重塑中起关键作用,而且在动脉粥样硬化,斑块破裂,血栓形成等病理过程中也起一定作用。MMP-9为明胶酶B,其表达是一个在基因转录和蛋白分泌水平复杂的体系,受细胞因子、炎症、金属蛋白酶类组织抑制剂的调节[5],尤其与炎症反应密切相关[4]。MM P-9浓度在自身免疫系统疾病[6]及动脉粥样硬化、冠脉综合征、外周血管疾病[7]患者血清中显著升高。本研究从mRNA及蛋白水平分别检测了人血管内皮细胞上 MMP-9及NF-κ Bp65的表达,证实APS患者血清能明显促进人血管内皮细胞MMP-9及NF-κ Bp65的表达,表明APS患者血栓形成可能是由APL通过NF-κ B途径上调MM P-9表达所致。另有研究表明APL活化内皮与内皮表面toll-like样受体介导细胞信号转导有关[8]。
氟伐他汀通过竞争抑制HMG-CoA还原酶,导致细胞内的异戊二烯类含量减少,抑制 Iκ B激酶复合体磷酸化致Iκ B的降解减少,降低NF-κ B的活性,从而起心血管保护作用[9]。动物实验表明,氟伐他汀可减少巨噬细胞MMP-9表达水平[10]。本研究从细胞水平也证实氟伐他汀剂量依赖性抑制APL诱导的内皮细胞MM P-9及 NF-κ Bp65的表达,甲羟戊酸可抑制其作用。说明其可能通过抑制NF-κ B途径降低APL诱导的MM P-9表达抑制血栓形成。
临床上针对DVT合并APS的治疗主要包括抗凝、溶栓等,但是由于出血倾向、费用昂贵等限制了其长期使用,使得此类患者血栓反复发作,寻找新的预防用药,迫在眉睫。本研究提示氟伐他汀可能通过抑制血管内皮细胞MM P-9的表达干预APS诱导的血栓形成,为今后DVT合并APS的治疗及预防提供了新的思路。
[1]Farmer-Boatwright MK,Roubey RA.Venous thrombosis in the antiphospholipid syndrome[J].Arterioscler T hromb Vasc Biol,2009,29(3):321-325.
[2]Lim W,Crowther M A,Eikelboom JW.Management of antiphospholipid antibody syndrome:A systematic review[J].JAMA,2006,295:1050-1057.
[3]Pieranqeli SS,Harris EN.Probing antiphospholipid-mediated thrombosis:The interplay between anticardiolipin antibodies and endothelial cells[J].Lupus,2003,12(7):539-545.
[4]付锦,张雪梅.基质金属蛋白酶-9与脑梗死的关系[J].中国神经免疫学和神经病学杂志,2007,14(3):170-172.
[5]Faber-elmann A,Sthoeger Z,T chernlack A,et al.Activity of matrix metalloproteinase-9 is elevated in sera of patients with sy stemic lupus erythematosus[J].Clin Exp Immunol,2002,127:393-398.
[6]Ram M,Sherer Y,Shoenfeld Y.Metrix metalloproteinase-9 and autoimmune disease[J].Clin,Immunol,2006,26(4):299-307.
[7]Castillo J,Alvarez-Sabin J,Martinez-Vila E,et al.Inflammation markers and prediction of post-stroke vascular disease recurrence:The M ITICO study[J].Neurol,2009,256(2):217-224.
[8]Meroni P L,Raschi E,Testoni C,et al.Innate immunity in the antiphospholipid sy ndrome role of toll-like receptors in endothelial cell activation by antiphospholipid antibodyies[J].Autoimmun Rev,2004,9,510-515.
[9]渠莉,王津文.氟伐他汀类药物的非调脂机制研究进展[J].中国医药,2006,1(6):379-381.
[10]Bellosta S,Via D,Canavesi M,etal.HMG-CoA reductase inhibitors reduce MMP-9 Secretion by macrophages[J].Arterioscler T hromb Vasc Biol,1998,18:1671-1678.

