山东半岛地区贝类中诺如病毒污染状况与病毒鉴定初报*
苏来金,马丽萍,徐仰丽,徐 静,周德庆
诺如病毒(Noroviruses,NVs)是引发病毒性急性肠胃炎的主要病原体之一,该病毒在离体条件下存活力很强,主要通过被污染的食物、水等多种途径进行传播〔1〕。近年来,由于水环境污染的加剧,许多水产品遭到了NVs的污染,特别是滤食性双壳贝类体内富集的NVs是周围水环境中的几十甚至上千倍〔2〕,致使世界许多地区均爆发了因生食含有NVs的双壳贝类而引发的大规模肠胃炎疫情〔3-4〕,给人类健康造成了巨大威胁。因此,水产品中NVs的污染状况调查是进行食品安全预警、防控食源性NVs疫情暴发的重要途径。目前国内外对腹泻病人粪便中诺如病毒分离株研究的报道较多〔5-7〕,证明在每一种NVs基因型中存在广泛的多样性,而对于双壳贝类中NVs含量、种类、基因型别等研究较少〔8〕,国内贝类中NVs污染状况和基因型别的调查研究尚未见报道。鉴于此,本研究对2007年9月至2008年8月在山东半岛沿海8个地区采集的186份贝类样品进行了RT-PCR检测,并对NVs阳性分离株进行了鉴定分析,旨在了解山东半岛地区贝类中NVs污染情况和毒株类型,补充我国水产品中NVs污染调查数据,为食源性NVs防治和分子流行病学调查积累资料。
1 材料与方法
1.1 材料
1.1.1 样品 2007年9月至2008年8月采集山东半岛的莱州、招远、烟台、威海石岛、乳山、青岛等8个地区的长牡蛎(Ostrea crassostrea)、毛蚶(Scapharca subcrenata)、栉孔扇贝(Chlamys f arreri)、虾夷扇贝(Patinopecten yessoensis)、菲律宾蛤仔(Ruditapes philippinarum)、缢蛏(Sinonovacula constricta)等贝类共186份样品,取内脏置-80℃保存,作为待检样品备用。
1.1.2 主要试剂与仪器 配制溶液:苏氨酸(Thr)缓冲液(0.1mol/L Thr,0.3mol/LNaCl,pH7.5);聚乙二醇(PEG)6000(24%PEG6000,0.6mol/L NaCl);PEG8000(16%PEG8000,0.525mol/L NaCl);PBS缓冲液(137mmol/L NaCl,2.7mmol/L KCl,10mmol/L Na2HPO4,2mmol/L KH2PO4,pH7.4);所有试剂配制用水均为焦碳酸二乙酯(DEPC)处理过无 RNase的二次水。购置试剂:IPTG、X-gal、PGEM-T 载体、AMV 逆转录酶、dNTPs、Taq DNA聚合酶、RNase抑制剂等为均为Promega公司产品;One Step PrimeScriptTMRTPCR Kit(TaKaRa);高纯 RNA提取试剂盒(Roche);胶回收试剂盒(Omega);小量质粒提取试剂盒(TIANGEN)。主要仪器:3K15型高速冷冻离心机(Sigma,美国),SW-CJ-1F型超净工作台(苏州净化设备厂),BioPhotomete生物分光光度计(Eppendorf,德国)公司产品,PTC-200 PCR扩增仪(MJ,美国),LightCycler2.0荧光定量 PCR仪(Roche,瑞士),凝胶成像系统(Vilber Lourmat,法国)。
1.1.3 引物 根据文献报道〔9-10〕本研究用于检测NVs的引物及探针,见表1。

表1 用于NVs检测的引物与探针Table 1 The primers and probes for detecting NVs
1.2 实验方法
1.2.1 贝类样品中病毒粒子的富集与RNA提取主要步骤:取25g贝类样品,加入175mL苏氨酸缓冲液匀浆3min,37℃孵育30min;4℃5 000×g离心20min,取上清;向沉淀中再次加入175mL苏氨酸缓冲液重悬沉淀,4℃5 000×g离心20min;合并两次上清液加入等体积 PEG6000溶液,冰上沉淀4h;4℃6700×g离心30min,弃上清;15mL PBS缓冲液重悬沉淀,加入等体积的氯仿,涡旋1min;4℃2000×g离心30min,取上清;上清液加入等体积PEG8000,冰上沉淀 2h;4℃14000×g离心 15min,弃上清;沉淀用200μL PBS缓冲液溶解,按照高纯RNA提取试剂盒(Roche)说明书提取病毒RNA。
1.2.2 常规 RT-PCR检测 RT反应体系为20μL,其 中包含 2μL 5 ×AMV Buffer,4μL 10 mmol/L dNTP Mix,1μL 的 20μ mol/L 通用引物,40U RNA酶抑制剂,5 U AMV反转录酶以及3μLRNA模板。反应条件为42℃,90min,反应结束后直接进行PCR反应。检测GGI型NVs的PCR反应体系为 50μL,其中包含 5μL 10 ×Buffer,4μL的 2.5 mmol/L dNTP Mix,10 μ mol/L 引物 COGI-F、COG-I-R各1μL,2.5 U TaqDNA 聚合酶以及2μL cDNA。反应条件:94℃预变性3min;94℃变性30s,52℃退火 30s,72℃延伸30s,共 40个循环;72℃终延伸7min。检测GGII型NVs的PCR反应体系为 50μL,其中包含 5μL 10 ×Buffer,4μL 2.5 mmol/L dNTP Mix,10 μ mol/L JV13I、JV12Y 各1μL,2.5 U TaqDNA 聚合酶以及 2μL cDNA。反应条件:94℃预变性3min;94℃变性60s,37℃退火90s,74℃延伸60s,共40个循环;74℃终延伸7min。扩增产物于1.5%琼脂糖凝胶在1%TAE缓冲液中,100V电泳30min,EB染色,在凝胶成像系统下观察拍照。
1.2.3 荧光定量RT-PCR检测 荧光定量RTPCR反应体积为20μL,按照试剂盒说明书的体系配置反应液,上下游引物0.2μ mol/L,模板 RNA 1μL,混匀后加入 Roche专用石英毛细管中,在Roche定量 PCR仪中进行扩增。反应条件:42℃5min反转录;95℃5s,56℃30s共45个循环;40℃,10s冷却结束反应。通过常规RT-PCR目的产物纯化后体外转录的cRNA,经生物分光光度计测定浓度、计算拷贝数后梯度稀释,作为荧光定量的标准品对病毒RNA进行相对定量。
1.2.4 克隆测序 阳性PCR产物用胶回收试剂盒纯化后,插入载体pGEM18-T中,转化至大肠杆菌DH5α感受态细胞,挑取重组子,摇菌后提取质粒,由上海博尚生物技术有限公司进行测序。
1.2.5 序列分析比较 测序获得的序列应用BLAST软件在GenBank寻找相近序列,利用DNAStar软件进行序列的多重比对和分析;应用MEGA4.0软件构建系统发生树。用于系统发生分析的NVs参考株来自于GenBank数据库,GGI-1~GGI-6参考株登陆号:M87661、L07418、U04469、AB042808、AF414406、AB081723;GGII-1 ~ GGII-3参考株为 U07611、AY134748、U22498;其中GGII-4 型参考株为:X866557、AF145896、AY587985、AY502023、Ab240190;GII-5~GII-8参考株:AF414423、AF397156、AF414409、AB039780;我国报道的参考株:EU794706、EU718209、DQ369797、EU703648。
2 结果与分析
2.1 NVs检测结果 采集的186份样品常规RTPCR检测,用GI型引物检测无目的片段检出,用GII型引物检测有5份扩增出目的片段,部分 RTPCR检测结果见图1,荧光定量 RT-PCR对GGII检测阳性样品RNA进行扩增,检测情况及定量结果见表2。

图1 部分贝类样品NVs的检测结果Fig.1 The NVs test result of some shellfish samples

表2 贝类样品中NVs检测情况Table 2 The result of NVs detection in shellfish samples
2.2 阳性株序列分析与遗传进化树 检测出的5株NVs阳性毒株分别命名:Norovirus oyster/GII/QingDao,Norovirus clam/GII/WeiHai,Norovirus scallop/GII/RiZhao,Norovirus razorclam/GII/LaiZhou,Norovirus ark clam/GII/YanTai序列已上传至GenBank中,登录号见表2。PCR产物经克隆与测序,阳性株序列与参考毒株比较绘制遗传进化树(图2)。
2.3 阳性毒株型别 阳性片段序列在GenBank中搜索比对,与近年来我国不同地区报道阳性株的同源 性 达 96%以 上(EU794706、EU718209、DQ369797、EU703648),与日本,英国 ,美国等地报道的GGII-4亚型遗传距离较近(AB240190、X86557、AY502023),同源性90%以上,可以初步确定为从贝类中分离到的此5株NVs均属于GII基因组型的GGII-4亚型。
3 讨 论
根据NVs基因组的RdRp和衣壳蛋白核苷酸序列差异,可将NVs分为5个遗传组(Genogroup),其中遗传组I(Genogroup I,GGI)和遗传组II(Genogroup II,GGII)以及暂定的遗传组IV(Genogroup IV,GGIV)感染人类,遗传组III(Genogroup III,GGIII)和遗传组V(GenogroupV,GGV)分别感染牛和鼠,遗传组GI和GII当前又分别区分为14和17个基因亚型〔11-13〕,重组NVs的出现使基因分型变得更为复杂,目前已经发现23株NV的RdRp和衣壳蛋白基因分属于不同基因型〔14〕。这些基因型出现给NVs的检测带来了巨大困难。尽管NVs分类复杂,但在引起胃肠炎暴发的NVs中,GII-4型 NVs一直处于优势地位〔15〕。自1992年以来,我国不同地区报道的NVs引发的婴幼儿腹泻研究中GGII-4型也是主要病原〔16〕。
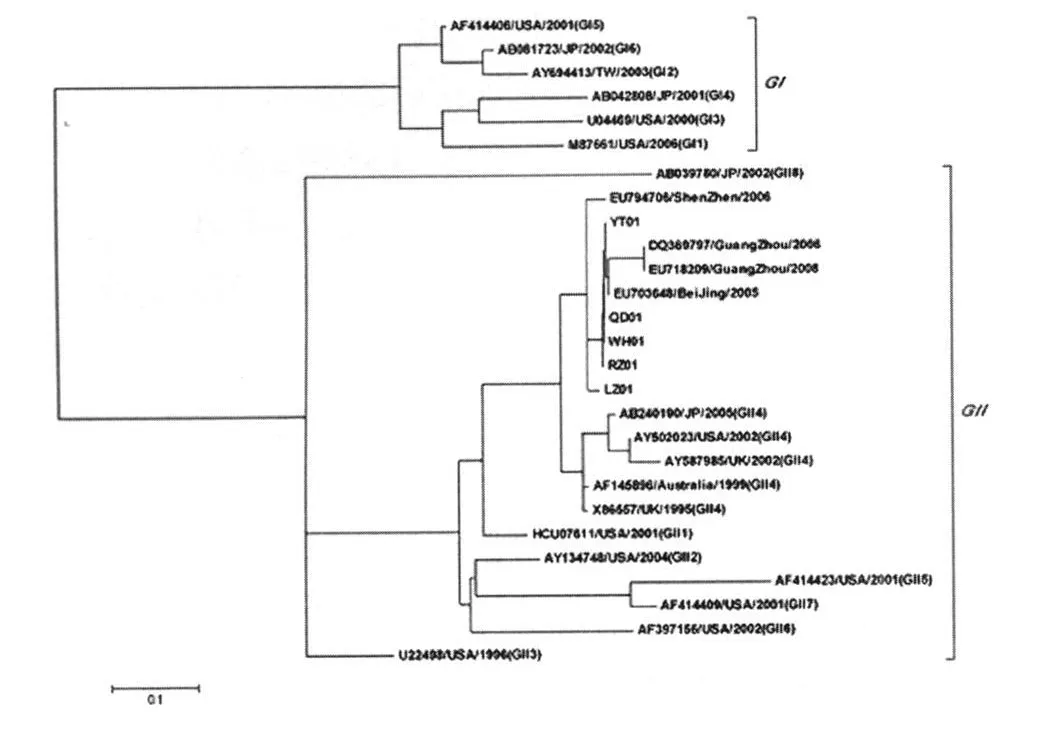
图2 NVs聚合酶区部分核苷酸序列遗传进化树Fig.2 Phylogenetic tree construct based on partial sequences of of NVs RNA polymerase region
NVs的流行地区广泛,全年发病,但冬季较多见,Mounts〔17〕、Burkhardt 等 人〔18〕的研 究表明 ,NVs的感染主要集中在冬季。近年来,许多国家暴发的由于生食牡蛎等双壳贝类而引发的NVs疫情也主要集中在秋冬季节〔19-21〕,本研究中检出的5份阳性毒株,主要是冬季的贝类样品。分析原因NVs可能同其他呼吸道病毒一样,在冬季依靠干燥的空气传播,粪-口传播是主要途径,而病人腹泻呕吐物造成了食物和水的污染,牡蛎等贝类通过受污染的水域在体内富集了大量NVs,加上冬春季节也是牡蛎等贝类收获季节,消费者生食牡蛎数量增加,因此冬季贝类中NVs检出最高,因食牡蛎引发大规模NVs传播的案例最多。
本研究从分子水平上初步揭示了山东半岛地区贝类中NVs的污染状况和基因型别,冬季为高发季节,由于样品数量、采集地区的限制,尚不能全面的反映我国水产品中NVs的污染状况,开展全国范围水产品NVs污染状况调查,对于了解水产品污染状况,保障水产品国际贸易、疾病传染预警等有着十分重要的现实意义。
〔1〕Koopmans M,Duizer E.Foodborne viruses:an emerging problem 〔J〕.Int J Food Microbiol,2004,90:23-41.
〔2〕Shieh Y,Monroe SS,Fankhauser RL,et al.Detection of Norwalk-like virus in shellfish implicated in illness〔J〕.J Infect Dis,2000,181(suppl 2):360-366.
〔3〕Boxman ILA,Tilburg JJHC,te Loeke NAJM,et al.Detection of noroviruses in shellfish in the Netherlands〔J〕.Int Food Microbiol,2006,108:391-396.
〔4〕de Bruin E,Duizer E,Vennema H,et al.Diagnosis of norovirus outbreaks by commercial ELISA or RT-PCR〔J〕.J Virol Methods,2006,137:259-264.
〔5〕Fankhauser RL,Monroe SS,Noel JS,et al.Epidemiologic and molecular trends of"Norwalk-like viruses"associated with outbreaks of gastroenteritis in the United States〔J〕.J Infect Dis,2002,186:1-7.
〔6〕Kageyama T,Shinohara M,Uchida K,et al.Coexistence of multiple genotypes,including newly identified genotypes,in outbreaks of gastroenteritis due to norovirus in Japan〔J〕.J Clin Microbio1,2004,42(7):2988-2995.
〔7〕陈军林,王 滔,高建民,等.福州地区腹泻患者诺瓦克样病毒感染的分子流行病学特点〔J〕.中国人兽共患病杂志,2003,19(2):83-85.
〔8〕Nishida T,Kimura H,Saitoh M,et al.Detection,quantitation,and phy logenetic analysis of noroviruses in japanese oy sters〔J〕.Appl Environ Microbiol,2003,69(10):5782-5786.
〔9〕Vennema H,de Bruin E,Koopmans M.Rational optimization of generic primers used for Norwalk-like virus detection by reverse transcriptase polymerase chain reaction〔J〕.J Clin Virol,2002,25(2):233-235.
〔10〕Kageyama T,Kojima S,Shinohara M,et al.Broadly reactive and hig hly sensitive assay for No rwalk-like viruses based on real-time quantitative reverse transcription-PCR〔J〕.J Clin Microbiol.2003,41:1548-1557.
〔11〕Koopmans MG,Bonsdorrf CH,Vinje J,et al.Foodborne enteric viruses〔J〕.FEMS Microbiol Rev,2002,26:187-205.
〔12〕Ando T,Noel JS,Fankhauser RL.Genetic classification of"Norwalk-like Viruses."〔J〕.JInfectDis,2000,181:S336-S348.
〔13〕Karst SM,Wobus CE,Lay M,et al.ST AT1-dependent innate immunity to a N orwalk-like virus〔J〕.Science,2003,299(5612):1575-1578.
〔14〕Bull RA,Hansman GS,Clancy LE,et al.Norovirus recombination in ORF1/ORF2 overlap 〔J〕.Emerg Infect Dis,2005,11(7):1079-1085.
〔15〕Zheng DP,Ando T,Fankhauser RL,et al.Norovirus classificatlon and proposed strain nomenclature〔J〕.Virology,2006,346(2):312-323.
〔16〕谢华萍,方肇寅,王光,等.长春市儿童医院1998-2001年婴幼儿杯状病毒腹泻流行病学研究〔J〕.病毒学报,2002,18(4):332-336.
〔17〕Mounts AW,Ando M,Koopmans JS,et al.Cold weather seasonality of gastroenteritis associated with Norwalklike viruses〔J〕.J Infect Dis,2000,181(Suppl 2):S284-287.
〔18〕Burkhardt W,Calci KR.Selective Accumulation May Account for Shellfish-A ssociated Viral Illness〔J〕.Appl Environ Microbiol,2000,66(4):1375-1378.
〔19〕Inouye S,Yamashita K,Yamadera S.Surveillance of viral gastroenteritis in Japan:pediatric cases and outbreak incidents〔J〕.J Infect Dis,2000,181:270-274.
〔20〕Le Guyader FS,Bon F,DeM edici D,et al.Detection of multiple noroviruses associated with an international gastroenteritis outbreak linked to oyster consumption 〔J〕.J Clin Microbiol,2006,44:3878-3882.
〔21〕Okada M,Ogawa T,Yoshizumi H.Genetic variation of the norovirus GII-4 genotype associated with a large number of outbreaks in Chiba prefecture Japan〔J〕.Arch Virol,2007,152(12):2249-2252.

