SXI2a基因在新生和格特隐球菌交配型鉴定中的作用
吴劲松,冯晓博,卢月梅,吴伟元,李文青
新生和格特隐球菌是导致人类和动物发生致命感染的病原真菌。其中,新生隐球菌主要感染免疫抑制患者,而格特隐球菌可感染免疫正常人群。新生和格特隐球菌是一种担子菌酵母,在临床中多以酵母相存在。该菌具有异宗配合的有性生活周期,其交配体系存在 α和 a两种相对的交配型,即MATα和MATa。交配型α和 a发生交配后,将产生重组的担子孢子。研究发现,担子孢子比酵母细胞具有更强的感染能力〔1〕。与酵母形态的隐球菌相比,担子孢子被认为更可能是经呼吸道导致感染发生的起始致病因子〔2〕。因此,α和a交配型的准确鉴定及后续研究将有利于阐明新生和格特隐球菌的遗传学、生物学和致病性特征。
基因分型结果表明,根据一定的遗传差异,新生和格特隐球菌各分为VNI-VNIV和VGI-VGIV 8种主要基因型;不同的主要基因型具有不同的地理分布和致病特性〔3〕。目前,交配型的鉴定主要包括PCR特异扩增分型和交配试验〔4〕。由于在大部分研究中分离的a交配型菌株较少,使得设计一种可通用于快速鉴定所有主要基因型a交配型的PCR方法及评价现有的鉴定a交配型的方法在各主要基因型中的通用性均显得非常重要。本文通过设计针对a交配型位点内特有的SXI2a基因的特异扩增法,并和现有的针对STE20a、MFa或 ST E3a基因的特异扩增法及交配试验进行比较,评价其在鉴定新生和格特隐球菌各主要基因型 a交配型中的作用。
1 材料与方法
1.1 菌株新生隐球菌MATa菌株,VNI基因型(3株)、VNIII基因型(6株,包括a/α和α/a各 3株)、VNIV基因型(4株);格特隐球菌MATa菌株,VGI基因型(5株)、VGII基因型(2株)、VGIII基因型(4株)、VGIV/IGS5b基因型(1株);新生和格特隐球菌MATα参考株,VNI-VGIV基因型各1株。所有受试新生和格特隐球菌菌株由上海交通大学医学院附属新华医院皮肤科真菌实验室保存。菌株资料见表1(注:VNII基因型至今未报道MATa菌株)。
1.2 试剂 培养基原料购自Sigma、Campbell和国药集团化学试剂有限公司。Taq酶、PCR相关试剂购自宝生物工程(大连)有限公司。引物由上海生工生物工程有限公司合成。
1.3 基因组提取 受试菌株于YPD斜面培养基37℃培养2d后,取一环菌接于无菌蒸馏水,离心取沉淀,后续步骤参照Meyer等的DNA提取方法〔3〕。
1.4 引物设计 检索GenBank中所有SXI2a基因的等位序列结果如下,125.91(VNI,MATa,AF542528)、JEC20(VNIV,MATa,AF542530)、E566(VGI,MATa,AY710429)、SXI2a_1(VGI,AY973652)、SXI2a_2(VGI,AY973653),SXI2a_3(VGI,AY973654),SXI2a_4(VGIII,DQ096310),SXI2a_5(VGII,DQ198316),采用 ClustalW2软件进行序列比对,在SXI2a基因最长的4号外显子的保守序列上设计通用引物(图1),经筛选后选择引物SXI2aF(5'-ACGAGTGCCTCCACCATATCA-3')-SXI2aR(5'-ACGGGTACAGT TT TGA GCTGG-3')进行后续实验。

图1 SXI2a基因结构模式图和SXI2aF-SXI2aR引物扩增区域Fig.1 Schematic representation of SXI2a gene and the amplified region by primer pair SXI2aF-SXI2aR
1.5 各主要基因型的交配型鉴定 分别采用基于MATa 位点内 SXI2a、STE20a、STE3a、MFa 基因的引 物 SXI2aF-SXI2aR、STE20aF(5'-ATCCGCCCTCGA GTCAAA-3')-STE20aR(5'-TGGCGACCGACTGTAGAT-3')、STE3aF(5'-A CCT TTGCGGTT TCATCAAC-3')-STE3aR(5'-AAGGTCGCATGGGTAATGAG-3')、MFaF(5'-CGCCTTCACTGCTACCTTCT-3')-MFaR(5'-AACGCA AGAGTA AGTCGGGC-3')对受试菌株的DNA模板进行PCR扩增,引物SXI2aF-SXI2aR的PCR反应条件为95℃5min;95℃30s,57℃30s,72℃50s,32个循环;72℃6min。余引物扩增条件见文献〔4-6〕。根据是否扩增出目的条带来鉴定交配型。
1.6 交配试验 将受试株和交配型标准株分别接种于YPD斜面培养基,30℃培养48h后,取等量分别与交配型标准株NIH312(MATα)、B4546(MATa)、JEC21(MATα)、JEC20(MATa)混合后,接种于V8蔬菜汁培养基(5%V8蔬菜汁,0.5g/L KH2PO4,4%琼脂)。培养全程在黑暗中进行,保持相对干燥,25℃培养2周。肉眼观察菌丝的产生,显微镜下观察菌丝、担子和担子孢子的形成。
2 结 果
2.1 基于SXI2a基因的引物SXI2aF-SXI2aR扩增各主要基因型a交配型的新生和格特隐球菌受试株均获得750bp左右的目的片段(图2);基于STE20a基因的引物ST E20aF-STE20aR除无法扩增VGIV/IGS5b基因型的a交配型外,其余主要基因型菌株的 a交配型均扩增得到目的片段;基于STE3a基因的引物STE3aF-STE3aR无法扩增VGI、VGII、VGIV基因型的a交配型,其余主要基因型菌株的a交配型扩增得到目的片段;基于MFa基因的引物MFaF-MFaR无法扩增VNI、VNIIIa/α、VGI、VGII、VGIII、VGIV 基因型的 a 交配型,其余主要基因型菌株的a交配型扩增得到目的片段。受 试 的 SXI2aF-SXI2aR、STE20aF-STE20aR、STE3aF-STE3aR、MFaF-MFaR 4对引物均无法扩增所有主要基因型α交配型参考株(见表1)。
2.2 在交配试验中,均不能与α或a交配型标准株发生交配的a交配型菌株包括VGI(5株),其余a交配型受试株(VNIII除外)均能与α交配型标准株发生交配,而不能与a交配型标准株发生交配(结果见表1)。

表1 本文受试隐球菌菌株、交配型特异扩增和交配试验结果Table 1 The cryptococcal strains tested,and the results of specific amplification and mating assay
3 讨 论
新生和格特隐球菌在自然界中存在无性克隆和有性交配两种主要的繁殖方式。其生活周期中包括有异宗配合、雌雄异株的有性阶段,其交配型位点包括两种不同的等位基因,即α和a,有着相对交配型的酵母细胞在适当环境下发生交配,产生重组的担子孢子。担子孢子被认为很可能是经呼吸道导致感染发生的致病因子。新生和格特隐球菌有性交配后产生的担子孢子具有直径小、易播散和抗干燥能力强等特点,易进入并沉积于肺泡。动物实验表明,小鼠吸入少量的担子孢子即可导致隐球菌病,而吸入更大量的亲本酵母细胞,却不能导致感染〔1-2〕。
尽管目前临床和环境中分离的隐球菌菌株多为α交配型,但有研究表明少数地区的环境分离株中存在一定比例的a交配型菌株,并通过遗传学分析证实环境株中存在重组现象〔4,7〕,提示这种致病酵母在一定的生态环境中完成交配产生子代。实验研究表明,酵母经有性繁殖后产生的子代比无性克隆的子代具有更强的环境适应能力,对1999年至今在加拿大温哥华岛上持续流行的隐球菌病的调查显示,主要致病菌为交配后产生的子代。然而,这种流行于地处温带温哥华岛的致病真菌却是原本分布于热带和亚热带的格特隐球菌。证明该流行与有性繁殖后产生的重组子代具有更强的环境适应能力及毒力变异有关〔8〕。
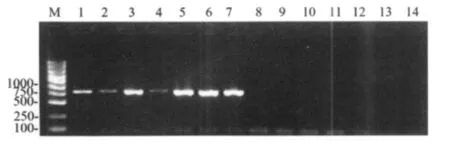
图2 SXI2aF-SXI2aR引物扩增各主要基因型a交配型和α交配型参考株部分结果M,Marker;1-14 依 次 为:KN99、JEC20、E566、WM628、CBS1930、B4546、RV63979、H99、JEC21、WM179、WM178、WM161、WM779、阴性对照Fig.2 The partial results of amplification of MAT αand MATa reference strains within different genotypes with primers SXI2aF and SXI2aR.From left to right:M arker,KN99,JEC20,E566,WM628, CBS1930, B4546, RV63979, H99,JEC21,WM179,WM178,WM161,WM779,negative control
新生和格特隐球菌从遗传学上可分为 8种主要基因型;各主要基因型的交配型位点内基因序列存在明显差异,而同一主要基因型菌株间序列相似性极高(>99%)〔4〕;另外,由于目前研究中分离的a交配型菌株较少,使得设计和评价PCR特异扩增法在鉴定不同主要基因型a交配型菌株中的作用尤为重要。本文通过设计针对a交配型位点内特有的SXI2a基因(α位点无此基因)的特异扩增法,通过和文献报道的针对STE20a、MFa或STE3a基因的特异扩增法及交配试验进行比较,结果显示,引物SXI2aF-SXI2aR扩增受试的所有主要基因型a交配型菌株均获得目的片段,而另外3对引物均不能完全扩增所有主要基因型的a交配型。通过与文献采用的3对a交配型特异性引物进行比较得出,SXI2aF-SXI2aR在鉴定所有类型的a交配型菌株中具有更好的通用性;同时,该引物无法扩增受试的所有主要基因型α交配型参考株,表明该引物是a交配型的特异扩增引物。和文献报道一致〔7〕,本文受试株中也存在不育株,通过交配试验无法鉴定其交配型,且交配试验耗时久,故其鉴定作用受到限制。综上所述,本文针对SXI2a基因的PCR扩增可鉴定新生和格特隐球菌各主要基因型的 a交配型。SXI2aF-SXI2aR引物在快速鉴定a交配型中具有更好的通用性。
〔1〕Sukroongreung S,Kitiniyom K,Nilakul C,et al.Pathogenicity of basidiospores of Filobasidiella neof ormans var.neof ormans〔J〕.Med Mycol,1998,36(6):419-424.
〔2〕Wickes BL.T he role of mating type and mo rphology in Cryptococcusneoformans pathogenesis〔J〕.Int J Med Microbiol,2002,292(5-6):313-329.
〔3〕Meyer W,Castaneda A,Jackson S,et al.M olecular typing of Ibero-American Cryptococcus neoformans Isolates〔J〕.Emerg Infect Dis,2003,9(2):189-195.
〔4〕Feng X,Yao Z,Ren D,et al.Genotype and mating type analysis of Cryptococcus neoformans and Cry ptococcus gattii isolates from China that mainly originated from non-HIV-infected patients〔J〕.FEMS Yeast Res,2008,8(6):930-938.
〔5〕Litvintseva AP,Kestenbaum L,Vilgalys R,et al.Comparative analy sis of environmental and clinical populations of Cry ptococcus neoformans〔J〕.J Clin Microbiol,2005,43(2):556-564.
〔6〕Chaturvedi S,Rodeghier B,Fan J,et al.Direct PCR of Cryptococcusneof ormans MATalpha and M ATa pheromones to determine mating type,ploidy,and variety:a tool for epidemiological and molecular pathogenesis studies〔J〕.J Clin Microbiol,2000,38(5):2007-2009.
〔7〕Saul N,K rockenberger M,Carter D.Evidence of recombination in mixed-mating-ty pe and alpha-only populations of Cry ptococcus gattii sourced from sing le eucaly ptus tree hollows〔J〕.Eukaryot Cell,2008,7(4):727-734.
〔8〕Fraser JA,Giles SS,Wenink EC,et al.Same-sex mating and the origin of the Vancouver Island Cryptococcus gattii outbreak〔J〕.Nature,2005,437(7063):1360-1364.

