广州管圆线虫ASP基因的克隆及原核表达*
郭鹏娟,詹希美,甘 明,李卓雅,于彦杰,潘智华,张美春,何 蔼
广州管圆线虫(Angiostrongylus cantonensis,Ac)是引起嗜酸性粒细胞增多性脑膜炎或脑膜脑炎的重要病原体。幼虫侵入人体,在体内移行,最终侵犯中枢神经系统,引起广州管圆线虫病〔1〕。该病主要发生在热带和亚热带地区,近年来,随着人们饮食生活习惯的改变,该病病例呈逐年增多趋势,越来越引起人们的重视。WHO公布的21世纪新出现的全球威胁性传染病中就包括广州管圆线虫病;我国卫生部在2003年将其列为新发传染病〔2-3〕。但目前关于该病的诊断、治疗等研究仍较有限。天冬氨酸蛋白酶(Aspartic protease,ASP)是具有特征的一大类活性酶。研究证明,其在利什曼原虫、盘尾丝虫、血吸虫及疟原虫等寄生虫中,参与了重要的代谢过程,被认为是较好的诊断分子及疫苗候选靶位〔4-5〕。本试验采用PCR技术选择性的扩增ASP基因,并进行了体外原核表达,旨在为下一步利用重组蛋白研制广州管圆线虫病的诊断试剂盒及基因工程疫苗奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 血清 阳性病人血清为2006年夏季北京暴发期间临床确诊广州管圆线虫病病人血清。
1.1.2 菌株质粒文库 广州管圆线虫幼虫cDNA质粒文库由本室构建。原核表达质粒pET-30a(+)及大肠杆菌BL21/DE3系本室保种。
1.1.3 主要试剂和工具酶 dNTP、ExTaq酶、T4DNA连接酶、SacⅠ、KpnⅠ酶及DNA分子量标准均购自TaKaRa公司。异丙基硫代-β-D-半乳糖苷(IPTG)购自BBI;蛋白质分子量标准购自 Ferment公司。质粒小提试剂盒购于Qiagen公司。采用U-gene DNA凝胶回收试剂盒。Ni-IDA Agarose购自美国Novagen公司。抗组氨酸标签单克隆抗体、辣根过氧化物酶标记的山羊抗小鼠二抗、DAB染色液均购自武汉博士德公司。
1.1.4 引物合成及质粒DNA测序 特异性引物合成及重组质粒DNA测序由大连宝生物公司完成。
1.2 方法
1.2.1 广州管圆线虫天冬氨酸蛋白酶基因的识别广州管圆线虫幼虫cDNA质粒文库(Library)系由本室与上海联众科技研究院合作构建,经文库测序,对得到的大量Unigene基因进行分析及归并。其中的编号为0008e10的序列含有完整的开放读码框,编码产物为广州管圆线虫的天冬氨酸蛋白酶(aspartic protease,ASP)。
1.2.2 ASP基因的扩增 根据已经获得ASP基因的编码序列,利用DNAClub及Primer5.0设计特异性引物。上游引物 P1:为引入的K pnⅠ酶切位点;
以上述cDNA为模板,进行PCR反应。反应条件为:94℃预变性5min,接着进行94℃变性45s,55℃退火30s,72℃延伸60s,反应30个循环,72℃延伸10min。所得PCR产物进行1.2%的琼脂糖凝胶电泳回收。
1.2.3 重组表达质粒pET-30a-(+)-ASP的构建及鉴定 将目的基因及原核表达质粒pET-30a-(+)经KpnⅠ、SacⅠ双酶切后回收,连接,转化感受态大肠杆菌 BL21/DE3,经卡那霉素(Kana)筛选,阳性克隆进一步通过PCR、双酶切及测序鉴定。
1.2.4 pET-30a-(+)-ASP基因在大肠杆菌BL21中的诱导表达 挑取阳性单克隆菌落接种于5mL LB/kan(100μ g/L)液体培养基中,37℃,250 r/min振摇过夜培养12~16 h;将过夜培养物按照1∶100接种到LB/kan液体培养基中,37℃,250r/min培养2~3 h,至对数中期(OD=0.4-0.6);加入 IPTG至终浓度为1.0mmol/L,37℃,250 r/min振荡培养6 h,取1mL表达产物,13 000 r/min离心 1min,收集菌体。沉淀中加入100μL 1×SDS凝胶上样缓冲液,重悬。沸水浴煮沸 3~5min,13 000 r/min离心1min,取上清10μL进行SDS-PAGE电泳分析。
1.2.5 时间和温度对融合表达的影响 按照1.2.4方法,分别在诱导时间为2h,4h,6h,8h,10h留样,SDS-PAGE电泳分析诱导时间对表达产物的影响;诱导温度为25℃,30℃,37℃时,SDS-PAGE电泳分析温度对表达产物量及可溶性的影响。
1.2.6 重组蛋白在大肠杆菌BL21中的大量诱导表达及亲和层析纯化 按照上述方法对阳性克隆进行大量诱导表达,离心收集菌体,按菌液:裂解缓冲液 (含 20mmol/L Tris-Cl、500mmol/L NaCl、5mmol/L咪唑,pH 7.9)=25∶1的比例加入裂解缓冲液,重悬菌体。加入溶菌酶至终浓度1mg/mL,混匀,冰上放置30min;冰上超声法裂解细菌:功率150W,超声 1s,停 2s,总时间 12min。4℃,6 000g离心30min,取上清,经 0.45μ m滤器过滤后,参照Ni-IDA Agarose说明书进行亲和层析纯化。洗脱的目的蛋白经 PBS(pH7.4)4℃过夜透析,SDSPAGE电泳分析后备用。
1.2.7 免疫印迹法检测重组蛋白 以抗His标签单克隆抗体(1∶1 000稀释)及广州管圆线虫病人血清(1∶300稀释)为一抗,山羊抗小鼠IgG-HRP溶液(1∶400稀释)及羊抗人IgG-HRP为二抗,进行免疫印迹实验,分析鉴定蛋白。
2 结 果
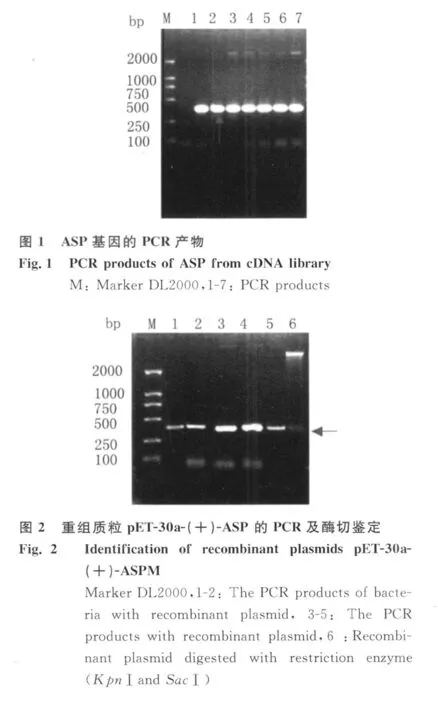
2.1 ASP基因的体外扩增 PCR特异性扩增目的基因,1.2%的琼脂糖凝胶电泳鉴定,结果显示在大约360bp的位置有一个明显的扩增条带,其大小与ASP基因编码区长度一致,如图1。
2.2 重组质粒的鉴定 重组质粒经过菌液PCR、质粒PCR及双酶切鉴定,通过1.0%琼脂糖凝胶电泳得到清晰的酶切图象,目的基因在360bp的位置,载体基因在5 422bp位置,如图2。
2.3 重组蛋白原核表达纯化的SDS-PAGE分析经鉴定含pET-ASP重组质粒的BL21菌株,不同温度下,IPTG终浓度1.0 mmol/L,进行诱导表达。诱导产物经过亲和层析纯化,经15%SDS-PAGE鉴定,显示在约16kD大小处有明显的表达条带(图3),与理论分子量相符。蛋白纯化效果较好。
2.4.1 重组蛋白的His-Tag鉴定 重组蛋白带有6×his标签,通过与His单克隆抗体反应,可以发现在相应的位置有条带出现,如图4。
2.4.2 重组蛋白的广州管圆线虫病人血清鉴定重组蛋白识别广州管圆线虫病人血清,可以在相应位置有反应条带出现,如图5。

3 讨 论
天冬氨酸蛋白酶作为一种重要的活性酶,在脊椎动物中主要的天冬氨酸蛋白酶如,胃蛋白酶、组织蛋白酶D、E和肾素等都已经确认。这些酶参与降解和吞饮细胞内蛋白,尤其是组织蛋白酶大多都与蛋白降解有关,且组织分布广泛。目前,天冬氨酸蛋白酶已经在很多线虫中得到确认,包括秀丽隐杆线虫、美洲板口线虫、犬钩口线虫及粪类圆线虫等〔6-9〕。由天冬氨酸蛋白酶、半胱氨酸蛋白酶以及金属蛋白酶组成的肠源性多酶体系已被认为是较好的线虫疫苗候选抗原。有研究证明ASP在钩虫幼虫侵入宿主过程中有重要作用,杨玉荣等对犬钩虫的ASP基因进行了体外克隆,进行了初步的研究,并推测认为其在引起宿主的免疫反应方面有重要作用,是抗钩虫疫苗的可能的候选分子〔10〕。在数种寄生虫病中,天冬氨酸蛋白酶已经是一些临床用药的靶位。
广州管圆线虫天冬氨酸蛋白酶的功能未知。本课题利用基因克隆和重组表达的方法将广州管圆线虫ASP基因进行体外表达,获得纯化的重组蛋白。免疫印迹(Western blotting)显示该目的蛋白能被广州管圆线虫病人血清所识别。为进一步研究该蛋白在广州管圆线虫中的作用奠定了基础。

图5 融合蛋白与广州管圆线虫病人血清的免疫印迹反应Fig.5 Western blotting analysis of fusion protein with patients serum.
〔1〕詹希美.人体寄生虫学(八年制)〔M〕.北京:人民卫生出版社,2005,227-229.
〔2〕Binder S,Levitt AM,Sacks JJ,et al.Emerging infections diseases:public health issue fo r the 21st century〔J〕.Science,1999,284(5418):1311-1313.
〔3〕于恩庶,魏承毓.新发现和再肆虐传染病诊断标准和防治指南〔M〕.香港:国际炎黄文化出版社,2002.282-283.
〔4〕Delcroix M,Sajid M,Caffrey CR,et al.A multienzyme network functions in intestinal protein digestion by a platyhelminth parasite〔J〕.J Biol Chem,2006,281(51):39316.
〔5〕Verity CK,McManus DP,Brindley PJ.Vaccine efficacy of recombinant cathepsin D aspartic protease from Schistosoma japonicum〔J〕.Parasite Immunol,2001,23(3):153-162.
〔6〕杨荣武.生物化学原理〔M〕.北京:高等教育出版社,2006:135-141.
〔7〕Na BK,Lee EG,Lee HW.Aspartic proteases of Plasmodium vivax are highly conserved in wild isolates〔J〕.Korean J Parasitol,2004,42(2):61-66.
〔8〕Williamson A L,Brindley PJ,Loukas A,et al.Hookworm cathepsin D aspartic proteases:contributing roles in the host-specific degradation of serum proteins and skin macromolecules〔J〕.Parasitology,2003,126(2):179-185.
〔9〕Coombs GH,Goldberg DE,Klemba M,et al.Aspartic proteases of Plasmodium f alciparum and other parasitic protozoa as drug targets〔J〕.T rends Parasitol,2001,17(11):532-537.
〔10〕杨玉荣,韦华.犬钩虫(Ancy lostomacaninum)天冬氨酸蛋白酶基因的克隆和在大肠杆菌中的表达〔J〕.中国人兽共患病学报,2007,23(12):1222-1225.

