云南大理白族带绦虫mtDNA-Cytb序列测定及分析*
罗 浪,杨毅梅
带绦虫在动物分类学上属于绦虫纲、圆叶目、带科、带属〔1〕。传统的分类认为人体带绦虫有猪带绦虫和牛带绦虫两种。猪带绦虫以猪作为中间宿主,牛带绦虫以牛作为中间宿主。但是自上世纪70年代以来,在我国台湾和东南亚地区发现了一种新的带绦虫,其外形与牛带绦虫近似,但是因为人吃生的或未煮熟的猪内脏被感染。经过近20年来的研究,这种绦虫被命名为亚洲带绦虫(Taenia asiatica)〔2〕。
云南大理是多民族聚集地区,尤以白族为首,当地白族居民沿袭着古老的风俗习惯,喜吃“生皮”、烧烤,生食猪、牛及野生动物的习惯造成了带绦虫病的广泛流行〔3〕。因此对该地区带绦虫进行鉴定,对制定当地乃至少数民族地区带绦虫病的防治策略具有重要的实际意义。本研究以线粒体DNA细胞色素b(mtDNA-Cytb)基因序列作为分子标记,对云南大理白族带绦虫标本进行分类鉴定。
1 材料与方法
1.1 材料
1.1.1 带绦虫的采集 在对云南大理白族地区的带绦虫流行病学调查过程中,对粪检有虫卵或排节片史者,采用槟榔、南瓜子驱虫,用生理盐水冲洗干净,经压片后,置70%酒精中固定保存。贵州省都匀亚洲带绦虫由贵阳医学院寄生虫学教研室惠赠,保存在70%酒精溶液。牛带绦虫采自云南省大理洱源,75%酒精保存。
1.1.2 主要试剂 SDS(中山大学达晖生物技术有限公司)、Tris平衡酚(上海生工生物工程技术服务有限公司)、dNTPs(上海生工生物工程技术服务有限公司),引物P1、P2(上海生工生物工程技术服务有限公司),TaqDNA聚合酶(上海生工生物工程技术服务有限公司),琼脂糖(Agarose),(中山大学达晖生物技术有限公司),分子量标准(DL2000 DNA Marker)(上海生工生物工程技术服务有限公司)
1.2 方法
1.2.1 带绦虫基因组DNA提取 采用酚氯仿法提取绦虫基因组 DNA〔4〕。
1.2.2 PCR扩增mtDNA-Cytb序列部分片段 使用 mtDNA-Cytb 引物〔5〕:
正向引物P1:5′-TTATGAGAT TGTCAAAA GATTCTT-3′
反向引物 P2:5′-TATAGATGTCAAAACAGTAGCAGCCC-3′
由上海生工生物工程技术服务有限公司合成。
PCR反应体系及条件:10×buffer(MgCl2 15mmol/L)5μL,dNTP(10 mmol/L)1μL,TaqDNA 聚合酶(5U/μL)0.3μL,引物(100 mmol/L)各1μL,模板 DNA(200 ng/μL)3μL,无菌双蒸水补足25μL。扩增条件:94℃预变性5 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,共30个循环;72℃再延伸5 min,4℃保存。取6μL PCR产物与 2μL 6×加样缓冲液混匀,于1.5%琼脂糖凝胶(含溴化乙啶5μ g/mL)电泳后,在凝胶成像仪上观察结果,并照相记录。
1.2.3 mtDNA-Cytb序列部分片段的克隆和测定
mtDNA-Cytb序列部分片段的克隆和测定在天跟生物工程(北京)有限公司进行。
1.2.4 序列分析和系统发育树状图 带绦虫标本mtDNA-Cytb序列部分片段测序结果用DNAMAN(v5.2.2)软件处理后进行同源性分析 ,并计算遗传距离和构建系统发育树状图。
2 结 果
2.1 PCR产物1.5%琼脂糖凝胶电泳根据电泳图预测,扩增的目的片段大小约为250 bp左右,与文献〔5〕一致。见图1。

图1 mtDNA-Cytb序列部分区段PCR产物1.5%琼脂糖凝胶电泳Fig.1 Electrophoresis profile of partial segments of mtDNACytb PCR products with 1.5%agarose gel
2.2 带绦虫mtDNA-Cytb序列特征
2.2.1 GC含量 云南大理白族带绦虫标本(B1-B6)mtDNA-Cytb序列部分片段GC含量分别为33.33%、32.86%、35.24%、34.76%、33.81%和32.86%,6株白族带绦虫标本mtDNA-Cytb序列部分片段A、C、G和T含量见图2。
2.2.2 带绦虫标本mtDNA-Cytb序列部分区段概况 使用引物P1/P2对大理白族带绦虫标本mtDNA-Cytb序列部分区段扩增 ,根据电泳图预测扩增的目的片段长度均为 250 bp左右。序列测定结果表明,云南大理白族带绦虫标本(B1-B6)扩增片段长分别为 254 bp、252 bp、262 bp、252 bp、223 bp 和260 bp。
2.3 遗传距离及系统发育树状图 使用DNAMAN软件分析云南大理白族带绦虫mtDNA-Cytb序列部分片段,除本实验测定的序列外,还使用了GenBank中的其他序列,其登记编号分别为AB066580(亚洲带绦虫中国台湾)、AB066571(猪带绦虫中国云南)和AB066581(牛带绦虫 中国乌鲁木齐)上述3种序列以及测出的6个带绦虫标本序列,计算遗传距离(见表1)并构建系统发育树。大理白族带绦虫(B1、B2、B6)标本与台湾亚洲带绦虫标本mtDNA-Cytb序列同源性为100%,大理白族带绦虫(B5)标本与台湾亚洲带绦虫标本mtDNA-Cytb序列同源性为99%,大理白族带绦虫(B3、B4)与中国云南猪带绦虫标本mtDNA-Cytb序列同源性为99%。系统发育树的结果共同显示:大理白族带绦虫(B1、B2、B5、B6)株与台湾亚洲带绦虫标本株首先并为一支,然后与乌鲁木齐牛带绦虫株相聚(Ⅰ);大理白族带绦虫(B3、B4)株与云南猪带绦虫标本株并成一支(Ⅱ);最后Ⅰ支和Ⅱ支相聚,形成姊妹群关系。见图3。
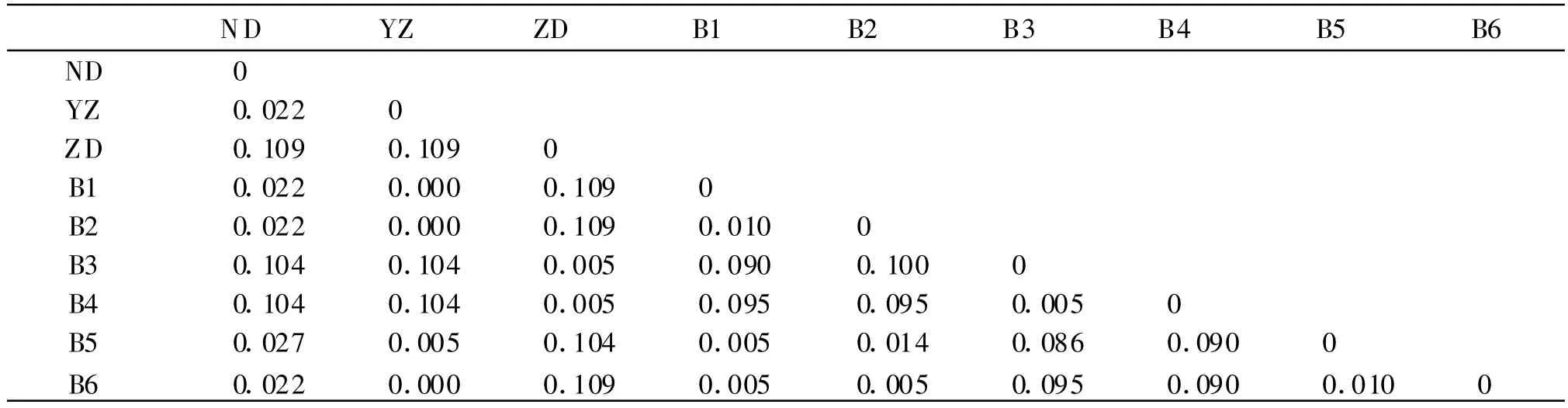
表1 带绦虫的氨基酸遗传距离比较Table 1 Comparison of genetic distances of aminoacids from Taeniacestodes
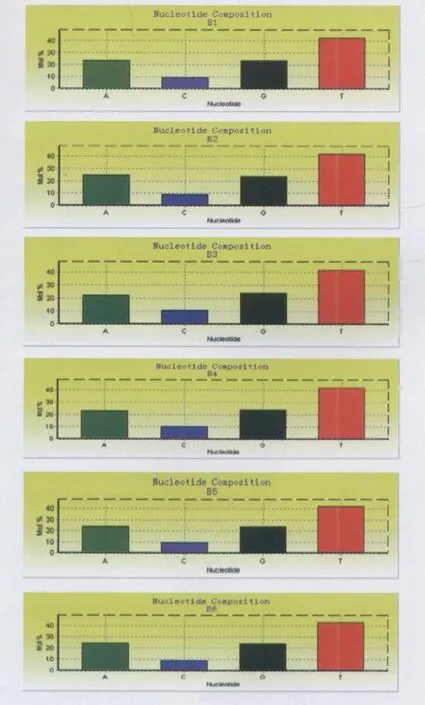
图2 大理白族带绦虫标本mtDNA-Cytb序列部分片段4种核苷酸含量Fig.2 Each content of A,C,G and T in the partial segments of mtDNA-Cytb sequences in Bai population(Dali)sample of Taenia cestodes

图3 根据带绦虫mtDNA-Cytb序列部分片段数据构建的系统发育树Fig.3 phylogenetic tree based on partial segments of mtDNACytb sequences dataof Taenia cestodes(ML Method).
3 讨 论
自上世纪90年代以来,对于带绦虫分类的研究,国内外学者除了形态学外,对该虫的研究逐渐转向了从分子生物学水平来探讨其恰当的分类地位。本文利用分子生物学方法对云南大理白族地区带绦虫虫株进行分类鉴定,选择mtDNA-Cytb序列作为其分子遗传标记。mtDNA作为胞核外遗传物质具有分子量小、结构简单、母性遗传、无组织特异性等特点,是研究寄生虫分子分类、群体遗传、系统进化的一种很好的分子标记〔6-7〕。已经证实,Cytb基因序列在解决亲缘关系很近的阶元的系统关系方面非常有用,被认为是解决系统发育问题最可信的mtDNA标记之一〔8〕。mtDNA-Cytb基因进化速度适中,适合于研究由种内到种间甚至于科间的系统进化关系〔9〕。当前,国内外学者已将mtDNA-Cytb基因应用法医学、哺乳动物,鸟类、昆虫、寄生虫,细菌等〔10-12〕的分类鉴定研究。
日本学者〔13〕以COX1和Cob为靶标,用切除描述胸腺嘧啶基础序列方法,结果是特征性胸腺嘧啶基础峰的图谱显示了四个不同的类型,亚洲带绦虫、牛带绦虫和两种基因型猪带绦虫。Jeon HK.等〔14〕对亚洲带绦虫作了线粒体基因序列测定分析,发现亚洲带绦虫与牛带绦虫间细胞色素C氧化酶I(COX1)和Cob(细胞色素 b)序列的差异分别为4.6%和4.1%,提出亚洲带绦虫是牛带绦虫的亚种。张晨昊〔15〕等通过采用mtDNA-Cytb序列作为分子遗传标记对采自云南西部三地带绦虫进行生物多态性研究,结论显示大理和怒江带绦虫属于亚洲带绦虫,云南楚雄带绦虫属于牛带绦虫。mtDNACytb序列分析可以用于带绦虫生物多态性研究。
本研究使用DNAMAN软件分析云南大理白族带绦虫mtDNA-Cytb序列部分片段,并结合GenBank中已知猪带绦虫、牛带绦虫和亚洲带绦虫mtDNA-Cytb序列,成功的构建了系统发育树,结果显示:大理白族带绦虫(B1、B2、B5、B6)株与台湾亚洲带绦虫标本株首先并为一支,然后与乌鲁木齐牛带绦虫株相聚(Ⅰ);大理白族带绦虫(B3、B4)株与云南猪带绦虫标本株并成一支(Ⅱ);最后Ⅰ支和Ⅱ支相聚,形成姊妹群关系。结果表明:大理白族带绦虫(B1、B2、B5、B6)株与台湾亚洲带绦虫之间的关系最为接近,应是同一个种。大理白族带绦虫(B3、B4)株与云南猪带绦虫标本关系最为接近,应是同一个种。该结果说明在带绦虫生物多态性研究中,尤其是牛带绦虫与亚洲带绦虫分类学研究中,mtDNA-Cytb序列可以作为种间、种下分类的分子遗传标记。
〔1〕潘卫庆,汤林华.分子寄生虫学〔M〕.上海:上海科学技术出版社,2004:370.
〔2〕Eom KS.What is Asian Taenia〔J〕.Parasitol Int,2006,55(Suppl):137-141.
〔3〕杨毅梅,李振,石武祥,等.云南大理洱海环湖带绦虫流行病学调查〔J〕.中国病原生物学杂志,2007,2(2):109-114.
〔4〕J.萨姆布鲁克EF,弗里奇T,曼尼阿蒂斯.分子克隆实验指南〔M〕.2版.北京:科学出版社,1999(6):464-467.
〔5〕Hiroshi Yamasaki,Minoru Nakao,Yasuhito Sako,et al.DNA differential diagnosis of human taeniid cestodes by base ex cision sequence scanning Thymine-Base reader analysis with mitochondrial genes〔J〕.Clin.Microbiol,2002,40(10):3818-3821.
〔6〕Boore JL,Animal.mitochondrial genomes〔J〕.Nucleic Acids Research,1999,27(8):1767-1780.
〔7〕Feagin JE.Mitochondrial genome diversity in parasites〔J〕.International Journal for Parasitology,2000,30(4):371-390.
〔8〕Zardoya R,Meyer A.Phylogenefic.performance mitochondrial proteineoding genes in resolving relationship among Venebrutes〔J〕.Mol Biol Evol,1996,13(7):933-942.
〔9〕Kouch T D,Thomas W K A,Meyer S V,et al.Dy-namics of mitochondrial DNA evolution in animal:Application and sequencing with conserved primers〔J〕.Proc Acad Sci USA,1989,86(6):1906-2001.
〔10〕刘超,刘宏,李红霞,等.细胞色素b基因序列测定进行种属鉴定应用研究〔J〕.刑事技术,2002,4:11-13.
〔11〕耿荣庆.山羊线粒体DNA 细胞色素b基因序列分析〔J〕.草食家畜,2006,2:32-34.
〔12〕朱振华,叶辉,张智英.基于mtDNA Cytb的六种果实蝇的分子鉴定〔J〕.昆虫学报,2005,48(3):386-390.
〔13〕Yamasaki H,Nakao M,Sako Y,et al.DNA differential diagnosis of human taeniid cestodes by base excision sequence scanning thymine-base reader analysis with mitochondrial genes〔J〕.J Clin Microbiol,2002,40(10):3818-3821.
〔14〕Jeon HK,Kim K H,Eom KS.Complete sequence of the mitochondrial genome of Taenia saginata:comparison with T.solium and T.asiatica 〔J〕.Parasitol Int,2007,56(3):243.
〔15〕张晨昊,杨毅梅.云南西部三地带绦虫生物多态性分子遗传学标记的研究〔J〕.中国病原生物学杂志,2009,4(4):283-286.

