肝细胞生长因子基因修饰的人骨髓间充质干细胞促进大鼠肢体血管新生
刘滋康 具星爱 靳继德 秦宜德 郭子宽
·论著·
肝细胞生长因子基因修饰的人骨髓间充质干细胞促进大鼠肢体血管新生
刘滋康 具星爱 靳继德 秦宜德 郭子宽
目的评价肝细胞生长因子(Hepatocyte growth factor,HGF)修饰的人骨髓间充质干细胞(Human bone marrow mesenchymal stem cells,hMSC)体内促血管新生效应,探讨其作用机制。方法结扎Wistar大鼠右侧股动脉,建立局部肢体缺血模型。将hMSC、hMSC/Ad-HGF或PBS,通过肌肉注射接种于缺血区,21 d后以对侧肢体为正常对照,进行激光多普勒灌注成像测定、HE染色和免疫组化检查,评价骨骼肌微血管密度。以MTT、Transwell及内皮细胞体外管状结构形成实验,评价hMSC/Ad-HGF对血管内皮细胞的体外增殖、迁移及成管状能力的影响。结果21 d后,hMSC/Ad-HGF和hMSC组血流灌注水平明显高于对照组(P<0.01),前者接近PBS组,显著高于hMSC组(P<0.05)。组织学分析表明,每高倍视野肌肉组织中,hMSC/Ad-HGF组微血管数量最高,PBS组和hMSC组次之,对照组最低(P<0.01)。hMSC/Ad-HGF培养上清可明显促进ECV304细胞的增殖,刺激作用高于表皮生长因子(20 ng/mL,P<0.001);促进细胞跨膜迁移和管状样结构形成,强于表皮生长因子。结论hMSC/Ad-HGF可促进血管内皮细胞的增殖、迁移及血管结构重建,从而引发血管新生效应。
间充质干细胞肝细胞生长因子血管新生基因转移
随着人口老龄化以及糖尿病患者的增多,心脑血管疾病的发病呈加剧态势,因而外周动脉疾病及局部肢体缺血性疾病的研究越来越受到重视。骨髓源间充质干细胞(Mesenchymal stem cells,MSC)作为一种成体干细胞,具有成骨、成软骨、成脂肪等的分化能力,且本身分泌多种造血相关细胞因子,具有免疫调节功能。因此,hMSC也可能是治疗缺血性疾病的理想细胞。近年来,已经有MSC治疗骨组织损伤、移植物抗宿主病和克隆氏病等疾病的报告,并证实了MSC应用的安全性。
然而,以往有关心肌缺血性疾病的实验研究表明,MSC移植后大部分细胞在72 h内死亡。在股骨头坏死模型的研究中我们发现,携带人肝细胞生长因子的腺病毒载体感染的MSC(MSC/Ad-HGF),具有更好的抗细胞凋亡能力[1]。此外,HGF具有很强的促血管再生能力。因此,与MSC相比较,MSC/Ad-HGF可能有更好的肢体缺血治疗作用。
股动脉结扎造成动物的局部肢体缺血,是目前普遍采用的动物模型[2-3],适用于缺血性疾病发病机制及治疗的基础研究。本研究在制备大鼠后肢缺血模型的基础上,利用激光多普勒血流灌注成像(Laser Doppler Perfusion Imaging,LDPI)技术,对大鼠后肢血流灌注水平的变化进行评估;采用标记CD31抗体的免疫组化方法,测定肌肉组织微血管密度的变化;以血管内皮细胞ECV304细胞为对象,体外研究携带肝细胞生长因子基因的重组腺病毒修饰的人骨髓间充质干细胞(hMSC/Ad-HGF),对其增殖、迁移及成管状能力的影响,综合探讨HGF基因修饰后的hMSC,在局部缺血的环境下,体内促进血管新生的功能及机制。
1 材料与方法
1.1 材料
Wistar大鼠(军事医学科学院实验动物中心);Ad-HGF病毒液和ECV304细胞系(本实验室);Matrigel(Sigma公司,美国);激光多普勒血流灌注成像仪PeriScan PIMⅡ及LDPIwin软件(Perimed公司,瑞典);Transwell迁移板(Corning Costar公司,美国)。
1.2 方法
1.2.1 大鼠局部肢体缺血模型的制备
以大鼠右后肢为手术肢,进行股动脉结扎,具体操作如下:腹腔注射戊巴比妥钠溶液,麻醉后仰卧固定,备皮,沿血管走行方向切口,暴露并分离与静脉伴行的股动脉,结扎2次并从中间剪断。术后48 h,取3只大鼠进行LDPI测定,评估模型制作方法。
1.2.2 缺血区注射hMSC、hMSC/Ad-HGF或PBS
常规方法扩增培养hMSC,制备hMSC/Ad-HGF,将第3代细胞用于实验。
将股动脉结扎处理的大鼠分为3组,即hMSC/ Ad-HGF组、hMSC组和PBS组,每组12只。手术后24 h采用肌肉注射的方法,在缺血区进行hMSC/ Ad-HGF和hMSC的接种,每只接种量为1×106个细胞,以PBS作为对照,待第21天进行LDPI测定。
1.2.3 肢体血流灌注水平的评估
接种21 d的大鼠,8%Na2S溶液脱毛处理,利用激光多普勒血流灌注成像仪,进行LDPI测定,评估后肢血流灌注水平的变化。每个样本测量3次,LDPIwin软件进行分析。
1.2.4 缺血区肌肉组织微血管密度的测定
LDPI测定后的大鼠,取股四头肌,制作石蜡切片,行HE染色,油镜下观察,每样本随机选取8个视野,以不超过8个红细胞直径大小的管腔结构作为微血管,进行计数并拍照[4],测定微血管密度。
标记CD31抗体[5]:肌肉组织切片脱蜡水化后,经抗原修复及去除内源性过氧化物酶,5%BSA封闭4 h,rabbit anti-CD31 antibody(1∶50)4℃孵育过夜,分别以goat anti rabbit IgG-HRP(1∶500)和goat anti rabbit IgG-FITC(1∶100)37℃避光孵育30 min,荧光显微镜下或DAB显色后观察结果。
1.2.5 hMSC/Ad-HGF对血管内皮细胞ECV304增殖的影响
利用MTT法,测定hMSC/Ad-HGF和hMSCs的无血清培养上清对血管内皮细胞ECV304体外增殖的影响。设定5组增殖诱导体系,即①hMSC/Ad-HGF无血清培养上清组;②hMSC无血清培养上清组;③DMEM组;④DMEM+10%FBS组;⑤DMEM+ EGF(20 ng/mL)。将ECV304以每孔2 000个细胞,接种于96孔板中,12 h后取12孔行MTT法测定,读取波长490 nm处的吸光值,,其余换成以上5种培养体系,每隔24 h测定1次,每组测定12孔,并将剩余细胞进行换液,连续测定3 d,结果以t检验法进行统计学分析。
1.2.6 hMSC/Ad-HGF对ECV304迁移的影响
设定5组迁移诱导体系(同上),其中hMSCs均为第3代细胞。向Transwell下室各加入600 μL迁移液,上室加入100 μL经DMEM重悬的ECV304(1×106cells/mL),每组做3复孔,37℃、5%CO2迁移8 h。4%多聚甲醛固定10 min,Giemsa染色2 min,棉签轻轻拭去上层细胞,光镜下观察结果。200倍放大后,选取细胞密度最高的5个视野计数,统计分析。
1.2.7 hMSC/Ad-HGF对ECV304体外成管状能力的影响
设定2大组,A组(Matrigel包被)和B组(无Matrigel包被),每组分别设定5小组,培养体系同上,具体操作如下:取Matrigel冰上融化,向24孔板中每孔加入25 μL原液,37℃孵育1 h。DMEM重悬ECV304至1×106cells/mL,每孔加入4×104个细胞,每小组设3复孔,37℃、5%CO2培养24 h,Giemsa染色2 min,光镜下观察拍照。100倍放大倍数下,选取管状密度最高的5个视野计数,统计学分析。
1.2.8 统计学分析
数据以均数±标准差表示,以t检验进行统计学处理,P<0.05为显著性差异。
2 结果
2.1 大鼠局部肢体缺血模型的建立
通过结扎右后肢股动脉制备大鼠局部肢体缺血模型,术后48 h行LDPI测定,评估血流灌注水平,检验模型制备效果(图1)。术后实验侧与正常对照侧的平均值分别为1.0和1.8,实验侧血流灌注水平降低了44%,说明股动脉结扎的方法是有效的。

图1 大鼠局部肢体缺血模型的建立及评估
2.2 接种细胞21 d后肢体血流灌注水平的评估
术后大鼠分别接种hMSC和hMSC/Ad-HGF,并以PBS作为对照组。21 d后进行LDPI测定,经LDPIwin软件分析获得血液灌流量值的相对值,并进行统计学分析。各组经LDPI测定时,获得的二维彩色灌注图像,颜色越鲜艳代表灌流量越大,颜色越暗代表灌流量越小。hMSC和hMSC/Ad-HGF组血流灌注的恢复水平要明显高于PBS组,hMSC/Ad-HGF组恢复得最好(图2)。为了更准确地对各组灌注水平进行评估,我们利用t检验的方法进行显著性分析。LDPI测得PBS组、hMSC组、hMSC/Ad-HGF组和正常对照组的灌流相对值分别为1.46±0.12、1.74±0.13、2.03±0.16和2.05±0.14。其中,hMSC明显高于PBS组(P<0.01),低于hMSC/Ad-HGF组(P<0.05);hMSC/Ad-HGF组与正常对照组很接近,无显著性差异。说明HGF基因修饰后的hMSC,可以更好地促进大鼠局部肢体缺血后血流灌注的恢复,具有更强的促血管新生的作用。

图2 通过LDPI测定,评估细胞接种21 d后的血流灌注水平
2.3 缺血区肌肉组织微血管密度的检测
接种细胞21 d后,油镜下观察骨骼肌微血管,以不超过8个红细胞直径的管腔结构,作为微血管进行计数,其中以含有0~2个红细胞的管腔结构最为常见。PBS组、hMSC组、hMSC/Ad-HGF组及正常对照组的计数结果分别为6.0±1.3、8.6±1.6、14.0±1.9和8.8±1.7(图3)。以血管计数评估微血管的密度得出,hMSC组的MVD显著高于PBS组(P<0.01),正常对照组低于hMSC/Ad-HGF组(P<0.05),而略高于hMSC组,无显著性差异,说明hMSC/Ad-HGF接种21 d后产生了更强的促血管新生效应。利用免疫组化和免疫荧光的方法,以CD31抗体标记微血管,进行各组MVD的差异比较,结果与上述一致。
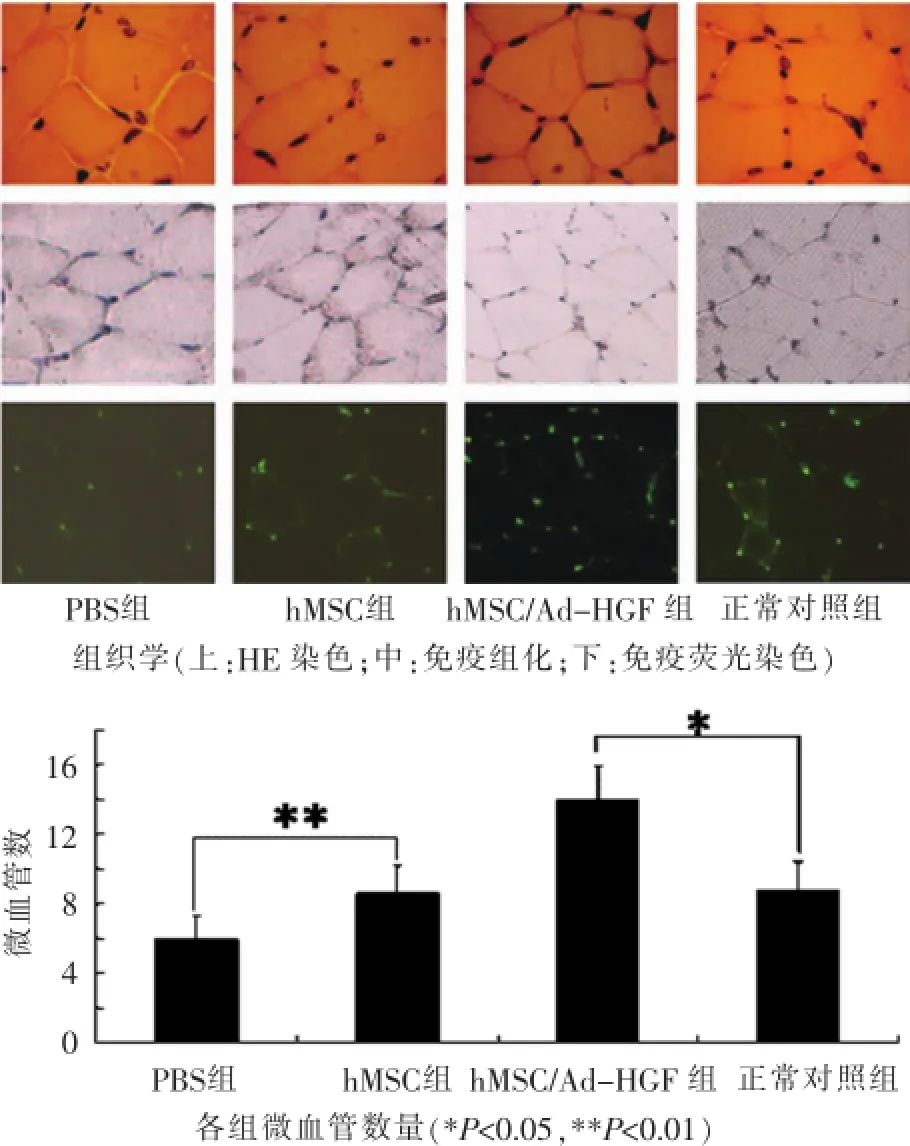
图3 细胞接种21 d后,骨骼肌MVD的检测及统计学分析
2.4 hMSC/Ad-HGF促进ECV304体外增殖
以MTT法检测hMSC/Ad-HGF对ECV304体外增殖的影响。当ECV304在5种不同体系中培养至第2、3天时,MTT测定结果经t检验分析得出,hMSC/Ad-HGF组的OD490值均高于其余各组(图4),且差异显著(P<0.001),说明hMSC/Ad-HGF能有效促进血管内皮细胞的体外增殖。

图4 hMSC/Ad-HGF促进ECV304体外增殖(*P<0.05,**P<0.01)
2.5 hMSC/Ad-HGF促进ECV304体外迁移
采用Transwell迁移方法,体外评价hMSC/Ad-HGF对ECV304迁移的影响。ECV304在不同的诱导体系中,迁移至Transwell膜的背面,光镜200倍下对迁移至膜背面的细胞进行计数,DMEM、DMEM+10%FBS、DMEM+EGF、hMSC和hMSC/Ad-HGF组的计数结果分别为49±13、673±51、556±31、274±23和641±40,各组间均具有显著性差异,而hMSC/Ad-HGF组明显高于hMSC和DMEM对照组,说明hMSC/Ad-HGF可以体外促进ECV304迁移(图5)。
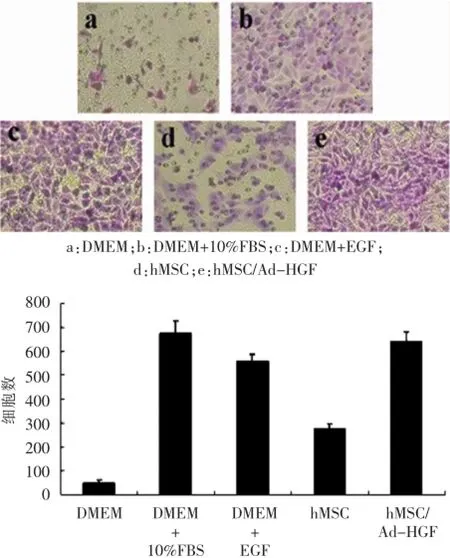
图5 hMSC/Ad-HGF促进ECV304体外迁移
2.6 hMSC/Ad-HGF促进ECV304体外成管状
通过不同的处理因素对血管内皮细胞体外成管状能力影响的测定,进一步研究hMSC/Ad-HGF体内促血管新生的机制。ECV304经不同体系诱导后的体外成管状样结构,以没有包被Matrigel的DMEM+10%FBS体系进行诱导培养,12 h后未发现成管状样结构,细胞生长状态良好;包被Matrigel后仅以DMEM进行ECV304的培养,12 h后不仅未出现管状结构,贴壁细胞少且状态较差;在相应的诱导体系下培养12 h后,形成了不同程度的管状样结构,DMEM+EGF+Matrigel组促进ECV304体外成管状能力,高于DMEM+10%FBS+Matrigel组(P<0.05),而低于hMSC+Matrigel组(P<0.01),其中hMSC/Ad-HGF+Matrigel组成管状能力最强,且显著高于hMSC+Matrigel组(P<0.001),说明hMSC/Ad-HGF具有很强的促进血管内皮细胞体外成管状的能力,再次证明经HGF基因修饰的hMSC具有促进血管新生的功能(图6)。

图6 hMSC/Ad-HGF诱导ECV304体外成管状
3 讨论
Kinnaird等[2]证实,体外培养的MSC可分泌VEGF、FGF,促进内皮细胞、平滑肌细胞的增殖、迁移,呈剂量依赖性;体内以经股动脉结扎造成单侧肢体缺血的BALB/c小鼠为实验模型,通过多点肌肉注射MSC的方法,揭示MSC通过旁分泌途径增加缺血部位血流供应,促进血管重建。Layman等[3]通过建立小鼠肢体缺血模型,以FGF-2和G-CSF联合用药的方式,阐明其促进血流供应的恢复和成熟血管的形成,且比单一因子用药时产生更强的效应,这也说明在缺血性疾病的恢复过程中,相关细胞因子起到了重要作用。
作为一种低免疫原性细胞,MSC具有免疫抑制作用,异体细胞已经应用于临床试验,治疗异基因骨髓移植后移植物抗宿主病[8-10]。因此,异体MSC联合细胞因子治疗组织缺血性疾病,可能具有更重要的潜在价值。
本实验在建立大鼠局部肢体缺血模型的基础上,通过肌肉注射经HGF基因修饰的人骨髓MSC,并以hMSC和PBS为对照,评价hMSC/Ad-HGF异基因治疗大鼠缺血,促进血管新生的功能。大鼠缺血区骨骼肌横向切片经HE染色,未见明显的肌肉坏死和炎症反应。通过LDPI及肌肉组织MVD的测定,证实hMSC/Ad-HGF对缺血区血流灌注恢复及组织微血管密度增高均起到了良好的促进作用,且治疗效果要明显好于hMSC和PBS组,具有显著差异性。为了深入探讨hMSC/Ad-HGF体内促血管新生的作用机制,我们以血管内皮细胞ECV304为评价对象[6-7],从hMSC/Ad-HGF对ECV304体外增殖、迁移以及成管状结构的影响等方面开展了一系列体外实验研究。结果表明,hMSC/Ad-HGF在各处理组中,对ECV304具有最强的促进其增殖和成管状结构的效应,并具有较强的诱导其迁移的能力。因此,我们推测,hMSC/Ad-HGF通过增加自身分泌的促血管生长因子,显著促进了血管内皮细胞的增殖、迁移及血管结构的重建,并以此在体内发挥促血管新生的作用。
[1]宫恩年,楼晓,商丰元,等.肝细胞生长因子基因修饰的间充质干细胞治疗兔股骨头坏死[J].组织工程与重建外科杂志,2008,4(3): 121-124.
[2]Kinnaird T,Stabile E,Burnett MS,et al.Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms[J].Circ Res,2004,94:678-685.
[3]Layman H,Sacasa M,Murphy AE,et al.Co-delivery of EGF-2 and G-CSF from gelatin-based hydrogels as angiogenic therapy in a murine critical limb ischemic model[J].Acta Biomater,2009, 5(1):230-239.
[4]阮洪军,陶厚权,赵仲生.胃癌组织中微血管密度的测定及其临床意义[J].肿瘤学杂志,2008,14(6):443-445.
[5]Casneuf VF,Demetter P,Boterberg T,et al.Antiangiogenic versus cytotoxic therapeutic approaches in a mouse of pancreatic cancer: an experimental study with a multitarget tyrosine kinase inhibitor (sunitinib),gemcitabine and radiotherapy[J].Oncol Rep,2009,22 (1):105-113.
[6]Zheng ZZ,Liu ZX.CD151 gene delivery increase eNOS activity and induces ECV304 migration,proliferation and tube formation [J].Acta Pharmacol Sin,2007,28(1):66-72.
[7]Wang SB,Cheng YN,Cui SX,et al.Des-gamma-carboxy prothrombin stimulates human vascular endothelia cell growth and migration[J].Clin Exp Metastasis,2009,26(5):469-477.
[8]王恒湘,边素燕,陈金龙,等.间充质干细胞不抑制体内T淋巴细胞的增殖[J].组织工程与重建外科杂志,2005,1(5):248-250.
[9]王恒湘,郭子宽.间充质干细胞在组织再生应用中的诸多问题[J].组织工程与重建外科杂志,2008,4(5):241-245.
[10]Riekstina U,Cakstina I,Parfejevs V,et al.Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow,adipose tissue,heat and dermis[J].Stem Cell Rev and Rep,2009,5(4):378-386.
Human Mesenchymal Stem Cells Modified by Hepatocyte Growth Factor Gene Promote Angiogenesis of Local Limb Ischemia in Rats
LIU Zikang1,JU Xingai2,Jin Jide2,QIN Yide1,GUO Zikuan2.
1 Department of Biochemistry and Molecular Biology,Anhui Medical University,Hefei 230032,China;2 Department of Experimental Hematology,Beijing Institute of Radiation Medicine,Beijing 100850,China.Corresponding authors:QIN Yide,GUO Zikuan.
ObjectiveTo evaluate the angiogenesis-promoting activities of human mesenchymal stem cells(hMSCs) modified by hepatocyte growth factor(HGF)in vivo and further investigate the underlying mechanisms.MethodsWistar rat limb ischemia model was developed by ligation of the right femoral artery.hMSC were infected by an adenoviral vector carrying human HGF cDNA.Aliquots of hMSC/Ad-HGF,hMSC or PBS were injected intramuscularly into the ischemic area of a rat limb ischemia model and 21 days later,laser Doppler perfusion imaging was performed to detect the blood flow of the limbs.Microvessel density(MVD)was evaluated by HE staining and immunohistochemistry on skeletal muscle sections.Evaluation of proliferation,migration and forming tube-like structures on ECV304 cells impacted by hMSC/Ad-HGF was determined by MTT,Transwell migration and tubercular structure formation assays.ResultsIn contrast to PBS,injection of hMSC/Ad-HGF and hMSC significantly improved the blood flow perfusion of the ischemic limbs.The relative means of the blood perfusion in hMSC/Ad-HGF-treated rats were comparable to those of the left legs and greater than those of hMSC-transplanted legs(P<0.05).The amounts of micro-vessels per high-fold field were highest in the hMSC/Ad-HGF-treated muscles,followed by those of PBS and hMSC,and all of them were greatly higher than those of normal controls(P<0.01).Thesupernatants of hMSC/Ad-HGF were shown to promote the proliferation of ECV304 cells and the stimulation activity was greater than that from recombinant human epithelial growth factor at a concentration of 20 ng/mL(P<0.001).In agreement, the conditioned medium of hMSC/Ad-HGF exhibited a greater activity than epithelial growth factor to enhance the transmembrane migration and tubercular structure formation of ECV304 cells.ConclusionHGF gene-modified human mesenchymal stem cells promote the proliferation,migration and vascular formation of endothelial cells,thus activating the angiogenesis process.
Mesenchymal stem cell;Hepatocyte growth factor;Angiogenesis;Gene transfer
Q813.1+1
A
1673-0364(2010)02-0061-05
2010年1月8日;
2010年1月29日)
10.3969/j.issn.1673-0364.2010.02.001
国家高科技研究发展计划项目(863项目)(2007AA02Z454);国家自然科学基金项目(30873018,30971068)。
230032安徽省合肥市安徽医科大学生物化学与分子生物学教研室(刘滋康,秦宜德);100850北京市军事医学科学院放射与辐射医学研究所实验血液学研究室(具星爱,靳继德,郭子宽)。
秦宜德,郭子宽。

