Wistar大鼠骨髓间充质干细胞的培养、鉴定和标记
赵科研 柳克祥 侯明晓 孙江滨 吴慧颖 李 博
(吉林大学第二医院心血管外科,吉林 长春 130041)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化潜能的非造血干细胞,可以向骨细胞、软骨细胞、脂肪细胞、干细胞、肌细胞、神经细胞以及心肌细胞分化〔1,2〕,具有高度可塑性,易于体外扩增,因其来源充足、取材方便,体外增殖能力相对较强,而且在异体移植中排斥反应小,被认为是组织工程和基因工程的理想种子细胞,为心血管疾病、神经疾病和骨关节疾病的治疗提供了一条全新的治疗方案。本文在总结贴壁分离法培养 MSCs的基础上,优化 MSCs纯化、鉴定、标记的方法,以获得稳定的培养体系,为应用组织工程技术提供大量的种子细胞。
1 材料与方法
1.1 动物 清洁级雄性 Wistar大鼠(3周鼠龄,60~70 g),吉林大学动物实验中心提供。
1.2 主要试剂和药品 低糖 DMEM培养基(Gibco公司),特级胎牛血清(Gibco公司),胰酶(Sigma公司),亚美尼亚仓鼠抗大鼠 CD29-Alexa Fluor(Biolegend公司),小鼠抗大鼠 CD45-过氧化物酶(FITC)(Biolegend公司),小鼠抗大鼠CD44-PE(Santa Cruz公司),小鼠抗大鼠 CD34-FITC(Santa Cruz公司),4-6二脒基-2-苯基吲哚(DAPI)储存液(Sigma公司)。
1.3 分离和培养 Wistar大鼠麻醉后处死,浸泡酒精 15 min,无菌条件下分离股骨、胫骨,无血清DMEM冲洗骨髓腔,取混悬液,1 000r/min离心 10min,弃上清液,沉淀含 10%胎牛血清的DMEM混悬,将获得的细胞接种在 100 ml培养瓶中,5%CO2,37℃下培养 24~48 h,换液,去除未贴壁细胞,2~3 d更换一次培养基,光镜观察细胞融合情况,细胞 80%融合后传代,0.25%胰酶消化,用血球计数仪计数细胞、传代,培养 3~5代细胞。
1.4 透射电镜样品制备 将培养 3代 10 cm2培养皿中约 2×106个细胞以磷酸盐缓冲液(PBS)洗涤 3次,再以 3%戊二醛4℃固定 1h,送电镜室,脱水包埋并制作超薄切片,行透射电镜观察并拍照。
1.5 MSCs表面标记物检测 0.25%胰酶消化收获第 3代细胞,收集 1×106个细胞,洗涤 1次,0~4℃预冷的 70%乙醇1ml边加入边摇匀,混匀后置于 4℃冰箱待进行细胞表面标记物检测。检测时以 1 ml PBS洗涤 2次,加含 10%山羊血清的 PBS常温孵育 10 min,1 000r/min离心 5min去上清,与饱和浓度的CD29-Alexa Fluor、CD34-FITC、CD44-PE、CD45-FITC单克隆抗体及其同型对照混匀,室温下闭光反应 30 min,PBS洗涤细胞,置于冰上,行流式细胞仪检测。
1.6 MSCs标记 将无菌的 DAPI储存液加入培养的 MSCs爬片上清中,至终浓度为 50 mg/L,37℃孵育染色至少 30 min。细胞至少用 Hanks平衡盐溶液冲洗 6遍以除去未结合的DAPI。荧光显微镜下观察细胞爬片。
2 结 果
2.1 MSCs相差显微镜观察细胞形态 骨髓细胞接种于培养瓶后,约 6~8 h可见 MSCs细胞贴壁,呈圆形或多角形,换液后,贴壁细胞清晰可见,2~3 d后可见少量短梭形、星形细胞分散贴壁生长,伸出伪足呈逗点状或短棒状;6 d左右可见放射状排列的细胞集落,伸出长短不一、粗细不均的突起、胞核大、核仁清晰。约 14d细胞融合 80%~90%,呈漩涡状。传代细胞比原代细胞贴壁快,24 h内已全部贴壁、伸展,增殖迅速,均匀分布生长,3~4 d可见长梭形细胞80%~90%铺满培养皿形成单层。见图 1。
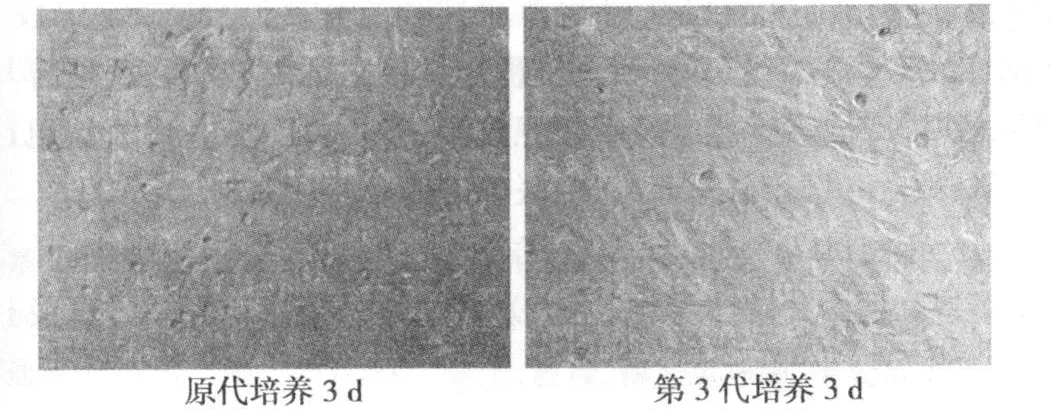
图1 相差显微镜下 MSCs形态(×100)
2.2 MSCs的超微结构 大鼠MSCs胞质较丰富,可见较多的细胞器,如线粒体、粗面内质网和高尔基复合体等,细胞核呈圆形或椭圆形,也可见不规则形核,核染色质较疏松。可见明显核仁,多为 1~2个。有的表面可见较多的微绒毛。见图 2。
2.3 MSCs的鉴定及标记 第 3代细胞表面标记物 CD29、CD44、CD34和 CD45的阳性率分别为 98.6%、78.2%、0.0%、0.3%。见图 3。细胞经 DAPI标记后,细胞核呈蓝色。见图 4。
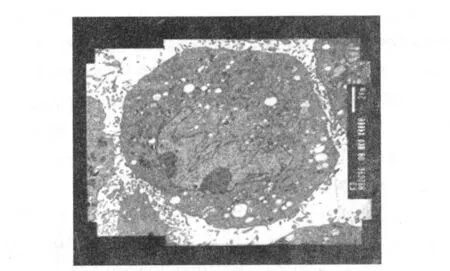
图2 MSCs第 3代超微结构(×4 000)
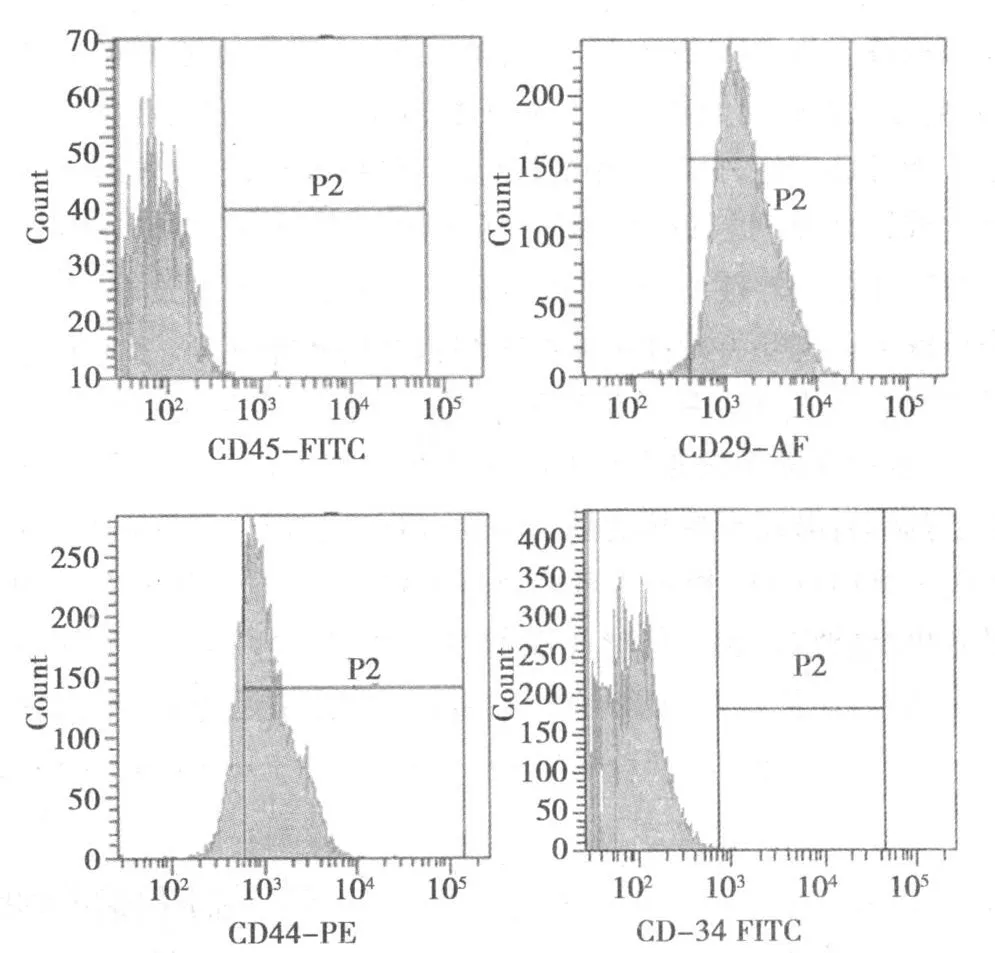
图3 M SCs第 3代细胞表面标记物表达

图4 MSCs第 3代细胞 DAPI标记
3 讨 论
由于骨髓的细胞组成复杂,细胞功能各异,其中MSCs含量很低,约为骨髓低密度组分中有核细胞的 0.001% ~0.01%〔3〕,故分离高纯度的 MSCs是原代培养关键性技术。目前,获得MSCs的方法主要有贴壁筛选法、密度梯度离心法、流式细胞仪分离法、免疫磁珠分选法〔4〕。而骨髓贴壁法操作步骤简单,既降低了离心对细胞的损害,又减少了污染机会,且分离的MSCs贴壁时间短,增殖快,细胞数量多,经传代后能够纯化,提示全骨髓贴壁法是一种更加简单有效的MSCs分离方法。
一般认为,间充质干细胞没有特异性表面抗原,整合素家族成员 CD29、黏附分子 CD44、CD166、CD105等是 MSCs的重要标志物〔5〕,而 MSCs不表达造血细胞表面抗原,如造血前体细胞标志抗原 CD34、成熟造血细胞标志抗原 CD38、白细胞标志抗原 CD45、淋巴细胞表面抗原 CD11a和单核细胞/巨噬细胞表面抗原 CD14。因此,实验选取 MSCs表达阳性的指标 CD29、CD44,以及表达阴性的指标 CD34和 CD45作为鉴定参考指标〔2,6〕。本研究选择了 CD29、CD34、CD44和 CD45进行检测,结果表明培养的细胞 CD29和 CD44阳性,CD34和CD45阴性,符合 MSCs的特点,经过传代,第三代可获得较高纯度的 MSCs,可以作为稳定的种子细胞进行体内研究。
DAPI是一种能够与 DNA强力结合的荧光染料,常用于荧光显微镜观测。DAPI对活细胞无毒性,不改变细胞器的超微结构,荧光保持时间较长。移植细胞的标记是研究其在体内的定位不可缺少的,目前常用的标记法有DAPI标记法、溴脱氧尿嘧啶核苷(BrdU)标记法、染色体标记法、基因标记法。BrdU法存在只能标记增殖期细胞,且标记细胞不能直接观察等不足。染色体标记主要将雄性供体动物细胞移植到雌性动物体内,通过 Y染色体杂交区别确认移植细胞。其优点在于可以终生标记,但也存在操作繁琐,无法观察活细胞等不足。基因标记法通过基因转染或直接从转基因动物取材,使被标记细胞携带绿色荧光蛋白(GFP)暼报告基因。但目前,实现报告基因在目的细胞中高效稳定表达仍然存在程序繁琐、实验周期长、成功率低等困难,而从转基因动物取材又因为动物来源困难,在国内较少开展〔7〕。本研究表明,DAPI起初标记率很高(接近100%),1 w内可维持 80%~90%标记率。但随着标记时间的延长,其标记效率迅速下降,3 w以后绝大多数细胞失去标记。
本实验完善贴壁法建立 Wistar大鼠MSCs培养体系,经鉴定细胞纯度高,可以为体内移植提供大量的种子细胞。采用DAPI进行细胞标记后,荧光显微镜下见所有MSCs均已被标记蓝色荧光,提示 DAPI标记法敏感性好,标记效率高,可应用进行体内细胞移植的良好标记。
1 Gnecchi M.Melo LG.Bone marrow-derived mesenchymal stem cells:Isolation,expansion,characterization,viral transduction,and production of conditioned medium〔J〕.Methods Mol Bol,2009;482:281-94.
2 杨 丽,张荣华,谢厚杰,等.建立大鼠骨髓间充质干细胞稳定分离培养体系与鉴定〔J〕.中国组织工程研究与临床康复,2009;13(6):1064-8.
3 Wakitani S,Saito T,Caplan AL.Myogenic cells derived from rat bone marrow mesenchymal stem cells exposed to 5-azacytidine〔J〕.Muscle Nerve,1995;18:1417-26.
4 赖平平,韩春茂,岑航辉,等.骨髓间充质干细胞的分离培养和生物学性状〔J〕.浙江医学,2004;26(5):328-30.
5 De Ugarte DA,Alfonso Z,Zuk PA,et al.Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow〔J〕.Immunol Lett,2003;89(2-3):267-70.
6 Shahdadfar A,Fronsdal K,Haug T,et al.In vitro expansion of human mesenchymal stem cells:choiceof serum is a determinant of cell proliferation,differentiation,gene expression,and transcriptome stability〔J〕.Stem Cells,2005;23(9):1357-66.
7 李玉玲,唐俊明,潘国栋,等.DAPI标记的骨髓间充质干细胞体内外示踪实验研究〔J〕.郧阳医学院学报,2005;24(5):257-9.

