川芎嗪抑制大鼠局灶性脑缺血损伤神经元凋亡的作用
柳朝阳 孙 鹏 苗 志 张 涛 王建杰
(佳木斯大学附属第一医院,黑龙江 佳木斯 154007)
川芎嗪为中药川芎的有效成分,化学结构为四甲基吡嗪(tetramethylpyrazine,TMP),在体内吸收后,能有效透过血脑屏障,并广泛分布大脑皮层、脑干、纹状体、海马、小脑和中脑等部位。近十几年来,TMP扩张血管的机制已有许多研究〔1〕。本研究采用川芎嗪干预大鼠大脑中动脉局灶性脑缺血(MCAO)模型,动态观察神经细胞的形态改变以及 bcl-2蛋白表达情况,探讨川芎嗪对局灶性脑缺血损伤神经保护的机制。
1 材料与方法
1.1 药品及试剂 川芎嗪注射液 40 mg/2 ml(北京第四制药有限公司生产,批号 20060701),TUNEL染色试剂盒及 bcl-2蛋白免疫组化染色试剂盒购于武汉博士德生物工程有限公司。
1.2 动物分组及模型制备 成年健康雄性 Wistar大鼠 36只,参照 Longa等〔2〕的大脑中动脉线栓法制作大鼠大脑中动脉栓塞模型。缺血 2 h后,将栓线向外轻轻拉出,恢复供血,形成再灌注。手术动物清醒后,出现左侧 Horner征、右侧前肢肢体无力、肌张力降低则提示 MCAO模型制作成功。模型制作成功后,按照随机原则,首先分为缺血再灌注组(18只)和川芎嗪治疗组(18只),两组在脑缺血 2 h后再灌注 6、12、24 h共 3个时间点各分为 3个亚组,每组 6只大鼠。治疗组大鼠在 MCAO模型制备成功后分别腹腔注射川芎嗪 40 mg/kg;缺血组在相同时间点均腹腔注射等量生理盐水。
1.3 标本制备 再灌注后相应时间点对各组模型动物以2ml 10%水合氯醛腹腔注射麻醉至深度昏迷,迅速开胸暴露心脏,以 100 ml肝素生理盐水经主动脉弓快速灌注冲洗,随后以 4%多聚甲醛 PBS缓冲液(4℃,p H7.4)经主动脉弓灌注 30 min。迅速取脑,冠状切开脑组织,取视交叉前后约 0.5 mm处的组织,置于上述固定液中 24 h。常规石蜡包埋,于视交叉处连续冠状切片,片厚 5μm,切片置于 4℃保存备用。
1.4 TUNEL染色检测原位细胞凋亡 取已制备好的石蜡切片常规脱蜡、脱水、双氧水处理、蒸馏水洗涤后严格按照说明书逐步进行,使用DAB显色试剂盒,着棕黄色为阳性细胞。
1.5 免疫组化染色检测 bcl-2蛋白表达 严格按照试剂盒说明书逐步进行操作,胞质呈棕黄色或棕褐色为阳性细胞。
1.6 镜下观察 400倍光学显微镜下每张切片随机观察 5个不重叠视野,计数阳性细胞数,取平均值。
1.7 统计学处理 所有实验数据均用 x±s表示,采用 SPSS 11.0统计软件进行方差分析和t检验。
2 结 果
2.1 TUNEL染色原位细胞凋亡检测结果 见表 1和图 1。随着再灌注时间的增加,缺血再灌注组凋亡细胞逐渐增多(P<0.05);再灌注各时间点,与缺血再灌注组相比,川芎嗪治疗组凋亡细胞数明显减少 (P<0.01)。
2.2 免疫组化染色检测 bcl-2表达情况 见表 2和图 2。随着再灌注时间的增加,缺血再灌注组 bcl-2阳性细胞逐渐减少(P<0.05);再灌注各时间点,与缺血再灌注组相比,川芎嗪治疗组 bcl-2阳性细胞数明显增加(P<0.05)。
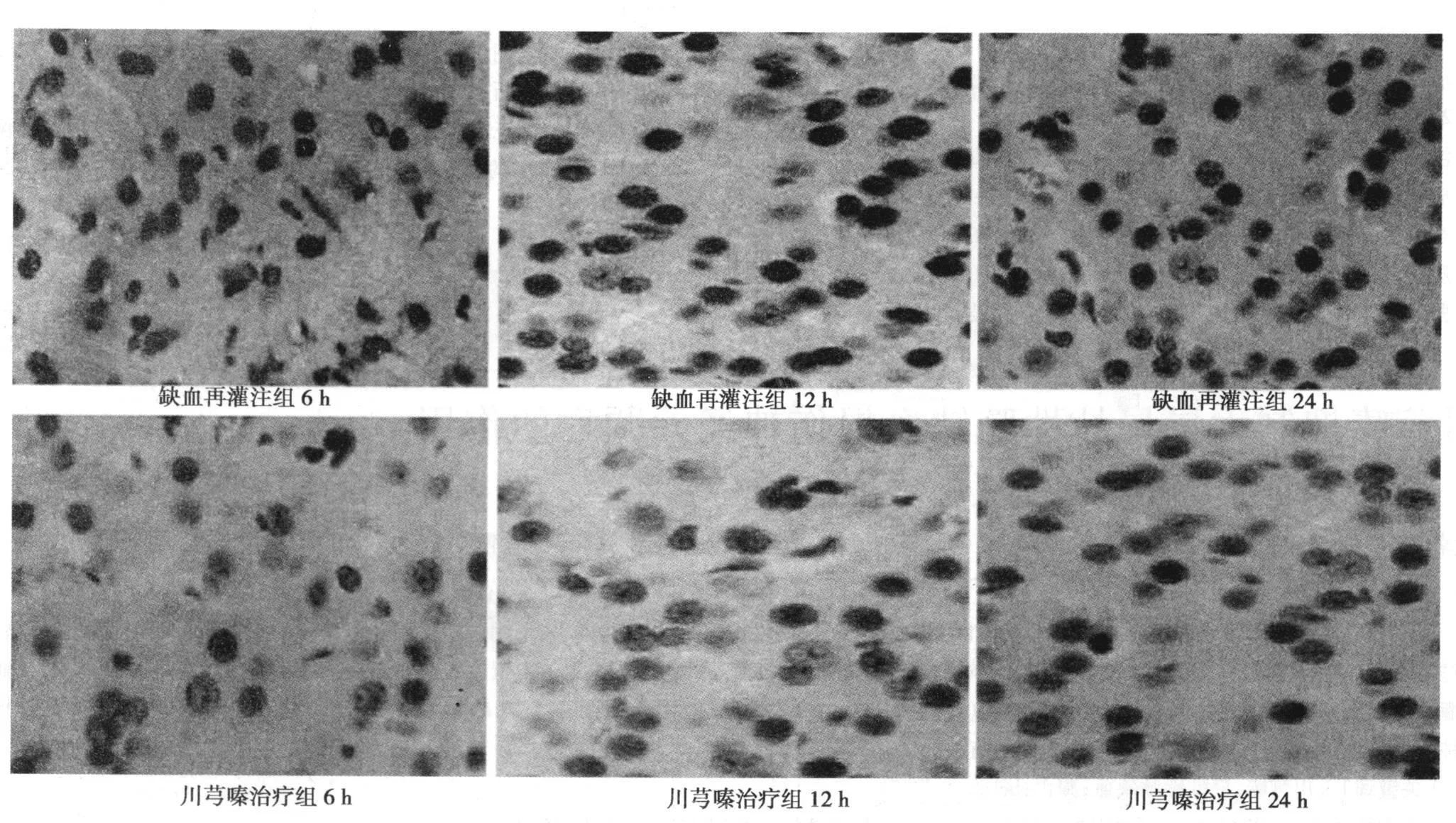
图1 实验各组TUNEL染色凋亡细胞表达情况(DAB,×400)

图2 实验各组bcl-2蛋白表达情况(DAB,×400)

表1 各组凋亡细胞表达(个/高倍镜视野,x±s,n=6)

表2 各组 bcl-2蛋白表达(个/高倍镜视野,x±s,n=6)
3 讨 论
缺血再灌注损伤的神经保护是目前国内外研究的热点。急性缺血性脑梗死的治疗主要是溶栓和神经保护相结合。溶栓在治疗疾病的同时,也不可避免地引起再灌注损伤。如何最大限度减少再灌注损伤,更好地保护已经受损的神经细胞成为急需解决的问题。寻找研发一种有效、平稳、安全的神经保护药物为解决这一问题提供了契机。以往的神经保护药物作用机制/靶点单一、副作用大、价格昂贵等原因,限制了其在临床的应用。祖国的传统医学具有整体观念的特点,中药又具有复方特征,可以作用于多靶点,而且中药来源广泛、价格低廉。鉴于此,越来越多的研究者把目光投向了传统中药。
细胞凋亡是缺血后神经细胞丢失的一种主要形式,但有关脑缺血后细胞凋亡的确切机制尚不清楚。研究表明,细胞凋亡过程受多种基因调控,其中原癌基因 bcl-2是调节细胞凋亡的最基本成员,被认为是能特异性抑制细胞凋亡发生的抗凋亡基因。bcl-2蛋白为 26 k D的细胞内膜蛋白,定位于内质网膜、线粒体膜和核膜。体内外实验均表明,bcl-2蛋白能抑制多种因素诱发的细胞凋亡。腺病毒介导的bcl-2高表达可阻止或延缓各种刺激诱导的神经元死亡〔3〕。肿瘤坏死因子(TNF)、环己酞亚胺(cycolhxeimide)都可通过诱导 bcl-2表达对抗缺氧 NO诱发的神经元凋亡。由此可见,bcl-2表达水平可能是调节神经元存活的主要因素。Martinou等用转基因技术使小鼠神经元内 bcl-2过度表达,梗死灶减少了 50%,证实了 bcl-2具有神经元保护作用〔4〕。最近研究发现 bcl-2转染到梗死周围区域能够阻断核凋亡诱导因子的转位,从而提高皮层神经元的存活〔5〕。
bcl-2作为细胞凋亡调节网络中最重要的蛋白,影响或被影响着其他细胞凋亡相关基因和分子,如 TGF-β、Hsp 70、ICE、Myc及 p53等。bcl-2表达具有多种生理活性,可以阻止或降低射线、自由基、化学药物等引起的细胞凋亡,对氧化损伤造成的细胞凋亡具有肯定的抑制作用。其抗凋亡的机制迄今仍不是很清楚。但多数研究者认为:①bcl-2发挥抗凋亡作用主要是直接对抗各种脂质的过氧化反应〔6〕;②抑制线粒体释放促凋亡蛋白质,如细胞色素 c和凋亡诱导因子〔7〕,目前认为,bcl-2减少缺血后神经元的丢失主要是通过阻断细胞色素 C的释放和 caspase-3的活化来加以实现的〔8〕;③抑制 Bax,bcl-xs等促凋亡基因作用的发挥;④抑制富含半胱氨酸蛋白酶的激活〔9〕;⑤bcl-2过度表达可直接或间接引起线粒体膜的超极化,以维持细胞内钙离子的稳态。在凋亡过程中,凋亡蛋白酶发挥着与核酸内切酶同样重要的作用。而位于线粒体膜的 bcl-2蛋白可阻止细胞色素C和APaf的相互作用从而使凋亡蛋白酶激活受阻,因而可阻止细胞色素 C介导的细胞凋亡〔10,11〕。本实验结果显示,脑缺血再灌注损伤可导致神经元凋亡,随着再灌注时间的增加凋亡细胞逐渐增多,再灌注各时间点,与缺血再灌注组相比,川芎嗪治疗组凋亡细胞数明显减少;脑缺血再灌注神经元中 bcl-2蛋白阳性细胞结构清晰、形态基本正常;再灌注各时间点,川芎嗪治疗组bcl-2蛋白阳性细胞数明显多于再灌注缺血对照组,提示川芎嗪能抑制脑缺血再灌注损伤导致的神经元凋亡。其机制可能是通过增加脑缺血再灌注损伤神经元 bcl-2蛋白表达,从而对脑缺血损伤发挥保护作用。
川芎嗪是一种临床治疗药物,与其他实验药物相比较,其临床试验相对安全易于开展,研究前景较为乐观。但其对脑缺血再灌注损伤的其他保护机制及最佳治疗剂量、有效治疗时间窗等问题尚待进一步研究。
1 杨光田,李树生,邓普珍 .实验动物复苏及低氧时川芎嗪对心脑的作用〔J〕.中国急救医学,1997;17(1):7.
2 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
3 Tabira T.Singifieance of intraeellular a beta in Alzheimer′s disease〔J〕.Nihon Shinkei Seishin Yakurigaku Zasshi,2002;22(5):175-80.
4 Hossmann KA.Viability thresholds and the penumbra of focal ischemia〔J〕.Annals Neurol,1994;36(4):557-65.
5 Mies G,Iijima T,Hossmann KA.Correlation between peri-infarct DC shifts andischemic neuronal damage in rat〔J〕.Neuroreport,1993;4(6):709-11.
6 Makresbery WR,Lovell MA.Four-hydroxynonenal,a product of lipid peorxidation,is increased in the brain in Alzheimer′s disease〔J〕.Neurobiol Aging,1998;19l:33-6.
7 Ahn YH,Koh JY,Hong SH.Protein synthesis-de pendent but bcl-2-independent cytochrome Creleasec in zin-c depletion-induced neuronal apoptosis〔J〕.JNeurosci Res,2000;61(5):508-14.
8 李 军,曾邦雄 .脑缺血损伤级联反应的研究进展〔J〕.国外医学◦麻醉学与复苏分册,2001;22(6):364-8.
9 王巧稚,刘广益,郭 勇 .淀粉样前体蛋白与阿尔茨海默病神经细胞凋亡的关系〔J〕.四川解剖学杂志,2003;11(2):32-4.
10 Nakatsuka H,Ohta S,Tanaka J,et al.Cytochrome release from mitochondria tothe cytosol was suppressed in the ischemia-tolerance-induced hippocampal CAI region after 5-min forebrain ischemia in gerbils〔J〕.Neurosci Lett,2000;278(1-2):53-6.
11 Antonwaieh FJ.Translocation of cytochrome c following transient global ischemia in the gerbil〔J〕.J Neurosci Lett,1999;274(2):123-6.

