双酚A在聚茜素红/碳纳米管电极上的伏安行为
杨 平,李兰芳,蔡 惠,金士威,万其进
(武汉工程大学化工与制药学院,绿色化工过程省部共建教育部重点实验室,湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉430074)
0 引 言
双酚A(BPA)是一种重要的化工原料,被广泛用于生产聚碳酸酯塑料和环氧树脂,也常作为塑料制品的抗氧化剂.双酚A属于有毒有害的有机污染物,具有致癌、致畸、致突变的潜在毒性.近年来,已有研究报道BPA是一种雌性环境激素,即使痕量的BPA也会对人类的生殖及后代生存能力产生负面影响[1],因此,建立一种快速、灵敏、简便、准确的测定BPA的方法非常有意义.
已经报道的BPA的检测方法有气相色谱—质谱(GC-MS)法、液相色谱法、荧光法、极谱法及酶联免疫吸附法(ELISA)等[2-8],但这些方法大都仪器昂贵,且前处理复杂.相比于上述方法,电化学方法[9]具有仪器简单、选择性好、灵敏度高等优点.用碳纳米管修饰电极检测塑料和水样中的BPA已有报道[10-11],但使用聚茜素红/碳纳米管修饰电极研究BPA的催化过程还尚未见文献报道.
本研究将碳纳米管分散于水中,取适量分散液滴涂于电极表面,干燥后置于一定浓度的茜素红溶液中电聚合制得聚茜素红/碳纳米管修饰电极(PAR/MWCNTs/GCE),用循环伏安法研究了BPA在磷酸盐缓冲溶液中的电化学行为,并对一系列浓度的BPA进行了电化学测定,得到了较好的实验结果.该修饰电极有望用于实际污水中双酚A含量的测定.
1 实验部分
1.1 仪器与试剂
CHI760B电化学工作站(上海辰华仪器公司);CSB6L—80D型超声波清洗器(天津市考德斯科技有限公司);ALC—210.3型电子天平(北京赛多利斯仪器系统有限公司);工作电极:玻碳电极(Φ=3 mm)或复合修饰电极;对电极:铂丝电极;参比电极:饱和甘汞电极(SCE).
多壁碳纳米管MWCNTs纯度95%(深圳纳米港);磷酸盐缓冲液:Na2HPO4溶液+KH2PO4溶液配制成不同pH值的缓冲溶液;K3Fe(CN)6溶液:0.02 mol/L;高纯氮气(武钢气体公司);茜素红(AR)(北京红星化工厂)配制成1.0×10-3mol/L水溶液,避光保存.其它试剂均为分析纯,实验用水均为超纯水;实验均是在室温下进行.
1.2 复合修饰电极的制备
1.2.1 碳纳米管修饰电极的制备 将1 mg羧基化碳纳米管超声分散于1 mL超纯水中,得到黑色悬浊液,然后用微量进样器取5 μL多壁碳纳米管分散液滴涂在预处理好的玻碳电极表面,室温下晾干,即得到碳纳米管修饰电极.
1.2.2 聚茜素红/碳纳米管修饰电极的制备 分别取2 mL 1.0×10-3mol/L茜素红与pH=6.8的磷酸盐缓冲溶液,将MWCNTs/GCE电极置于其中,接通三电极系统并与仪器连接,于-1.4~+1.8 V电位范围内,以100 mV/s的扫速循环扫描10圈,所得即为PAR /MWCNTs/GCE修饰电极.
2 结果与讨论
2.1 PAR/MWCNTs/GCE交流阻抗特性
用交流阻抗法分别对裸玻碳电极和PAR/MWCNTs/GCE进行了表征.如图1所示,在选定的频率范围内,裸玻碳电极上探针[Fe(CN)6]3-/4-的阻抗谱图基本是一条直线,这说明了[Fe(CN)6]3-/4-非常容易到达电极表面发生反应,电化学反应较快,电极上不存在阻挡电子传递的物质.而在PAR/MWCNTs/GCE上,探针[Fe(CN)6]3-/4-的阻抗谱图在高频部分出现半圆,而在低频区得到近似直线,说明复合膜的形成部分地阻碍了电子的传递,由于膜内的针孔缺陷,探针分子可以通过它到达电极表面.
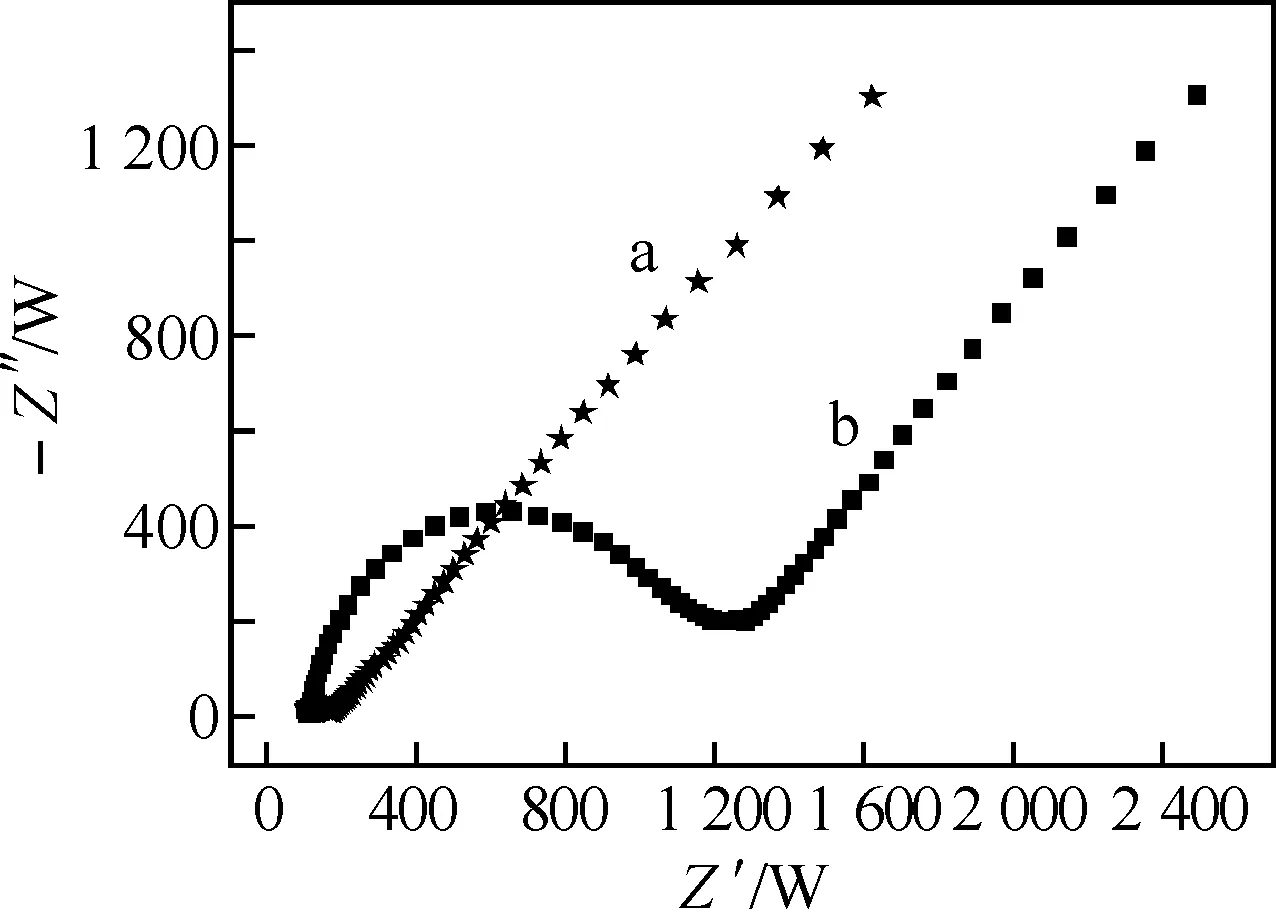
图1 电极(a)和PAR/MWCNTs/GCE(b)的交流阻抗图
2.2 双酚A在不同电极上的电化学行为
图2为在含1.0×10-4mol/L对双酚A的磷酸缓冲溶液(pH=6.2)中,用不同的电极获得的循环伏安图.由图可见,双酚A在裸电极上可能过电位较高,在扫描电位范围内没有任何响应.然而,它在聚茜素红/碳纳米管复合修饰电极上于0.55 V处出现了一个较强的不可逆氧化峰,表明复合修饰电极对双酚A具有很好的电催化氧化作用.
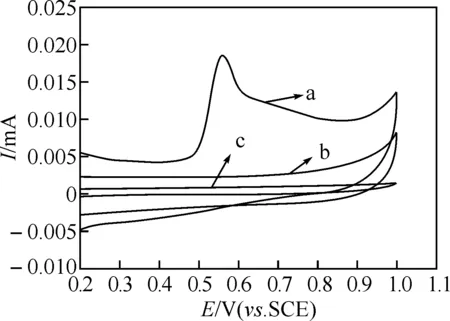
图2 1.0×10-4 mol/L BPA在PAR/MWCNTs/GCE(a)和裸电极(b)上的伏安图,及PAR/MWCNTs/GCE在底液中(c)的循环伏安图
2.3 最佳实验条件的选择
2.3.1 聚茜素红/碳纳米管修饰电极制备条件的选择a. 聚茜素红膜厚度的选择.膜的厚度对电极的性能也有很大的影响.在电聚合时,不同的扫描圈数可以得到不同厚度的修饰膜.较厚的膜可以排除干扰,但是对被分析物的响应不敏感,而且增加了聚合时间降低了效率.对于聚茜素红/碳纳米管修饰电极膜厚的选择是基于电极的两点性质:一是确保电极膜有一定的厚度,这样才能确保电活性物质的催化氧化;二是电极膜的导电性,膜过厚电子不易通过,不能获得较高的峰电流.
通过记录PAR/MWCNTs/GCE在1.0×10-4mol/L AR中的电流响应,考察了峰电流与聚合圈数的关系,如图3所示.
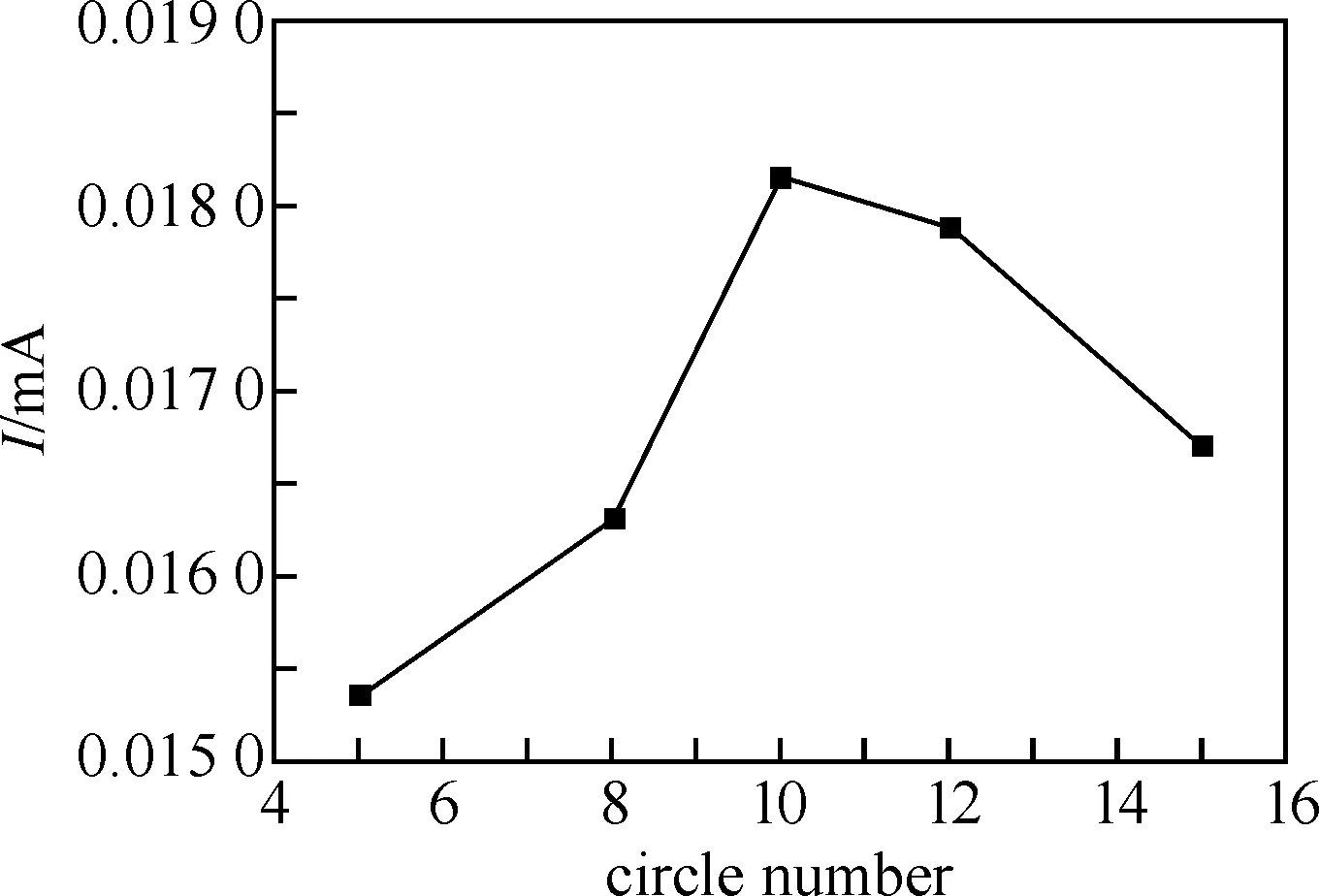
图3 峰电流与聚合圈数的关系
实验结果表明,在一定的条件下,电聚合圈数较少时,聚合物修饰电极对双酚A的响应电流也较小,当电聚合圈数为10圈时,修饰电极对双酚A的响应电流达到最大值,这是由于随着扫描圈数的增加,在电极表面聚合的茜素红越多,相应的活性位点持续增加,使其对目标物质的响应电流增大;修饰电极电聚合超过10圈后,修饰电极对双酚A的响应电流下降,这是由于膜厚增加,电子在膜中阻力变大,催化效果降低,导致响应电流降低.故本实验选用电聚合扫描圈数为10圈.
b. 碳纳米管滴涂量的选择.在其它实验条件不变的情况下,在裸电极表面分别滴涂不同量的碳纳米管悬浮液,当悬浮液的体积从3、4、5、6、7、8 μL(1 mg/mL)变化时,氧化峰电流先增大后减小,如图4所示.这可能是由于碳纳米管松散地堆积在电极表面,其堆积量愈大则电阻愈大,故导致导电性变差.为了控制峰电流和空白电流的大小,选择碳纳米管的滴涂量为5 μL.
2.3.2 支持电解质及pH值的选择 实验比较了双酚A在相同pH值的不同缓冲溶液如NaAc-HAc缓冲溶液、磷酸盐缓冲溶液、柠檬酸钠-HCl缓冲溶液中的电化学行为,发现双酚A在0.2 mol/L磷酸盐缓冲溶液中氧化峰形较好,峰电流较高.
配制pH5.8~8.0范围的磷酸缓冲溶液,研究在扫速为100 mV/s时BPA的电化学行为随pH值的变化情况(如图5A).实验发现当磷酸盐缓冲液的pH值为6.2时,BPA显示出良好的电化学活性,峰形好且峰电流大,故选定本实验的底液pH值为6.2.
由循环伏安图可知氧化峰电位随pH增大有一定的负移,且峰电位的移动与pH值的变化呈线性关系(图5B),线性方程为:Ep(V)=0.900 3-0.054 39 pH,R=0.998 1,表明该过程有质子参加反应.
2.3.3 扫速的影响 在最佳实验条件下,将聚茜素红/碳纳米管复合修饰电极置于1.0×10-4mol/L BPA中,研究了BPA在不同扫描速率下的循环伏安行为(如图6A)从图中可以看出,在扫速为0.02 ~ 0.12 V/s范围内,双酚A在聚茜素红/碳纳米管修饰电极上的峰电流和峰电位明显随着扫速的增大而增大.并且在该范围内,峰电流与扫速的平方根呈现良好的线性关系(如图6B).线性回归方程为:ipa=0.001 51v1/2-0.003 75,R=0.995 6.表明双酚A在聚茜素红/碳纳米管修饰电极//溶液界面上的扩散为电极反应的控制步骤.
2.3.4 线性范围和检出限 图7A在pH=6.2的磷酸缓冲溶液为底液的条件下,聚茜素红/碳纳米管修饰电极对不同浓度的双酚A溶液的循环伏安图.在5.0×10-7~1.0×10-5mol/L浓度范围内,双酚A的氧化峰电流与其浓度有良好的线性关系(图7B).对应的线性回归方程是:ipa=0.002 08+0.116 55c;相关系数R=0.999 7;检测限可达5.0×10-8mol/L.
2.3.5 稳定性和重现性 使用聚茜素红/碳纳米管修饰电极平行测定10次1×10-4mol/L的双酚A溶液,峰电流基本稳定,其相对标准偏差为3.6%,由此可以说明体系的重现性良好.对比新制备的聚茜素红/碳纳米管修饰电极,使用在超纯水中放置一周后的电极测定同一浓度的双酚A溶液,其峰电流无明显变化,表明聚茜素红/碳纳米管修饰电极具有较长的使用寿命和良好的稳定性,可以用于实际样品的分析测定.
2.3.6 干扰实验 本实验考察了一些废水中常见的离子对双酚A的测定的影响,100倍的Cu2+、Pb2+、Sn2+等离子及邻苯二酚对双酚A的测定不造成干扰.
2.3.7 模拟环境水样的测定 配制不同浓度双酚A的模拟废水,用PAR/MWCNTs/GCE在0.2~1.0 V电位范围内、100 mV/s扫速下测量峰电流,用加标回收法获得模拟废水中双酚A含量,平行测定三次,结果见表1.由表可见,测定双酚A的回收率在96.3%~102.8%之间,相对标准偏差在2.3%~3.3%范围内.

图6 (A)扫描速度对PAR/MWCNTs/GCE在1.0×10-4 mol/L BPA中循环伏安图的影响;(B)为峰电流与扫描速度的关系

图7 (A)不同浓度的BPA在PAR/MWCNTs/GCE上的循环伏安图;(B)峰电流和BPA浓度的关系
表1不同浓度的双酚A混合溶液的回收率
Table 1 Recoveries of bisphenol A with different concentrations

样号原始量/(1×10-6 mol/L)加入量/(1×10-6 mol/L)测得量/(1×10-6 mol/L)回收率/%相对标准偏差/%13.41.04.397.32.52.05.5102.83.04.07.399.22.624.41.05.296.32.32.06.398.33.34.08.5101.22.6
参考文献:
[1]LI Wen, SEIFERT M, XU Ying, et al. Comparative study of estrogenic potencies of estradiol,tamoxifen, bisphenol—Aand resveratrol with two in vitro bioassays[J].Environ Int,2004,30(3):329-335.
[2]王玉飞,陈衡平,陈晖.桶装饮用水中双酚A的溶出及GC/MS分析[J].中国卫生检验杂志,2003,13(5):581-582.
[3]YOSHIDA T,HORIE M,HOSHINO Y,et a1.Determination of bisphenol A in canned vegetables and fruit by high performance liquid chromatography[J].Food Addit Contam,2001,18(1):69-75.
[4]刘晓燕,张海霞,刘满仓.酚类环境雌激素的色谱分析方法[J].分析测试学报,2007,26(2):288-294.
[5]余宇燕,庄惠生,沙玫,等.荧光法测定食品包装材料中的双酚A[J].分析测试学报,2006,25(5):99-101.
[6]唐舒稚,庄惠生.荧光法测定水中双酚A残留的研究[J].工业水处理,2006,26(3):74-76.
[7]张文德,马志东,郭忠.食品包装材料中双酚A的极谱测定[J].分析化学,2003,31(2):249.
[8]孙仕萍,马志东,张文德.单扫示波极谱法测定食品包装材料中双酚A的研究[J].分析科学学报,2002,18(6):490-492.
[9]李江,李容,李永强,等.BPA在Na—MMT—CMC/GCE修饰电极上的电化学行为与检测[J].分析测试学报,2008,27(7):766-768.
[10]刘秋香,陈艳玲,梁艳,等.双酚A在壳聚糖—FC—134—碳纳米管修饰电极上的电化学行为及其测定[J].分析科学学报,2007,23(6):701-704.
[11]何琼,常艳兵,张承聪.双酚A在多壁碳纳米修饰电极上电化学性质及其测定研究[J].云南大学学报:自然科学版,2004,26(1):70-74.

