HPLC法测定自发性高血压大鼠血浆中去甲肾上腺素的含量Δ
梁秋云,黄慧学,刘华钢,蒙华琳
(1.广西医科大学,南宁市 530021;2.广西中医学院,南宁市 530021;3.广西柳州医学高等专科学校,柳州市 545006)
去甲肾上腺素(NA)是重要的单胺类递质,测定其血浆浓度可为高血压、帕金森氏病、甲亢、嗜铬细胞瘤和神经母细胞瘤等诊断定位提供依据[1]。国内、外测定血浆中NA含量报道的方法主要有高效液相色谱(HPLC)-电化学检测法、HPLC-荧光法及毛细管电泳法等[1~3],但大部分方法的样品处理较复杂,对仪器设备的要求较高或灵敏度低;紫外检测器是HPLC最常配备的检测器,应用范围广,目前还未见采用HPLC-紫外检测(UV)法测定血浆中NA的报道。本实验以可能具有高血压治疗作用的多糖为模拟药物,同时设立阳性对照药卡托普利片,建立HPLC-UV法测定自发性高血压大鼠(SHR)血浆中NA含量的方法,为临床诊断和基础研究提供一种快速、简便、准确测定血浆中NA的含量测定方法。
1 材料
HPLC仪,包括2487紫外可见检测器、柱温箱、Breeze3.3工作站(美国沃特斯公司);C18色谱柱(大连依利特分析仪器有限公司);TGL-16C高速微量离心机(上海安亭科学仪器厂);751型紫分光光度计(上海分析仪器总厂)。
仙人掌果采于广西北海涠洲岛,经广西中医药研究院赖茂祥研究员鉴定为仙人掌Opuntia dillenii(Ker.-Gawl.)Haw.植物的果实。仙人掌果多糖(CPFP)由上述仙人掌果经本课题项目组提取、纯化制得(多糖含量大于70%);NA对照品(瑞士Fluka公司,批号:2002298,纯度:≥98%);阳性对照药卡托普利片(汕头金石制药总厂,批号:070311,规格:每片25 mg);甲醇为色谱纯,水为去离子重蒸水,其余试剂均为分析纯。
SHR,♂,12周龄,体质量(220±50)g,由上海斯莱克实验动物有限责任公司提供,合格证号:SCXK(沪)2003-0003;同龄♂Wistar大鼠由广西医科大学实验动物中心提供,合格证号:SCXK桂2003-0003。
2 方法与结果
2.1 色谱条件
色谱柱:C18(250 mm×4.0 mm,5 μm);流动相:甲醇-0.15 mol·L-1磷酸二氢钾缓冲液(1∶9,V/V,pH=6.0);柱温:室温;流速:1.0 mL·min-1;检测波长:280 nm。
2.2 给药、分组及血样处理
SHR随机分为5组:CPFP高、中、低剂量组和阳性对照药组、模型组,每组10只,另取正常血压的Wistar大鼠10只为正常对照组。CPFP高、中、低剂量组分别ig 2.37、1.58、0.76 g·kg-1·d-1(剂量由预试验确定)CPFP;阳性对照药组ig 10 mg·kg-1·d-1(剂量由临床给药剂量确定)卡托普利,正常对照组及模型组ig无菌注射用水,各组大鼠每天给药1次,连续9周。9周末自腹主动脉取血,血样收集于1.5 mL肝素离心管中,及时于4 ℃、2000 r·min-1离心,取血浆100 μL,加0.05 mol·L-1高氯酸200 μL,10000 r·min-1离心2 min,取上清液置于-20 ℃冰箱中待测。
2.3 方法专属性
取阴性溶液(流动相)、0.05 mol·L-1高氯酸溶解的NA对照品溶液和给药9周后的血浆样品处理溶液进样,色谱见图1。

图1 SHR血浆样品中NA的HPLC色谱图A.阴性溶液;B.对照品;C.血浆样品;1.NAFig 1 HPLC chromatograms of NAin plasma of SHRA.negative solution;B.standard substance;C.plasma sample;1.NA
在选定的色谱条件下,NA峰形良好,分离完全,其保留时间为3.05 min;以NA计算理论塔板数不小于3000;其它内源性物质基本不干扰测定。
2.4 线性范围和最低检测限
取干燥至恒重的NA对照品适量,精密称定,用0.05 mol·L-1高氯酸溶解并分别稀释成0.5 g·L-1的对照品贮备液。
精密吸取贮备液1、20、40、60、80 μL,分别稀释为0.5、10、20、30、40 µg·L-1,以浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线并进行线性回归,得回归方程为Y=271906X-14910(r=0.9999)。以3倍信噪比计算出NA检测限为0.05µg·L-1。
2.5 精密度及稳定性试验
取“2.2”项下其中1份血样,分别于同日内重复测定5次,求得日内精密度;每日2次,重复测5 d,求得日间精密度。结果,日内精密度的RSD=2.15%,日间精密度的RSD=3.81%,表明仪器精密度良好。
将已知NA浓度的血样置于-20℃下存放,于1、3、5、7 d再测试其含量,考察样品放置稳定性。结果RSD=2.08%,表明血浆中NA在-20℃下至少能稳定7 d。
2.6 回收率试验
因NA为内源性物质,故用加入法测定回收率,即通过向已知浓度的样本提取液中加入一定量的NA贮备液,按“2.1”色谱条件进行测定,扣除样品中原有的含量,求出NA的加样回收率,结果见表1。
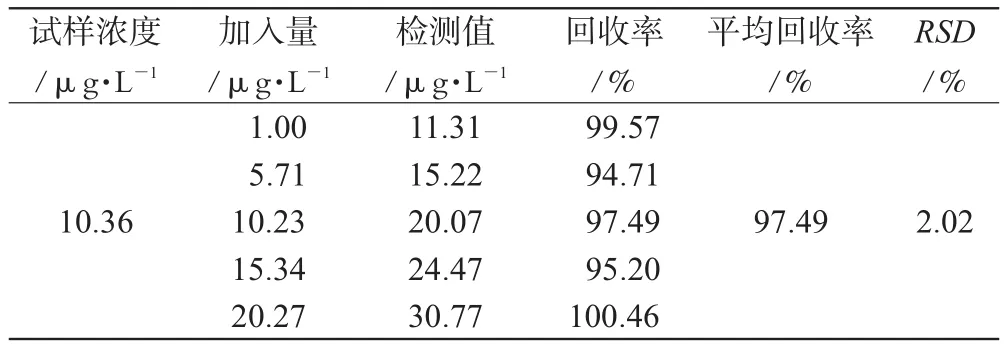
表1 加样回收率试验结果(n=5)Tab 1 Results of recovery test(n=5)
2.7 血浆样品中NA的含量测定
取各组血样按上述色谱条件进样分析,各组NA含量结果详见表2。
表2 各组血样中NA含量测定结果(±s,n=10)Tab 2 Content determination of NA in plasma of SHR of each group( ±s,n=10)

表2 各组血样中NA含量测定结果(±s,n=10)Tab 2 Content determination of NA in plasma of SHR of each group( ±s,n=10)
与模型组比较:*P<0.05,**P<0.01vs.model group:*P<0.05,**P<0.01
NA含量/μg·L-1 8.89±1.5618.03±1.8714.15±2.09**16.31±1.64*17.27±2.1511.45±2.30**组别正常对照组模型组CPFP高剂量组CPFP中剂量组CPFP低剂量组阳性对照药组
由表2可知,所建立方法不但能测定各组大鼠中NA含量,同时还表明给药9周后,与模型组比较,CPFP高剂量组、阳性对照药组NA含量显著降低(P<0.05),提示所建立的NA含量测定方法可用于高血压治疗药物的药动学研究。
3 讨论
样品处理方法的选择对测定血样中微量NA含量十分重要。文献报道[1~3]的血样的处理方法中多以氧化铝吸附法或溶剂萃取法进行提取,成本较高,步骤烦琐。本实验直接采用0.05 mol·L-1高氯酸处理样品,与其他提取法相比,操作简便、快速,且回收率高。
NA属碱性化合物,而酸性条件下碱性物质出峰时间将缩短,碱性条件下碱性物质出峰时间会延长[4],因此选择适宜pH值的流动相十分重要。本实验前期对不同pH值的磷酸盐缓冲液进行考察后,发现流动相的pH值在6.0左右最有利于样品的检测和分离。
本实验前期对NA进行紫外波长下扫描,发现NA在280 nm波长处有最大吸收峰,故选择280 nm作为检测波长。
综上所述,本方法线性、精密度、回收率良好,灵敏度高,操作简便,可用于NA的药动学及相关研究。
[1]吴燕川,冯秀丽,何士大,等.样品固相萃取及高效液相色谱法测定血浆中去甲肾上腺素[J].首都医科大学学报,2005,26(6):760.
[2]郑春梅,张惠云.大鼠血清中单胺类递质的高效液相色谱-荧光检测法分析[J].药物分析杂志,2006,26(2):215.
[3]付 敏,张东朋,马万云,等.多巴胺和5-羟色胺的毛细管电泳测定[J].分析测试学报,2002,21(2):1.
[4]谢笑龙,杨郸莉,李志梅,等.血浆儿茶酚胺的同时提取及反向高效液相测定法[J].遵义医学院学报,2005,28(4):324.

