木糖醇对糖尿病模型大鼠骨形态计量学的影响Δ
郑金亮,高秀梅,于德民,孙丽荣#
(1.天津医科大学代谢病医院,卫生部及天津市激素与发育重点实验室,天津市 300070;2.解放军第254医院,天津市 300070)
骨质疏松症(Osteoporosis,OP)因具有发病率高、高致死致残率、治疗费用高和生活质量低等特点,已成为严重的社会公共卫生问题;而糖尿病(Diabetes mellitus,DM)患者常合并OP[1]。木糖醇(Xylitol,Xy)是国内市场糖尿病食品主要甜味添加剂,有动物实验[2]显示Xy可通过增加骨质量及骨矿物成分而预防OP。为评价Xy对OP的预防作用,笔者以骨形态计量学作为评价骨静态及动态变化的综合指标(该方法也是目前国际上公认的较为可信的检验药物预防和治疗OP的方法[3]),对DM模型大鼠进行骨形态计量学特性的观察和分析,本文在此首先探讨Xy对DM大鼠骨形态计量学的影响。
1 材料与方法
1.1 动物
健康、♂Wistar大鼠48只,体质量190~220 g,3月龄,由天津市药物研究院提供(动物合格证书编号:003519)。所有大鼠均饲养于不锈钢金属笼内,每笼4~5只,室温20~24℃。12 h光照交替,摄入相同的标准固体饲料(1 kg饲料中含谷类855 g、植物蛋白60 g、动物蛋白25 g、色拉油5 g、钙(Ca)7.1 g、磷(P)2.9 g、VitD315 μg等,天津市药物研究院提供),各组摄入去离子水。
1.2 试药
Xy(北京健力药业有限公司,规格:每袋25 kg,分析纯);四氧嘧啶(美国Sigma公司,分析纯);注射用盐酸四环素(常州市动物药品厂,规格:每支0.5 g,分析纯);血清Ca、磷、碱性磷酸酶(ALP)试剂盒(天津医科大学代谢病医院提供);骨钙素(BGP)放射免疫试剂盒(北京北方生物技术研究所);甲基丙烯酸羟乙基酯、N,N-二甲基苯胺、HE和甲苯胺蓝染色试剂等(天津医科大学病理教研室提供)均为分析纯。
1.3 仪器
光学显微镜(日本Olympus公司);拜安捷血糖仪(德国拜耳公司);MPS-30荧光倒置显微镜(德国Leica公司)。
1.4 大鼠分组及处理
按分层随机区组设计分组,分为DM组和健康组,2组分别以4 mg·100 g-1四氧嘧啶和等体积的生理盐水尾静脉注射,连续3 d测血糖>16.7 mmol·L-1为DM模型成功并记为实验第1周,共计12周。24只DM大鼠再分为糖尿病对照(DC)、DM+10%Xy和DM+20%Xy组,每组8只;另将24只健康组大鼠分为正常对照(NC)、NC+10%Xy和NC+20%Xy组,每组8只。大鼠饲养参照文献[4],DC、NC组饲标准饲料,DM+10%Xy、NC+10%Xy组和DM+20%Xy、NC+20%Xy组分别饲标准饲料并添加10%及20%Xy(10%、20%是指Xy重量占标准饲料中谷类重量的百分比)。于实验第1、5、12周的第1天测尾静脉血糖。在实验第10周第7天和第12周第5天进行活体四环素标记(ip盐酸四环素50 mg·kg-1,行骨矿化标记)。12周末处死,取血测Ca、磷、ALP、BGP水平,取双侧股骨测量骨形态计量学指标。
1.5 指标测定
1.5.1 非脱钙骨切片制备。固定:将左侧股骨用水砂纸将股骨远端1/3沿纵向磨平,去除软组织并磨去前、后部分皮质,固定于70%乙醇中。脱水:70%乙醇48 h→80%乙醇48 h→95%乙醇48 h→100%乙醇48 h→丙酮48 h。包埋:骨标本在甲基丙烯酸羟乙基酯包埋液中浸润7 d,其间换液1次。浸润后在低温状态下包埋,包埋时加入聚合液,按包埋液∶聚合液50∶1比例聚合(包埋液:60 mL甲基丙烯酸羟乙基酯+12 mL聚乙二醇-400+6 g干燥过氧化苯甲酞+8 mL蒸馏水,聚合液:15 mL聚乙二醇-400+1 mL N,N-二甲基苯胺)。切片:Leica1516切片机制备5 μm、10 μm纵向切片,5 μm切片用于染色,10 μm切片直接树胶封片用于荧光显微镜观察。染色:5 μm纵向切片进行HE染色及甲苯胺蓝染色。
1.5.2 骨形态计量学参数测量。在普通光学显微镜10×10倍视野下观察HE染色及甲苯胺蓝染色切片并照相。用A-100显微镜网格、测微尺测量自骺板线远端1~3 mm范围内干骺端的骨组织静态参数,每张切片观察80个视野。以荧光显微镜观察不染色切片的四环素标记带并照相,MiaS半自动图像分析系统测定骨组织动态参数。
骨组织静态参数:骨小梁体积/全部骨组织体积(TBV/TTV,%);平均骨小梁板厚度(MTPT,μm);平均骨小梁板密度(MTPD,mm-2);平均骨小梁板间隙(MTPS,μm)。骨组织动态参数:四环素单标记表面1/2+双标记表面占骨小梁表面的百分比([Sfract(s/2+d)],%,s:单标表面,d:双标表面);四环素双标记线间的平均距离(DDL,μm);骨矿化沉积率(MiAR,μm·d-1):用2条四环素标记线之间的平均距离除以2次给药间隔天数,即每天矿化多少类骨质;骨组织水平的形成率(Svf,μm3·μm-2·d-1):单位面积骨小梁表面每天新形成的矿化骨的多少,即Svf=MiAR×[Sfract(s/2+d)]。
1.6 统计处理
2 结果
2.1 血糖
各组在不同时间段的血糖水平详见表1。
表1 各时间段血糖水平(mmol·L-1,±s,n=10)Tab 1 Level of blood glucose in different period(smmo·lL-1,±s,n=10)
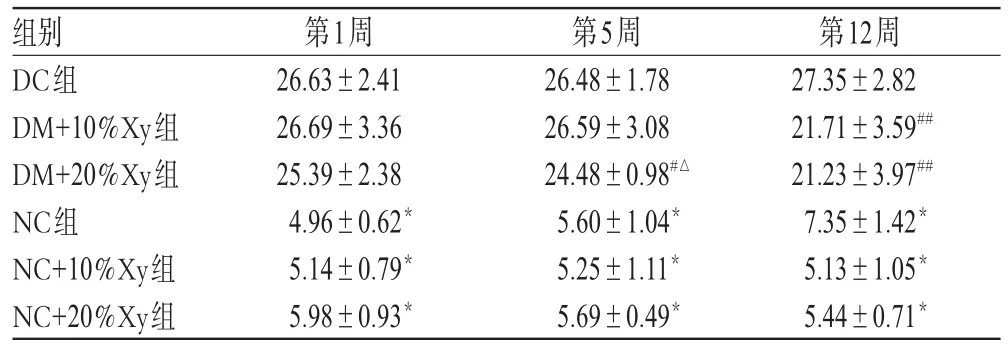
表1 各时间段血糖水平(mmol·L-1,±s,n=10)Tab 1 Level of blood glucose in different period(smmo·lL-1,±s,n=10)
与DM组比较:*P<0.001;与DC组比较:#P<0.05,##P<0.001;与DM+10%Xy组比较:△P<0.05vs.DM group:*P<0.001;vs.DC group:#P<0.05,##P<0.001;vs.DM+10%Xy group:△P<0.05
各时间段,DM各组的血糖水平均高于NC组;NC各组组间比较差异无统计学意义;第5周时,DM+20%Xy组血糖水平低于DM+10%Xy和DC组;第12周时,DM+20%Xy、DM+10%Xy组血糖水平均显著低于DC组。
2.2 血清Ca、磷、ALP和BGP水平
实验第12周时各组血清Ca、磷、ALP和BGP水平结果见表2。
表2 各组血清Ca、磷、ALP、BGP水平结果(±s,n=8)Tab 2 Level of calcium,phosphorus,ALP and BGP in serum of those groups(±s,n=8)
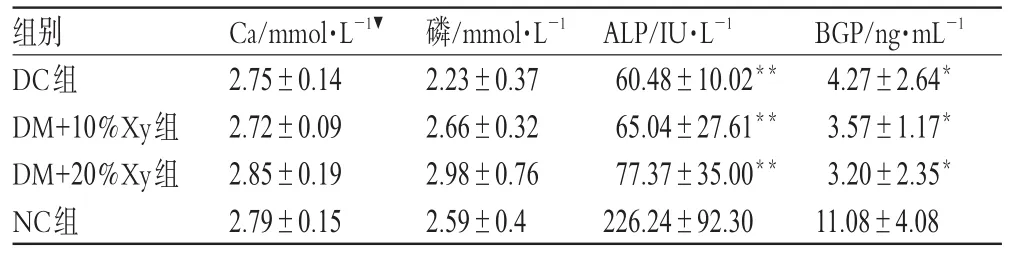
表2 各组血清Ca、磷、ALP、BGP水平结果(±s,n=8)Tab 2 Level of calcium,phosphorus,ALP and BGP in serum of those groups(±s,n=8)
▼结果经对数转换后行单因素方差分析。与NC组比较:*P<0.05,**P<0.001▼single factor variance analysis was used after log transformation.vs.NC group:*P<0.05,**P<0.001
BGP/ng·mL-1 4.27±2.64*3.57±1.17*3.20±2.35*11.08±4.08组别DC组DM+10%Xy组DM+20%Xy组NC组Ca/mmol·L-1▼2.75±0.142.72±0.092.85±0.192.79±0.15磷/mmol·L-1 2.23±0.372.66±0.322.98±0.762.59±0.4 ALP/IU·L-1 60.48±10.02**65.04±27.61**77.37±35.00**226.24±92.30
由表2可见,实验第12周,Ca、磷水平各组间比较差别无统计学意义;与NC组比较,DC组、DM+10%Xy组、DM+20%Xy组ALP、BGP水平更低(P<0.05或P<0.001)。
2.3 骨形态计量学参数
2.3.1 静态参数。实验12周时各组静态参数比较结果见表3。
表3 静态参数结果(±s,n=8)Tab 3 Data of static parameter(±s,n=8)

表3 静态参数结果(±s,n=8)Tab 3 Data of static parameter(±s,n=8)
与DC组比较:*P<0.05;与DM+10%Xy组比较:#P<0.05vs.DC group:*P<0.05;vs.DM+10%Xy group:#P<0.05
组别DC组DM+10%Xy组DM+20%Xy组NC组MTPS/μm 34.52±8.0935.39±6.0828.26±7.7924.64±6.05#MTPD/mm-2 0.51±0.350.64±0.350.92±0.22*#0.84±0.23 MTPT/μm 28.51±4.8329.50±3.4133.26±3.3633.09±3.57 TBV/TTV/%34.63±11.1530.54±5.8135.04±4.6940.28±4.55
表3结果表明,实验12周时,DM+20%Xy组的MTPD水平高于DC组和DM+10%Xy组;与NC组比较,DM+10%Xy组MTPS水平更高。各组间MTPT与TBV/TTV比较无差别。
2.3.2 动态参数。实验12周时各组动态参数比较结果见表4。
表4 动态参数结果(±s,n=8)Tab 4 Data of dynamic parameter(±s,n=8)

表4 动态参数结果(±s,n=8)Tab 4 Data of dynamic parameter(±s,n=8)
▲结果经对数转换后行单因素方差分析。与DC组比较:*P<0.01;与DM+10%Xy组比较:#P<0.05▲single factor variance analysis was used after log transformation.vs.DC group:*P<0.01;vs.DM+10%Xy group:#P<0.05
Svf▲/μm3·μm-2·d-1 91.74±60.4497.54±48.01261.45±204.63*#292.05±194.96*#组别DC组DM+10%Xy组DM+20%Xy组NC组Sfract(s/2+d)/%178.81±153.84127.01±44.80290.55±235.69272.52±134.87 DDL/μm 9.25±2.9211.36±3.0314.07±2.95*#15.32±3.21*#MiAR/μm·d-1 0.61±0.190.74±0.200.92±0.19*#1.00±0.21*#
由表4可见,实验第12周时,与DC和DM+10%Xy组比较,DM+20%Xy组DDL、MiAR和Svf水平更高;与NC组比较,DC和DM+10%Xy组DDL、MiAR和Svf水平更低;DM+20%Xy组与NC组之间比较无差别。
2.4 骨切片形态学
各组骨切片经不同染色法及在不同条件下观察结果详见图1。

图1 各组骨组织图片(×100)Fig 1 Photogram of bone tissue of those groups(×100)
由图1可见,DC组骨小梁数目减少、稀疏断裂、表面四环素标记线少、网状结构消失;DM+10%Xy组骨小梁表面四环素标记线增加;DM+20%Xy组、NC组骨小梁表面可见四环素单标、双标线,骨小梁连接性升高,骨矿化加快,骨组织黏附性形成增加,骨重建活跃,骨小梁增厚,骨质量增加。
3 讨论
Xy是一种五碳糖醇,甜度与蔗糖相当,在中国市场上的DM食品中主要作为蔗糖的替代品,多利用植物纤维人工合成。摄入的外源性Xy经细胞浆中Xy脱氢酶催化转变成D-木酮糖,进入磷酸戊糖旁路,此后与内源性Xy代谢途径一致。Xy进入细胞时不需要胰岛素,还可刺激胰岛素分泌及抑制脂肪酸合成,降低血中游离脂肪酸及丙酮酸[5]。本研究显示Xy可降低DM大鼠的血糖,可能与其刺激胰岛素分泌有关[6],而对正常大鼠的血糖未见影响。
以往的研究多注重Xy对血糖的影响,而其与OP的相关性几乎未见报道。OP是常见的代谢性骨病,DM患者常合并OP,而 DM 也能导致和加重 OP[1,7]。研究表明[3,4,8],Xy 可改善骨代谢,其机制可能为Xy通过改善糖代谢而减少糖基化终末产物,从而减轻糖化、氧化对成骨细胞和骨细胞的损伤;在体内Xy代谢所产生的NAD(P)H(还原型辅酶Ⅰ/Ⅱ),为氧化呼吸链的能量转运位点NAD(P)H-泛醌还原酶供氢,以及时为骨钙摄取提供能量,促进骨的早期矿化及胶原合成;Xy还可经旁细胞途经增加肠钙吸收。
本研究中DM大鼠血清Ca、磷未见明显变化,且Xy对DM模型大鼠血清Ca、磷无明显影响,可能与血清Ca、磷水平受多因素调节有关。血清Ca、磷浓度正常原因可能为高血糖状态引起Ca、磷摄入减少丢失增加,血Ca下降,甲状旁腺激素(PTH)分泌增加(继发性甲状旁腺功能亢进),动员大量的骨Ca入血,从而维持血Ca、磷在正常水平。如果结合骨Ca、磷水平测定更有助于评价骨代谢变化。本研究显示:DM各组血清ALP、BGP低于NC组,提示DM大鼠骨形成减少及骨转换率降低,与以往研究一致[9]。Xy未引起模型大鼠血清ALP、BGP的变化,这可能与ALP、BGP作为骨代谢指标的特异性、灵敏度均不高,肝脏、肾脏等疾病均会导致其变化有关。
骨组织形态计量学技术可定量观察到骨吸收活性与新生骨的成骨速率,是研究OP诊断及药物疗效的最重要手段之一。本研究结合活体四环素标记,可观察到新骨生长、矿化和骨吸收的动态过程,定量获得骨细胞水平及组织水平的信息[10]。在荧光下可见其单标记线和双标记线,双标记说明2次给予四环素时恰好处于骨再建周期的骨形成中,单标记则说明其中一次出现四环素沉积,而另一次给予四环素时恰好处于骨形成开始之前或结束之后,因而未能出现沉积。四环素单标记或双标记增多,均是骨再建活跃的标志,可直观地反映骨形成和新骨生长的情况。四环素的沉积关键取决于吸收量,成骨活性及血流量,所以它是评估成骨活性、量及骨重建活性的重要方法。实验第12周结果显示:(1)MTPS:与NC组比较,DC组更高,说明DM致骨小梁彼此之间分离程度加大,结构松散。(2)MTPD:与DC组、DM+10%Xy组比较,DM+20%Xy组更高,说明高剂量Xy可使DM模型大鼠骨小梁变厚,密度增加。(3)DDL:与NC组比较,DC组更低;与DC组比较,DM+20%Xy组更高;由于DDL表示骨矿化程度,这表明DM可使大鼠出现骨矿化不良,而Xy可改善这一过程。(4)MiAR:与NC组比较,DC组更低;与DC组比较,DM+20%Xy组更高。说明高剂量Xy可增加DM模型大鼠骨矿化沉积速率。(5)Svf:与NC组比较,DC组更低;与DC组比较,DM+20%Xy组更高。由于Svf代表组织水平的骨形成速率,取决于骨再建激活频率、成骨细胞功能和寿命,以及与矿化有关的因素。结果表明DC、DM+10%Xy组大鼠发生了低转换型OP,即骨吸收和骨形成均减少,骨吸收大于骨形成,骨量减少;具体表现为骨矿化减少、骨小梁变薄、彼此分离程度加大、结构松散;对DM大鼠而言,高剂量Xy可提高新骨矿化速率及组织水平骨形成率,增加骨小梁厚度、密度,使其结构紧凑,从而改善DM引起的骨小梁稀疏、断裂、立体网状结构的消失。这与Mattila等[2,11]研究结果相似。这可能与上述Xy增加肠Ca吸收,促进胰岛素分泌,降低DM大鼠血糖,从而减轻糖化、氧化对骨的细胞及胶原损伤,增加新骨矿化及胶原量等有关。
本研究中,Wistar大鼠的骨骼解剖结构和骨代谢情况与人类十分相似,也有骨丢失和骨重建,对各种致病因素和治疗药物的反应与人类基本一致,为排除雌激素及增龄的影响,本实验选取3月龄、♂Wistar大鼠制成DM模型,并在DM及健康大鼠的标准饲料中添加不同剂量的Xy喂饲3个月,观察Xy对DM及健康大鼠骨代谢的影响,分析其作用机制并找出剂量反应关系。由于科研经费不足和时间限制,只对NC+10%Xy和NC+20%Xy组进行了血糖测定,而其他指标则暂时未能进行测定,将在后续的研究中陆续补充。
综上所述,DM大鼠出现了骨形成、骨转换和骨形态计量学异常,而Xy可降低DM大鼠的血糖水平,增加其骨矿物质含量及改善骨小梁结构,对预防和治疗OP有一定作用,且此作用可能存在剂量依赖关系。
[1]Dominguez LJ,Muratore M,Quarta E,et al.Osteoporosis and diabetes[J].Reumatismo,2004,56(4):235.
[2]Mattila PT,Svanberg MJ,Knuuttila ML,et al.Increased bone volume and bone mineral content in xylitol-fed aged rat[J].Gerontology,2001,47(6):300.
[3]廖二元,谭利华主编.代谢性骨病学[M].第1版.北京:人民卫生出版社,2003:474~481.
[4]Svanberg M,Mattila P,Knuuttila M,et al.Dietary xylitol retards the ovariectomy-induced increase of bone turnover in rats[J].Calcif Tissue Int,1997,60(5):462.
[5]Jakob A,Williamson JR,Asakura T.Xylitol metabolism in perfused rat liver.Interactions with gluconeogenesis and ketogenesis[J].Biol Chem,1971,246(24):7623.
[6]陈军华,杨 柳,万喜英.木糖醇对糖尿病病人血糖与胰岛素释放的影响[J].护理学杂志,2002,17(8):625.
[7]Yamagishi S,Nakamura K,Inoue H,et al.Possible participation of advanced glycation end products in the pathogenesis of osteoporosis in diabetic patients[J].Med Hypotheses,2005,65(6):1013.
[8]Svanberg M,Knuuttila M.The effect of dietary xylitol on recalcifing and newly formed cortical long bone in rats[J].Calcif Tissue Int,1993,53(2):135.
[9]Knuuttila M,Kuoksa TH,Svanberg M,et al.Effects of dietary xylitol on collagen content and glycosylation in healthy and diabetic rats[J].Life Sci,2000,67(3):283.
[10]Parfitt AM,Drezner MK,Glorieux FH,et al.Bone histomorphometry:standardization of nomenclature,symbols and units.Report of the ASBMR Histomorphometry Nomenclature Committee[J].Bone Miner Res,1987,2(6):595.
[11]Mattila P,Svanberg M,Knuuttila M.Diminished bone resorption in rats after oral xylitol administration:A dose-response study[J].Calcif Tissue Int,1995,56(3):232.

