日本血吸虫Sj22.6-LHD-Sj23融合基因的克隆及原核表达
付 媛,卢福庄,石团员,顾 昀,俞国乔,陆国林,张雪娟*
(1.浙江省农业科学院畜牧兽医研究所,浙江 杭州 310021;2.浙江省畜牧兽医局,浙江 杭州 310020)
日本血吸虫病是一种危害严重的人畜共患病,可引起肝脏、肠道以及其他器官的损伤,严重时导致宿主死亡。血吸虫病的诊断在家畜血吸虫病防治中具有重要的作用,寻找制备和纯化较方便的高敏感性、特异性诊断抗原一直是人们研究的重点。基因重组抗原因其具有这些特点而备受关注。随着分子生物学的发展,通过人工合成或重叠延伸等方法将几个不同来源的基因片段相互连接,构成不同蛋白质之间的融合体,可能体现所有来源蛋白质的活性和功能,甚至可能获得协同效应[9]。目前,日本血吸虫(Schistosoma japonicum)重组蛋白已经用于家畜日本血吸虫病的诊断研究。膜相关蛋白Sj22.6ku和Sj23大亲水区多肽(LHD-Sj23)都具有良好的抗原性,已应用于日本血吸虫的免疫学诊断[1-4]。Sj22.6ku抗原基因是由Stein等从曼氏血吸虫cDNA文库中筛选出来,并证实其编码蛋白分子存在于童虫和成虫表膜[5]。Davern等从菲律宾株日本血吸虫文库中获得Sj23基因,并证实Sj23抗原与人的一些膜蛋白结构相似[6]。Sj23抗原基因全长片段原核表达困难,而LHD-Sj23已在pGEX载体系统中与GST融合表达[3],并应用于牛羊血吸虫病的诊断[4]。由于LHD-Sj23片段只有62个氨基酸,理论上其大小约为6.7 ku,单独表达的蛋白不利于纯化和后续操作。本研究利用重叠延伸PCR技术对这两个基因片段进行融合,将构建的重组表达质粒转入E.coli RosettaDE3中表达,通过亲和纯化的方法,首次获得融合蛋白Sj22.6-LHD-Sj23,western blot试验证明该融合蛋白具有良好的抗原性,但与两个单独的重组蛋白Sj22.6ku和LHD-Sj23相比抗原性如何,还有待于进一步研究。本研究为家畜日本血吸虫病血清抗体检测方法的建立奠定了基础。
1 材料和方法
1.1 虫株、质粒和细菌株 日本血吸虫虫株由浙江省医学科学院提供;pET28原核表达载体、E.coli DH5α为本实验室保存;E.coliRosetta(DE3)感受态细胞购自北京全式金生物技术有限公司;pMD18-T载体购自宝生物工程(大连)有限公司。
1.2 主要试剂 小量质粒抽提试剂盒和DNA胶回收试剂盒购自上海生工生物工程技术服务有限公司;DNA Marker、各种限制性内切酶及连接酶购自TaKaRa公司;TRIzol和亲和层析Ni-NTA Argrose Beads购自Invitrogen公司;RT-PCR试剂盒购自promega公司;HRP标记protein A购自Calbiochem公司。
1.3 引物设计与合成 按照GenBank中登录的日本血吸虫Sj22.6ku和LHD-Sj23基因序列,参照文献[3、7],用Primer5.0软件辅助设计扩增日本血吸虫膜蛋白Sj22.6ku和LHD-Sj23基因的PCR引物对SF1/SLR2和 SlP1/SP2(表 1)。Sj22.6ku基因片段的上游引物SF1含有EcoRⅠ限制性酶切位点和保护性碱基,下游引物SLR2去除了Sj22.6ku基因末端的终止密码子TAG,并插入一段柔性氨基酸编码序列(ATCCTCAGAGCCTCCGCCACC);LHD-Sj23 基 因片段的上游引物SLP1中包含与SLR2引物相配对的柔性氨基酸编码序列(GGTGGCGGAGGCTCTGAGG AT),下游引物SP2含有SalⅠ酶切位点和保护性碱基。引物均由上海英俊生物科技公司合成。
1.4 RT-PCR扩增Sj22.6ku基因和LHD-Sj23基因 取日本血吸虫虫体约100 mg,按照TRIzol试剂操作说明提取总RNA,用SF1/SLR2引物对扩增Sj22.6ku基因序列,用SLP1/SP2引物对扩增LHDSj23基因序列。

表1 PCR引物的名称和序列Table 1 Names and sequences of PCR primers
反转录条件如下:42℃ 45 min,94℃ 2 min,反应产物作为模板进行PCR反应。扩增Sj22.6ku基因序列PCR反应条件如下:94℃ 30 s、55℃1 min、72℃ 1 min,32个循环;72℃ 10 min。扩增LHD-Sj23基因序列PCR反应条件为:94℃30 s、55℃1 min、72℃30 s,32个循环;72℃10 min。
1.5 Sj22.6-LHD-Sj23基因序列扩增 将两者的PCR产物分别稀释后做模板,以引物对SF1/SP2扩增Sj22.6-LHD-Sj23基因。PCR反应条件为:94℃30 s、55℃ 1 min、72℃ 1 min,32个循环;72℃10 min。产物经0.8%琼脂糖凝胶电泳检测。
1.6 pMD18-Sj22.6-LHD-Sj23重组表达质粒的构建将PCR产物从0.8%琼脂糖凝胶中回收,具体操作按胶回收试剂盒说明进行。产物连接到pMD18-T载体中,转化E.coliDH5α中,在氨苄平板上筛选白色菌落,提取重组质粒,用EcoRⅠ和SalⅠ双酶切鉴定。
将重组质粒pMD18-Sj22.6-LHD-Sj23和表达载体pET28分别用限制性内切酶EcoRⅠ和SalⅠ酶切,Sj22.6-LHD-Sj23基因片段与pET28连接,将连接产物转化E.coliDH5α感受态细胞,提取质粒,用EcoRⅠ和SalⅠ双酶切鉴定重组子。鉴定正确的质粒由上海英骏生物科技公司测序。测序结果与理论拼接序列比对分析。
1.7 pET28-Sj22.6-LHD-Sj23在E.coliRosetta(DE3)中的诱导表达以及表达条件的优化 将测序正确重组质粒pET28-Sj22.6-LHD-Sj23转化E.coliRosetta(DE3),诱导表达程序按照pET系统操作手册进行。以SDS-PAGE电泳检测分析。
将重组菌电泳检测,37℃振荡培养至对数生长期,加入IPTG至终浓度为0.8 mM进行诱导,37℃继续培养,分别在0 h、0.25 h、0.5 h、1 h、2 h、3 h、4 h、5 h和6 h以及30℃诱导6 h后分别取菌液进行SDS-PAGE电泳分析。
1.8 表达产物的纯化和western blot检测 取大量诱导表达后的菌液100 mL,4℃ 8000 r/min离心5 min,4℃收集菌体,加入细胞裂解液,并用超声波破碎菌体收集包涵体蛋白,Ni-NTA亲和层析柱中纯化,经含250 mmol/L咪唑的洗脱缓冲液洗脱后,收集融合蛋白Sj22.6-LHD-Sj23,PBS透析脱盐处理后经SDS-PAGE鉴定其纯度。Western blot检测方法参照文献[7],人工感染日本血吸虫45 d的牛阳性血清作为一抗(1∶150稀释),protein A HRP作为二抗(1∶5000)稀释,以DAB为底物显色。
2 结果与讨论
2.1 日本血吸虫Sj22.6ku和LHD-Sj23基因的克隆 以日本血吸虫成虫虫体总RNA为模板,RT-PCR扩增Sj22.6ku和LHD-Sj23基因,PCR产物经琼脂糖凝胶电泳显示扩增片段分别约为600 bp和200 bp(图 1)。
2.2 日本血吸虫融合蛋白Sj22.6-LHD-Sj23基因的克隆及重组质粒pET28-Sj22.6-LHD-Sj23的构建PCR产物经琼脂糖凝胶电泳显示扩增片段为约807 bp(图 2),将其与 pMD18-T载体连接;重组质粒pMD18-Sj22.6-LHD-Sj23和表达载体pET28a酶切,将外源片段与pET28a载体回收连接,连接产物转化感受态细胞,用EcoRⅠ和SalⅠ双酶切鉴定,结果表明得到约为5000 bp的载体片段和约800 bp的融合蛋白基因片段。完整融合蛋白基因的ORF与理论拼接结果比对显示,有两个碱基发生突变:35 bp处和711 bp处的A突变成了G,其推导氨基酸序列由天冬氨酸突变为甘氨酸,而711 bp处碱基为同义突变。
2.3 Sj22.6-LHD-Sj23融合蛋白的诱导表达和表达条件的优化及蛋白纯化 将阳性重组菌pET28-Sj22.6-LHD-Sj23/Rosetta(DE3)经 IPTG诱导后进行SDS-PAGE电泳分析,可在约35 ku处见到表达的融合蛋白(图3),而对照的未诱导菌株无该表达条带。融合蛋白Sj22.6-LHD-Sj23理论值大小为30 ku,实际SDS-PAGE电泳结果为35 ku,可能是pET28载体系统中融合蛋白有组氨酸标签,唐威华等证实组氨酸标签确实是造成偏差的原因之一[8],推测由于组氨酸标签中的碱性氨基酸的作用造成蛋白在SDS-PAGE电泳中迁移变慢,而导致偏差。同时,进行SDS-PAGE电泳时蛋白的净电荷会影响迁移率。带电量高的蛋白会结合较少的SDS,因此阻碍了蛋白的泳动,所以融合蛋白的电泳结果比理论值略大。

图1 日本血吸虫Sj22.6和LHD-Sj23基因的RT-PCR扩增产物Fig.1 Amplification of S.japonicumSj22.6ku and LHD-Sj23 genes by RT-PCR
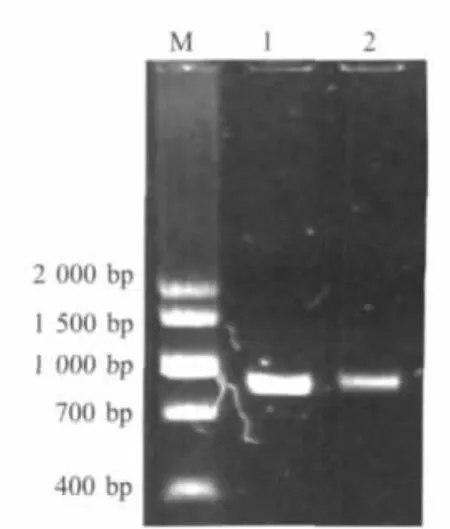
图2 日本血吸虫Sj22.6-LHD-Sj23基因的PCR扩增产物Fig.2 Amplification of S.japonicum Sj22.6-LHD-Sj23 gene by PCR
经Quantity ONE软件分析显示融合蛋白表达产物约占菌体总蛋白的28%。经可溶性分析试验表明,该重组蛋白主要以包涵体的形式存在。表达条件优化后重组菌在30℃,0.8 mmol/L IPTG诱导6 h的情况下,Sj22.6-LHD-Sj23融合蛋白的表达显著,在此条件下扩大诱导,收集菌体提取包涵体蛋白。融合蛋白经Ni-NTA纯化,纯化后的蛋白具有较高的纯度(图 4)。
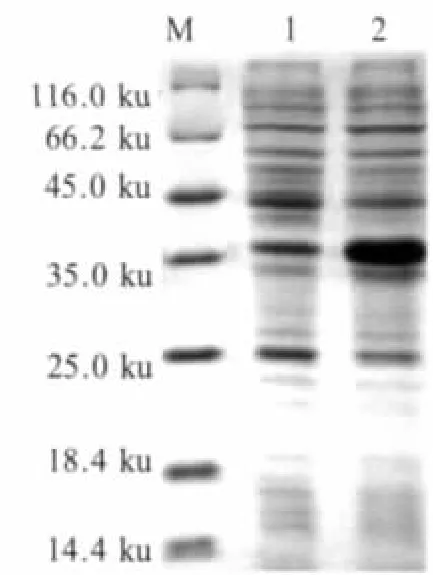
图3 融合蛋白Sj22.6-LHD-Sj23的SDS-PAGE分析Fig.3 Analysis of Sj22.6-LHD-Sj23 fusion protein expression with SDS-PAGE
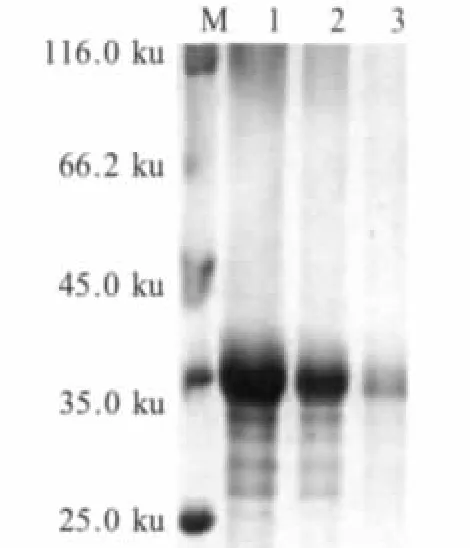
图4 SDS-PAGE分析融合蛋白Sj22.6-LHD-Sj23的纯化Fig.4 Analysis of purified fusion protein Sj22.6-LHD-Sj23 with SDS-PAGE
2.4 Western blot检测融合蛋白的抗原性 将纯化后的融合蛋白Sj22.6-LHD-Sj23进行western blot分析,结果表明,在约35 ku处可见明显的反应带,表明融合蛋白可被日本血吸虫阳性牛血清识别,与阴性血清无反应,证明融合蛋白有良好的反应活性。
[1]张桂筠,张兆松,陈淑贞,等.日本血吸虫中国大陆株基因重组抗原Sj22.6ku的免疫学活性鉴定[J].中国寄生虫学与寄生虫病杂志,1998,(1):6-10.
[2]余传信,朱荫昌,殷旭仁,等.日本血吸虫(大陆株)23 ku分子(SjC23)大亲水肽段(HD)在pGEX-5X-1中表达[J].实用寄生虫病杂志,2000,(4):145-147.
[3]林矫矫,Huggins M C,Bickle Q D,等.中国大陆株日本血吸虫23 ku基因重组抗原的研究-23 ku抗原大亲水区多肽基因重组抗原的制备及抗原性测定[J].中国兽医科技,1995,(5):21-23.
[4]林娇娇,李浩,陆珂,等.应用Sj23基因重组抗原诊断牛、羊血吸虫病研究[J].畜牧兽医学报,2003,34(5):506-508.
[5]Stein L D,David J R.Cloning of a developmentally regulated tegument antigen of Schistosoma mansoni[J].Mol Biochem Parasitol,1986,20(3):253-264
[6]Davern K M,Wright M D,Vanessa R,et al.Further characterisation of theSchistosoma japonicumprotein Sj23,a target antigen of an immunodiagnostic monoclonal antibody[J].Mol Biochem Parasitol,1991,48(1):67-75.
[7]付媛,张雪娟,赵俊龙,等.日本血吸虫22.6 ku膜相关蛋白基因的克隆及原核表达[J].华中农业大学学报,2007,26(3):357-360.
[8]唐威华,张景六,王宗阳,等.SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J].植物生理学报,2000,26(1):64-68.
[9]章辉,朱荫昌,司进,等.日本血吸虫复合B细胞表位抗原的制备和鉴定[J].中国寄生虫学与寄生虫病杂志,2007,25(4):285-290.

